의약품 제조업체: Amneal Pharmaceuticals LLC (Updated: 2023-11-17)
처방 정보 주요 사항
LINEZOLID 정제, 경구 투여
최근 주요 변경 사항
경고 및 주의사항, 골수억제(5.1) 7/2023
적응증 및 용법
Linezolid 정제는 내성 그람 양성균에 의해 유발되는 다음 감염 치료를 위해 성인 및 소아에게 사용되는 oxazolidinone 계열의 항생제입니다: 병원 내 폐렴(1.1), 지역사회 획득 폐렴(1.2), 복잡한 피부 및 피부구조 감염(동반된 골수염 제외), 당뇨병성 족부감염 포함(1.3), 단순 피부 및 피부구조 감염(1.4), 반코마이신 내성 Enterococcus faecium 감염. (1.5)
사용 제한 사항(1.6):
- Linezolid 정제는 그람 음성균 감염 치료에 적응증이 없습니다.
- 28일 이상 linezolid 제형을 투여한 안전성 및 효능은 대조 임상시험에서 평가되지 않았습니다.
내성균 발생을 줄이고 linezolid 제형 및 다른 항생제의 효능을 유지하기 위해, linezolid 정제는 세균 감염이 확인되거나 강력하게 의심되는 경우에만 치료 또는 예방 목적으로 사용해야 합니다. (1.7)
투여 용량 및 투여 방법
| 투여 용량, 투여 경로, 투여 횟수 | |||
| 감염 |
소아 환자 (2) (출생 ~ 11세) |
성인 및 청소년 (2) (12세 이상) |
투여 기간 (2) (일) |
| 병원 내 폐렴 | 8시간마다 10mg/kg 경구 투여 | 12시간마다 600mg 경구 투여 | 10 ~ 14 |
| 지역사회 획득 폐렴, 동반 균혈증 포함 | |||
| 복잡한 피부 및 피부구조 감염 | |||
| 반코마이신 내성 Enterococcus faecium 감염, 동반 균혈증 포함 | 8시간마다 10mg/kg 경구 투여 | 12시간마다 600mg 경구 투여 | 14 ~ 28 |
| 단순 피부 및 피부구조 감염 |
5세 미만: 8시간마다 10mg/kg 경구 투여 (2)
|
성인: 경구 12시간마다 400 mg 청소년: 경구 12시간마다 600 mg | 10~14일 |
제형 및 강도
- 정제: 리네졸리드 600 mg (3)
경고 및 주의사항
- 골수억제: 매주 전혈구 검사 실시. 중증 신장애 환자와 중등증~중증 간장애 환자에서 혈소판감소증이 보고됨. 골수억제가 발생하거나 악화되는 환자에서 투약 중단 고려 (5.1)
- 말초 및 시신경 병증: 주로 28일 이상 투약 시 발생 보고됨. 시력 장애 증상이 있는 경우 신속한 안과 검진 권고 (5.2)
- 세로토닌 증후군: 항우울제 및 마약성진통제 등 세로토닌 작용 약물 병용 시 세로토닌 증후군 증상 모니터링. 다른 치료법이 없는 경우에만 항우울제와 병용 투여. 항우울제 투여 중단 후 세로토닌 증후군과 항우울제 중단 증상 모니터링 (5.3)
- 리네졸리드 투여군에서 카테터 관련 혈류 감염 연구 시 사망률 불균형 관찰됨 (5.4)
- Clostridioides difficile 관련 설사: 설사 발생 시 평가 (5.5)
- 혈압 상승 가능 상호작용: 혈압 모니터링 (5.6)
- 저혈당: 인슐린 또는 경구 혈당강하제 투여 당뇨 환자에서 증상성 저혈당 사례 시판 후 보고됨 (5.9)
- 저나트륨혈증 및/또는 부적절한 항이뇨호르몬 분비증후군(SIADH): 저나트륨혈증 및/또는 SIADH 위험 환자에서 정기적 혈청 나트륨 수치 모니터링 (5.10)
이상반응
성인 및/또는 소아 환자에서 리네졸리드 투여 시 5% 이상 발생한 가장 흔한 이상반응: 설사, 구토, 두통, 구역, 빈혈 (6)
의심되는 이상반응은 Amneal Pharmaceuticals 1-877-835-5472 또는 FDA 1-800-FDA-1088 또는 www.fda.gov/medwatch로 보고하십시오.
환자 상담 정보는 17번 항목 참조
개정: 2023년 11월
목차
전체 처방 정보: 목차*
1 적응증 및 사용법
1.1 원내 폐렴
1.2 지역사회 획득성 폐렴
1.3 복잡성 피부 및 피부 구조 감염
1.4 비복잡성 피부 및 피부 구조 감염
1.5 Vancomycin 내성 Enterococcus faecium 감염
1.6 사용 제한
1.7 사용법
2 용법 및 투여 방법
2.1 일반적 용법 및 투여
3 제형 및 함량
4 금기
4.1 과민반응
4.2 모노아민 산화효소 억제제
5 경고 및 주의사항
5.1 골수 억제
5.2 말초 및 시신경병증
5.3 세로토닌 증후군
5.4 카테터 부위 감염을 포함한 카테터 관련 혈류 감염 환자를 대상으로 한 연구에서의 사망률 불균형
5.5 Clostridioides difficile 관련 설사
5.6 잠재적 혈압 상승 상호작용
5.7 젖산 산증
5.8 경련 발작
5.9 저혈당
5.10 저나트륨혈증 및/또는 부적절한 항이뇨 호르몬 분비 증후군(SIADH)
5.12 내성균 발생
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 모노아민 산화효소 억제제
7.2 아드레날린성 및 세로토닌성 제제
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.3 가임기 여성 및 남성
8.4 소아 사용
8.5 노인 사용
10 과량 투여
11 설명
12 임상약리
12.1 작용기전
12.2 약력학
12.3 약동학
12.4 미생물학
13 비임상 독성
13.1 발암성, 변이원성, 생식능력 장애
13.2 동물 독성학 및/또는 약리학
14 임상시험
14.1 성인
14.2 소아 환자
16 공급/보관 및 취급 방법
16.2 정제
16.4 보관 및 취급
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
1.1 원내폐렴
Linezolid 정제는 Staphylococcus aureus (methicillin 감수성 및 내성 균주) 또는 Streptococcus pneumoniae로 인한 원내폐렴 치료에 사용됩니다 [임상연구 (14) 참조].
1.2 지역사회획득폐렴
Linezolid 정제는 혈액 감염을 동반한 경우를 포함하여, Streptococcus pneumoniae 또는 Staphylococcus aureus (methicillin 감수성 균주에 한함)으로 인한 지역사회획득폐렴 치료에 사용됩니다 [임상연구 (14) 참조].
1.3 복잡성 피부 및 연조직 감염
Linezolid 정제는 골수염을 동반하지 않은 당뇨병성 족부 감염을 포함하여, Staphylococcus aureus (methicillin 감수성 및 내성 균주), Streptococcus pyogenes, 또는 Streptococcus agalactiae로 인한 복잡성 피부 및 연조직 감염 치료에 사용됩니다. Linezolid 정제는 욕창 궤양 치료에 대해 연구된 바 없습니다 [임상연구 (14) 참조].
1.4 비복합성 피부 및 연조직 감염
Linezolid 정제는 Staphylococcus aureus (methicillin 감수성 균주에 한함) 또는 Streptococcus pyogenes로 인한 비복합성 피부 및 연조직 감염 치료에 사용됩니다 [임상연구 (14) 참조].
1.5 Vancomycin 내성 Enterococcus faecium 감염
Linezolid 정제는 혈액 감염을 동반한 경우를 포함하여, vancomycin 내성 Enterococcus faecium 감염 치료에 사용됩니다 [임상연구 (14) 참조].
1.6 사용 제한
- Linezolid 정제는 그램음성균 감염 치료에 사용되지 않습니다. 동반된 그램음성균 병원체가 확인되거나 의심되는 경우 즉시 특정 그람음성균 치료를 시작하는 것이 중요합니다 [경고 및 주의사항 (5.4) 참조].
- Linezolid 제제를 28일 이상 투여했을 때의 안전성과 유효성은 대조 임상시험에서 평가되지 않았습니다 [임상연구 (14) 참조].
1.7 용법
약제 내성균의 발현을 줄이고 linezolid 정제 및 기타 항균제의 효과를 유지하기 위해, linezolid 정제는 감수성 세균에 의해 발생한 것으로 확인되었거나 강력하게 의심되는 감염증의 치료 또는 예방에만 사용해야 합니다. 배양 및 감수성 정보가 가용한 경우, 이를 항균 치료 선택 또는 수정 시 고려해야 합니다. 이러한 데이터가 없는 경우에는 지역 내 역학 및 감수성 패턴이 경험적 치료법 선택에 도움이 될 수 있습니다.
2 용법 및 투여
2.1 일반 용량 및 투여
감염 치료를 위한 linezolid 제형의 권장 용량은 표 1에 설명되어 있습니다.
표 1. Linezolid 정제의 용량 지침
|
감염* |
용량, 투여 경로 및 빈도 |
권장 치료 기간 |
|
|
소아 환자† (출생부터 11세까지) |
성인 및 청소년 (12세 이상) |
||
|
원내 폐렴 |
10 mg/kg 경구‡ |
600 mg 경구‡ 매 12시간 |
10 to 14 |
|
동반된 균혈증을 포함한 지역사회 획득 폐렴 |
|||
|
복잡한 피부 및 피부 구조 감염 |
|||
|
동반된 균혈증을 포함한 vancomycin 내성 Enterococcus faecium 감염 |
10 mg/kg 경구‡ |
600 mg 경구‡ 매 12시간 |
14 to 28 |
|
단순 피부 및 피부 구조 감염 |
5세 미만: 10 mg/kg 경구‡ 매 8시간 5-11세: 10 mg/kg 경구‡ 매 12 시간 |
성인: 400 mg 경구‡ 매 |
10 to 14 |
|
* 지정된 병원체로 인한 것임 [적응증 및 사용법(1) 참조]. †7일 미만의 신생아: 7일 미만의 대부분의 미숙아(재태연령 34주 미만)는 만삭아 및 연장아에 비해 linezolid 전신 청소율이 낮고 AUC 값이 높습니다. 이러한 신생아는 12시간마다 10mg/kg의 용량 요법으로 시작해야 합니다. 임상 반응이 불충분한 신생아의 경우 8시간마다 10mg/kg 용량을 사용하는 것을 고려할 수 있습니다. 모든 신생아 환자는 생후 7일까지 8시간마다 10mg/kg을 투여해야 합니다 [특정 집단에서의 사용(8.4) 및 임상약리학(12.3) 참조]. ‡ Linezolid 정제를 사용한 경구 투여 [공급/보관 및 취급 방법(16) 참조]. |
|||
정맥 투여에서 경구 투여로 전환할 때 용량 조정은 필요하지 않습니다.
3 제형 및 함량
Linezolid 600 mg 정제: 흰색에서 미백색을 띠는 변형된 캡슐 모양의 필름코팅정제로, 한 면에는 “AN 777″이 새겨져 있고 다른 면은 평평합니다.
4 금기 사항
4.2 Monoamine Oxidase 억제제
Linezolid는 monoamine oxidases A 또는 B를 억제하는 약물(예: phenelzine, isocarboxazid)을 복용하는 환자 또는 이러한 약물을 복용한 지 2주 이내의 환자에게 사용해서는 안 됩니다.
5 경고 및 주의사항
5.1 골수기능 억제
Linezolid를 투여 받은 환자에서 골수기능 억제 (빈혈, 백혈구감소증, 범혈구감소증 및 혈소판감소증 포함)가 보고되었다. 결과를 알 수 있는 경우, linezolid를 중단한 시점에서 영향을 받은 혈액학적 지표가 치료 전 수준으로 상승하였다. 혈소판감소증은 중증의 신장애 환자(투석 여부에 관계없이), 중등도 내지 중증의 간장애 환자에서 더 자주 보고되었다. 특히 2주 이상 linezolid를 투여 받는 환자, 기존에 골수기능 억제가 있는 환자, 중증의 신장애 또는 중등도에서 중증의 간장애 환자, 골수 억제를 유발하는 병용약물을 투여 받는 환자, 또는 만성 감염으로 이전에 또는 병용 항균제 요법을 받은 환자의 경우 linezolid 치료를 받는 동안 매주 전혈구검사를 모니터링해야 한다. 골수기능 억제가 발생하거나 악화되는 환자에서는 linezolid 치료 중단을 고려해야 한다 [이상반응 (6.2) 참조].
5.2 말초 및 시신경병증
말초 및 시신경병증은 linezolid로 치료받은 환자, 주로 권장 최대 투여기간인 28일을 초과하여 치료받은 환자에서 보고되었다. 시력 상실로 진행된 시신경병증의 경우, 환자들은 권장 최대 기간을 초과하여 장기간 치료를 받았다. 시야흐림은 linezolid로 28일 미만 치료받은 일부 환자에서 보고되었다. 말초 및 시신경병증은 소아에서도 보고되었다.
시력 변화, 색각 변화, 흐린 시야 또는 시야 결손과 같은 시각장애 증상이 나타나는 경우, 신속한 안과 검사가 권장된다. Linezolid를 장기간(3개월 이상) 복용하는 모든 환자와 치료 기간에 관계없이 새로운 시각 증상을 호소하는 모든 환자에서 시각 기능을 모니터링해야 한다. 말초 또는 시신경병증이 발생하는 경우, 이러한 환자에서 linezolid의 지속 사용 시 잠재적 위험을 고려해야 한다.
5.3 세로토닌 증후군
Linezolid와 선택적 세로토닌 재흡수 억제제(SSRIs)와 같은 항우울제를 포함한 세로토닌성 약물과의 병용투여와 관련하여 치명적인 경우를 포함한 세로토닌 증후군의 자발보고가 있었다.
임상적으로 적절하고 환자가 세로토닌 증후군 또는 신경이완제 악성 증후군(NMS)과 유사한 반응의 징후 및/또는 증상에 대해 주의 깊게 관찰되지 않는 한, linezolid는 carcinoid 증후군 및/또는 다음 약물 중 하나를 복용 중인 환자에게 투여해서는 안 된다: 세로토닌 재흡수 억제제, 삼환계 항우울제, bupropion, buspirone, 세로토닌 5-HT1 수용체 작용제(triptans) 및 meperidine을 포함한 아편유사제 [약물 상호 작용 (7) 및 임상약리학 (12.3)].
일부 경우, 세로토닌성 항우울제 또는 buspirone을 이미 복용 중인 환자는 linezolid로 긴급 치료가 필요할 수 있다. Linezolid에 대한 대안이 없고 linezolid의 잠재적 이점이 세로토닌 증후군 또는 NMS 유사 반응의 위험을 상회하는 경우, 세로토닌성 항우울제를 신속히 중단하고 linezolid를 투여해야 한다. 환자는 2주 동안(fluoxetine을 복용한 경우 5주) 또는 linezolid의 마지막 투여 후 24시간 동안 중 먼저 도래하는 시점까지 모니터링해야 한다. 세로토닌 증후군 또는 NMS 유사 반응의 증상에는 고체온, 경직, 근간대경련, 자율신경불안정, 망상에서 혼수에 이르는 극심한 초조 등 정신 상태 변화가 포함된다. 또한 환자는 항우울제의 중단 증상에 대해 모니터링해야 한다(관련 중단 증상에 대한 설명은 지정된 약제의 제품설명서 참조).
5.4 카테터 부위 감염을 포함한 카테터 관련 혈류감염 환자에서의 사망률 불균형에 대한 연구
혈관내 카테터 관련 감염이 있는 중증 환자를 대상으로 한 공개 연구에서 linezolid 치료 환자와 vancomycin/dicloxacillin/oxacillin 치료 환자 간 사망률 불균형이 관찰되었다[78/363 (21.5%) vs. 58/363 (16.0%); odds ratio 1.426, 95% CI 0.970, 2.098]. 인과관계가 확립되지는 않았지만, 이러한 불균형은 주로 베이스라인에서 그람음성 병원체, 혼합 그람음성 및 그람양성 병원체 또는 병원체가 확인되지 않은 linezolid 치료 환자에서 발생했으나 그람양성 감염만 있는 환자에서는 관찰되지 않았다.
Linezolid는 카테터 관련 혈류감염 또는 카테터 부위 감염 환자의 치료에 대해 승인되지 않았으며 사용해서는 안 된다.
Linezolid는 그람음성 병원체에 대한 임상 활성이 없으며 그람음성 감염 치료에 대해 적응증이 없다. 동반 그람음성 병원체가 확인되거나 의심되는 경우 즉시 특정 그람음성 치료를 시작하는 것이 중요하다 [적응증 및 사용법 (1) 참조].
5.5 Clostridioides difficile 관련 설사
Clostridioides difficile 관련 설사(CDAD)는 linezolid를 포함한 거의 모든 항균제 사용과 관련하여 보고되었으며, 경증 설사에서 치명적인 대장염에 이르기까지 다양할 수 있다. 항균제 치료는 대장의 정상 세균총을 변화시켜 C. difficile의 과증식을 초래한다.
C. difficile은 CDAD의 발생에 기여하는 독소 A와 B를 생성한다. 고독소 생성 C. difficile 균주는 항균요법에 불응하고 대장절제술이 필요할 수 있기 때문에 이러한 감염은 이환율과 사망률 증가를 유발한다. 항균제 사용 후 설사가 나타나는 모든 환자에서 CDAD를 고려해야 한다.
CDAD는 항균제 투여 후 2개월 이상 경과한 후에도 보고되었기 때문에 주의 깊은 병력 청취가 필요하다.
CDAD가 의심되거나 확인된 경우, C. difficile에 대해 작용하지 않는 항균제 사용을 중단해야 할 수 있다. 임상적으로 필요에 따라 적절한 수액 및 전해질 관리, 단백질 보충, C. difficile에 대한 항균 약물 치료 및 외과적 평가가 이루어져야 한다.
5.6 혈압 상승을 유발할 수 있는 잠재적 상호작용
환자의 잠재적 혈압 상승을 모니터링하지 않는 한, linezolid는 조절되지 않는 고혈압, pheochromocytoma, thyrotoxicosis 및/또는 다음과 같은 유형의 약물을 복용하는 환자에게 투여해서는 안 됩니다: 직접 및 간접적으로 작용하는 sympathomimetic agents (예: pseudoephedrine), vasopressive agents (예: epinephrine, norepinephrine), dopaminergic agents (예: dopamine, dobutamine) [Drug Interactions (7) 및 Clinical Pharmacology (12.3) 참조].
5.7 Lactic Acidosis
Linezolid 사용과 관련하여 lactic acidosis가 보고되었습니다. 보고된 사례에서 환자들은 반복적인 오심과 구토 증상을 경험했습니다. Linezolid를 투여받는 동안 반복적인 오심이나 구토, 설명되지 않는 acidosis, 또는 낮은 bicarbonate 수치가 발생하는 환자는 즉시 의학적 평가를 받아야 합니다.
5.9 저혈당증
Linezolid로 치료받은 인슐린이나 경구용 혈당강하제를 복용하는 당뇨병 환자에서 증상이 있는 저혈당증의 시판 후 사례가 보고되었습니다. Linezolid는 가역적이고 비선택적인 MAO 억제제입니다. 일부 MAO 억제제는 인슐린이나 혈당강하제를 투여받는 당뇨병 환자에서 저혈당 에피소드와 관련이 있었습니다. Linezolid와 저혈당증 사이의 인과관계는 확립되지 않았지만, linezolid로 치료받는 당뇨병 환자는 잠재적인 저혈당 반응에 주의해야 합니다.
저혈당증이 발생하면, 인슐린이나 경구용 혈당강하제의 용량 감소, 또는 경구용 혈당강하제, 인슐린, 또는 linezolid의 중단이 필요할 수 있습니다.
5.10 저나트륨혈증 및/또는 Syndrome of Inappropriate
Antidiuretic Hormone Secretion (SIADH)
Linezolid로 치료받은 환자에서 저나트륨혈증 및/또는 Syndrome of Inappropriate Antidiuretic Hormone Secretion (SIADH)의 시판 후 사례가 관찰되었습니다. 보고된 사례에서 징후와 증상에는 혼란, 기면, 전신 쇠약이 포함되었고 심각한 경우에는 호흡 부전 및 심지어 사망에 이르기도 했습니다. 고령자, 이뇨제를 복용하는 환자, linezolid를 투여받는 동안 저나트륨혈증 및/또는 SIADH의 위험이 있는 다른 환자에서 혈청 나트륨 농도를 정기적으로 모니터링하십시오. 저나트륨혈증 및/또는 SIADH의 징후와 증상이 발생하면, linezolid 투여를 중단하고 적절한 지지요법을 시작하십시오.
5.12 내성균 발현
증명된 세균 감염이나 강력히 의심되는 세균 감염 또는 예방적 적응증 없이 linezolid를 처방하는 것은 환자에게 유익할 가능성이 낮고 내성균 발현의 위험을 증가시킵니다.
6 부작용
6.1 임상시험 경험
임상시험은 매우 다양한 조건에서 수행되므로 약물의 임상시험에서 관찰된 이상반응 발생률을 다른 약물의 임상시험 발생률과 직접 비교할 수 없으며 실제 관행에서 관찰된 발생률을 반영하지 않을 수 있습니다.
성인
리네졸리드 제형의 안전성은 최대 28일 동안 치료를 받은 7건의 3상 비교임상시험에 등록된 2,046명의 성인 환자에서 평가되었습니다.
단순 피부 및 피부구조 감염(uSSSIs)으로 치료받은 환자 중 25.4%의 리네졸리드 치료군과 19.6%의 대조군에서 최소 1건의 약물관련 이상반응이 발생했습니다. 다른 모든 적응증의 경우, 20.4%의 리네졸리드 치료군과 14.3%의 대조군에서 최소 1건의 약물관련 이상반응이 발생했습니다.
표 2는 이들 시험에서 성인 환자들에 대한 리네졸리드 투여량별 전체 원인에 의한 치료 중 발생한 이상반응의 발생률을 보여줍니다.
표 2. 비교임상시험에서 리네졸리드로 치료받은 성인 환자의 1% 이상에서 발생한 치료 중 발생한 이상반응 발생률(%)
| 이상반응 | 단순 피부 및 피부구조 감염 | 기타 모든 적응증 | ||
|---|---|---|---|---|
| 리네졸리드 400 mg 경구 12시간 간격 (n=548) |
클래리트로마이신 250 mg 경구 12시간 간격 (n=537) |
리네졸리드 600 mg 12시간 간격 (n=1,498) |
기타 모든 대조군* (n=1,464) |
|
|
두통 |
8.8 |
8.4 |
5.7 |
4.4 |
|
설사 |
8.2 |
6.1 |
8.3 |
6.4 |
|
구역질 |
5.1 |
4.5 |
6.6 |
4.6 |
|
구토 |
2.0 |
1.5 |
4.3 |
2.3 |
|
어지럼 |
2.6 |
3.0 |
1.8 |
1.5 |
|
발진 |
1.1 |
1.1 |
2.3 |
2.6 |
|
빈혈 |
0.4 |
0 |
2.1 |
1.4 |
|
미각 변화 |
1.8 |
2.0 |
1.0 |
0.3 |
|
질칸디다증 |
1.8 |
1.3 |
1.1 |
0.5 |
|
구강칸디다증 |
0.5 |
0 |
1.7 |
1.0 |
|
비정상적인 간기능 검사 |
0.4 |
0.2 |
1.6 |
0.8 |
|
진균 감염 |
1.5 |
0.2 |
0.3 |
0.2 |
|
혀 변색 |
1.3 |
0 |
0.3 |
0 |
|
국소 복통 |
1.3 |
0.6 |
1.2 |
0.8 |
|
전신 복통 |
0.9 |
0.4 |
1.2 |
1.0 |
|
* 비교 대상에는 12시간마다 경구 섭취하는 셉포독심 프록세틸 200mg, 12시간마다 정맥 주사하는 세프트리액손 1g, 6시간마다 경구 섭취하는 디클록사실린 500mg, 6시간마다 정맥 주사하는 옥사실린 2g, 12시간마다 정맥 주사하는 반코마이신 1g이 포함되었습니다. |
||||
uSSSI로 치료 받은 환자들 중에서 약물 관련 부작용으로 인해 치료를 중단한 비율은 리네졸리드 치료군 3.5%, 대조군 2.4%였습니다. 다른 모든 적응증에서는 리네졸리드 치료군 2.1%, 대조군 1.7%가 약물 관련 부작용으로 인해 치료를 중단했습니다. 가장 흔한 약물 관련 부작용으로 인한 치료 중단 사유는 구역, 두통, 설사, 구토였습니다.
소아 환자
리네졸리드 제형의 안전성은 출생부터 11세까지의 215명 소아 환자와 5세부터 17세까지의 248명 소아 환자(이 중 146명은 5세부터 11세, 102명은 12세부터 17세)에게서 평가되었습니다. 이들 환자들은 2건의 3상 비교 대조 임상시험에 등록되어 최대 28일까지 치료를 받았습니다. 그람 양성 감염이 있는 입원 소아 환자(출생부터 11세)를 대상으로 한 연구에서 환자들은 2:1로 무작위 배정되어 리네졸리드 또는 반코마이신 치료를 받았는데, 리네졸리드 군에서의 사망률은 6.0%(13/215), 반코마이신 군에서는 3.0%(3/101)였습니다. 그러나 환자군의 중증 기저 질환을 고려할 때 인과관계를 확립할 수는 없었습니다.
uSSSI로 치료받은 소아 환자들 중 리네졸리드 치료군의 19.2%, 대조군의 14.1%가 적어도 한 건의 약물 관련 부작용을 경험했습니다. 다른 모든 적응증에서는 리네졸리드 치료군의 18.8%, 대조군의 34.3%가 적어도 한 건의 약물 관련 부작용을 경험했습니다.
표 3은 비교 대조 3상 임상시험에서 어느 한 치료군에서나 1% 이상의 소아 환자(최소 2명 이상)에게서 보고된 모든 원인에 의한 치료 후 발생 부작용의 발생률을 보여줍니다.
표 3. 비교 대조 임상시험에서 어느 한 치료군에서나 1% 이상의 소아 환자(최소 2명 이상)에게서 발생한 치료 후 발생 부작용의 발생률(%)
|
부작용 |
복잡성 없는 피부 및 피부구조 감염* |
기타 모든 적응증† |
||
|
리네졸리드 (n=248) |
세파드록실 (n=251) |
리네졸리드 (n=215) |
반코마이신 (n=101) |
|
|
설사 |
7.8 |
8.0 |
10.8 |
12.1 |
|
구토 |
2.9 |
6.4 |
9.4 |
9.1 |
|
두통 |
6.5 |
4.0 |
0.9 |
0 |
|
빈혈 |
0 |
0 |
5.6 |
7.1 |
|
혈소판 감소증 |
0 |
0 |
4.7 |
2.0 |
|
구역질 |
3.7 |
3.2 |
1.9 |
0 |
|
전반적인 복통 |
2.4 |
2.8 |
0.9 |
2.0 |
|
국소 복통 |
2.4 |
2.8 |
0.5 |
1.0 |
|
설사 |
1.6 |
0.8 |
2.3 |
3.0 |
|
호산구 증가증 |
0.4 |
0.8 |
1.9 |
1.0 |
|
비적용 부위 가려움증 |
0.8 |
0.4 |
1.4 |
2.0 6 부작용 |
|
리네졸리드 |
클래리트로마이신 |
리네졸리드 |
다른 모든 비교약물† |
|
|
현기증 |
1.2 |
0.4 |
0 |
0 |
|
* 5세부터 11세까지의 환자는 12시간마다 경구 리네졸리드 10mg/kg 또는 12시간마다 경구 세파드록실 15mg/kg를 투여받았습니다. 12세 이상의 환자는 12시간마다 경구 리네졸리드 600mg 또는 12시간마다 경구 세파드록실 500mg를 투여받았습니다. † 출생부터 11세까지의 환자는 8시간마다 정맥주사 리네졸리드 10mg/kg 또는 연령 및 신장클리어런스에 따라 6시간에서 24시간마다 정맥주사 반코마이신 10mg/kg에서 15mg/kg를 투여받았습니다. |
||||
uSSSI로 치료받은 소아 환자 중 1.6%의 리네졸리드 투여군과 2.4%의 비교약물 투여군이 약물 관련 이상반응으로 인해 치료를 중단했습니다. 다른 모든 적응증에서, 약물 관련 이상반응으로 인한 중단은 리네졸리드 투여군의 0.9%, 비교약물 투여군의 6.1%에서 발생했습니다.
실험실 검사치 이상
리네졸리드는 최대 28일간 12시간마다 600mg까지 투여 시 혈소판감소증과 관련이 있었습니다. 3상 비교임상시험에서, 현저한 혈소판감소(정상하한치 및/또는 기저치의 75% 미만으로 정의)를 경험한 성인 환자 비율은 리네졸리드의 경우 2.4%(연구별 범위: 0.3% ~ 10.0%), 비교약물의 경우 1.5%(연구별 범위: 0.4% ~ 7.0%)였습니다. 출생부터 11세까지의 입원 소아 환자 대상 연구에서, 현저한 혈소판감소를 경험한 환자 비율은 리네졸리드군 12.9%, 반코마이신군 13.4%였습니다. 5세부터 17세까지의 외래 소아 환자를 대상으로 한 연구에서, 현저한 혈소판감소 환자 비율은 리네졸리드군 0%, 세파드록실군 0.4%였습니다. 리네졸리드 사용과 관련된 혈소판감소증은 일반적으로 2주 이상의 장기 치료에 의존하는 것으로 보입니다. 대부분 환자의 혈소판 수치는 추적 관찰기간 동안 정상범위/기저치로 돌아왔습니다. 3상 임상시험에서 혈소판감소증을 경험한 환자에게서 관련 임상적 이상반응은 관찰되지 않았습니다. 리네졸리드의 구휼사용프로그램에서 혈소판감소증 환자에게서 출혈 사례가 확인되었지만, 이러한 사례에 리네졸리드가 기여한 역할은 확실하지 않습니다 [경고 및 주의사항 (5.1) 참조].
약물관련 여부와 상관없이 다른 실험실 수치 변화를 살펴본 결과 리네졸리드와 비교약물 간 큰 차이는 없었습니다. 이러한 변화는 대체로 임상적으로 중요하지 않았고, 치료 중단으로 이어지지 않았으며 가역적이었습니다. 최소 한 번 이상 현저한 혈액학 또는 혈청화학 수치 이상을 보인 성인 및 소아 환자 비율은 표 4, 5, 6, 7과 같습니다.
표 4. 리네졸리드 비교임상시험에서 최소 한 번 이상 현저한* 혈액검사치 이상을 보인 성인 환자 비율
|
실험실 검사 |
단순 피부 및 피부구조 감염 |
기타 모든 적응증 |
||
|
리네졸리드 |
클래리트로마이신 |
리네졸리드 |
다른 모든 비교약물† |
|
|
헤모글로빈 (g/dL) |
0.9 |
0.0 |
7.1 |
6.6 |
|
혈소판 수 (x 103/mm3) |
0.7 |
0.8 |
3.0 |
1.8 |
|
WBC (x 103/mm3) |
0.2 |
0.6 |
2.2 |
1.3 |
|
호중구 수 (x 103/mm3) |
0.0 |
0.2 |
1.1 |
1.2 |
|
* 기저치에서 정상치의 경우 정상하한치(LLN)의 75% 미만(<호중구에서는 50% 미만>); 기저치에서 비정상치의 경우 LLN 및 기저치의 75% 미만(<호중구에서는 50% 미만>) † 비교약물에는 12시간마다 경구 세프포독심 프록세틸 200mg, 12시간마다 정맥주사 세프트리악손 1g, 6시간마다 경구 디클록사실린 500mg, 6시간마다 정맥주사 옥사실린 2g, 12시간마다 정맥주사 반코마이신 1g이 포함되었습니다. |
||||
표 5. 리네졸리드 비교임상시험에서 최소 한 번 이상 현저한* 혈청화학검사치 이상을 보인 성인 환자 비율
|
실험실 검사 |
단순 피부 및 피부구조 감염 | |||
|
기타 모든 적응증 |
||||
|
리네졸리드 |
클래리트로마이신 250밀리그램 12시간마다 |
리네졸리드 |
기타 모든 비교 대상약물† |
|
|
AST (U/L) |
1.7 |
1.3 |
5.0 |
6.8 |
|
ALT (U/L) |
1.7 |
1.7 |
9.6 |
9.3 |
|
LDH (U/L) |
0.2 |
0.2 |
1.8 |
1.5 |
|
알칼리성 인산분해효소 (U/L) |
0.2 |
0.2 |
3.5 |
3.1 |
|
리파제 (U/L) |
2.8 |
2.6 |
4.3 |
4.2 |
|
아밀라제 (U/L) |
0.2 |
0.2 |
2.4 |
2.0 |
|
총 빌리루빈 (mg/dL) |
0.2 |
0.0 |
0.9 |
1.1 |
|
BUN (mg/dL) |
0.2 |
0.0 |
2.1 |
1.5 |
|
크레아티닌 (mg/dL) |
0.2 |
0.0 |
0.2 |
0.6 |
|
* 기저치에서 정상값인 경우 정상 상한치(ULN)의 2배 초과, 기저치에서 비정상값인 경우 ULN의 2배 초과 및 기저치의 2배 초과 † 비교 대상약물은 경구 셰프포독심 프록세틸 200밀리그램 12시간마다, 정맥주사 셰프트리악손 1그램 12시간마다, 경구 디클록사실린 500밀리그램 6시간마다, 정맥주사 옥사실린 2그램 6시간마다, 정맥주사 반코마이신 1그램 12시간마다를 포함합니다. |
||||
표 6. 대조군 대비 임상시험에서 리네졸리드를 투여받은 소아 환자 중 적어도 한 번 이상 현저하게 비정상적인* 혈액학적 검사 값을 경험한 환자 비율
|
검사실 검사 |
단순 피부 및 피부구조 감염† |
기타 모든 적응증‡ |
||
|
리네졸리드 |
셰프아드록실 |
리네졸리드 |
반코마이신 |
|
|
혈색소 (g/dL) |
0.0 |
0.0 |
15.7 |
12.4 |
|
혈소판 수 (x 103/mm3) |
0.0 |
0.4 |
12.9 |
13.4 |
|
백혈구 수 (x 103/mm3) |
0.8 |
0.8 |
12.4 |
10.3 |
|
호중구 수 (x 103/mm3) |
1.2 |
0.8 |
5.9 |
4.3 |
|
* 기저치가 정상 범위일 경우 정상 하한치(LLN)의 75% 미만(호중구의 경우 50% 미만); 기저치가 비정상일 경우 LLN의 75% 미만(호중구의 경우 50% 미만, 헤모글로빈의 경우 기저치가 LLN 미만일 때 90% 미만) †5~11세 환자에게 리네졸리드 12시간마다 10mg/kg 또는 세파드록실 12시간마다 15mg/kg 경구 투여. 12세 이상 환자에게 리네졸리드 12시간마다 600mg 또는 세파드록실 12시간마다 500mg 경구 투여. ‡출생~11세 환자에게 리네졸리드 8시간마다 10mg/kg 정맥 또는 경구 투여, 반코마이신 연령 및 신장 기능에 따라 6~24시간마다 10~15mg/kg 정맥 투여. |
||||
표 7. 비교 임상시험에서 리네졸리드를 투여받은 소아 환자 중 실질적으로 비정상적인 혈청 화학 검사치를 경험한 환자 비율
|
검사 |
피부 및 피부구조 감염(비복잡)† |
기타 적응증‡ |
||
|
리네졸리드 |
세파드록실 |
리네졸리드 |
반코마이신 |
|
|
ALT (U/L) |
0.0 |
0.0 |
10.1 |
12.5 |
|
리파아제(U/L) |
0.4 |
1.2 |
— |
— |
|
아밀라아제(U/L) |
— |
— |
0.6 |
1.3 |
|
총 빌리루빈(mg/dL) |
— |
— |
6.3 |
5.2 |
|
크레아티닌(mg/dL) |
0.4 |
0.0 |
2.4 |
1.0 |
|
* 기저치가 정상 범위일 경우 정상 상한치(ULN)의 2배 초과; 기저치가 비정상일 경우 ULN의 2배 초과(총 빌리루빈의 경우 기저치의 1.5배 초과) †5~11세 환자에게 리네졸리드 12시간마다 10mg/kg 또는 세파드록실 12시간마다 15mg/kg 경구 투여. 12세 이상 환자에게 리네졸리드 12시간마다 600mg 또는 세파드록실 12시간마다 500mg 경구 투여. ‡출생~11세 환자에게 리네졸리드 8시간마다 10mg/kg 정맥/경구 투여 또는 반코마이신 연령 및 신장 기능에 따라 6~24시간마다 10~15mg/kg 정맥 투여. |
||||
6.2 시판 후 경험
다음 이상반응이 리네졸리드 시판 후 확인되었다. 이러한 반응은 불분명한 규모의 인구집단에서 자발적으로 보고되었기 때문에 반응 빈도를 신뢰성 있게 추정하거나 약물 노출과의 인과관계를 확립하기 어렵다.
- 골수억제(빈혈, 백혈구감소증, 범혈구감소증, 혈소판감소증 포함). 혈소판감소증은 중증 신장애 및 중등증~중증 간장애 환자에서 보다 자주 보고되었다[경고 및 주의사항(5.1) 참조]; 재생불량성빈혈
- 말초신경병증, 시력 상실로 진행하는 경우도 있는 시신경병증[경고 및 주의사항(5.2) 참조]
- 유산증[경고 및 주의사항(5.7) 참조]. 이러한 보고는 대부분 최대 권장 기간인 28일을 초과하여 치료받은 환자에서 발생했지만, 단기 치료 환자에서도 발생하였다.
- 선택적 세로토닌 재흡수 억제제(SSRI), 아편유사제 등 세로토닌성 약물 병용 시 세로토닌 증후군 발생[경고 및 주의사항(5.3) 참조]
- 경련[경고 및 주의사항(5.8) 참조]
- 아나필락시스, 혈관부종, 중증 피부 이상반응(SCAR: toxic epidermal necrolysis, Stevens-Johnson syndrome 포함) 등 수포성 피부 질환, 과민성 혈관염
- 치아 변색 및 설 변색 발생. 치아 변색은 치과 전문가 세정(수동 제거) 시 해결된 경우 있음
- 증상성 저혈당 발생[경고 및 주의사항(5.9) 참조]
- 저나트륨혈증 및/또는 부적절한 항이뇨호르몬 분비증후군 (SIADH)[경고 및 주의사항(5.10) 참조]
7 약물 상호 작용
7.1 Monoamine Oxidase Inhibitors
Linezolid는 가역적이고 비선택적인 monoamine oxidase inhibitor입니다 [Contraindications (4.2) 및 Clinical Pharmacology (12.3)] 참조.
7.2 Adrenergic and Serotonergic Agents
Linezolid는 adrenergic 및 serotonergic agents와 상호 작용할 가능성이 있습니다 [Warnings and Precautions (5.3, 5.6) 및 Clinical Pharmacology (12.3)] 참조.
8 특정 집단에서의 사용
8.1 임신
위험 요약
임신한 여성에서 linezolid 사용에 대한 발표된 데이터와 시판 후 사례 보고서에서 주요 선천성 기형, 유산 또는 약물과 관련된 부작용의 위험이 확인되지 않았습니다. Linezolid를 기관 형성 기간 동안 투여했을 때, AUC를 기반으로 임상 치료 노출량의 약 6.5배(마우스), 동등(랫드) 또는 0.06배(토끼)의 모체 노출 수준에서 마우스, 랫드 또는 토끼에서 기형을 유발하지 않았습니다. 그러나 추정 인체 노출량의 6.5배에서 마우스에서 배아-태아 치사가 관찰되었습니다. 암컷 랫드에 기관 형성 기간부터 수유기까지 투여했을 때, AUC를 기반으로 추정 인체 노출량과 대략 동등한 용량에서 출생 후 새끼의 생존율이 감소했습니다(데이터 참조).
표시된 집단에서 주요 선천성 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천성 기형, 유산 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인지된 임신의 주요 선천성 기형 및 유산의 추정 배경 위험은 각각 2%~4% 및 15%~20%입니다.
데이터
동물 데이터
마우스에서는 모체 독성(임상 징후 및 체중 증가 감소)을 유발한 용량에서만 배아-태아 독성이 관찰되었습니다. 임신 6일부터 16일까지 경구 투여한 450 mg/kg/day(AUC 기반 추정 인체 노출량의 6.5배)는 착상 후 배아 사망 증가, 전체 새끼 손실, 태아 체중 감소 및 늑골 연골 융합 발생률 증가와 관련이 있었습니다. 최대 150 mg/kg/day 용량까지는 모체 또는 배아-태아 독성이 관찰되지 않았습니다. 태아 기형은 관찰되지 않았습니다.
랫드에서는 임신 6일부터 17일까지 경구 투여한 15 mg/kg/day 및 50 mg/kg/day(AUC 기반 추정 인체 노출량의 각각 0.22배 및 대략 동등)에서 태아 독성이 관찰되었습니다. 그 영향은 태아 체중 감소와 흉골 골화 감소로 구성되었는데, 이는 태아 체중 감소와 관련하여 자주 관찰되는 소견입니다. 태아 기형은 관찰되지 않았습니다. 모체 독성은 50 mg/kg/day에서 체중 증가 감소의 형태로 나타났습니다.
토끼에서는 임신 6일부터 20일까지 15 mg/kg/day의 경구 용량(AUC 기반 추정 인체 노출량의 0.06배)으로 투여했을 때 모체 독성(임상 징후, 체중 증가 및 사료 섭취량 감소)이 있는 경우에만 태아 체중 감소가 발생했습니다. 태아 기형은 관찰되지 않았습니다.
암컷 랫드를 임신 및 수유기(임신 6일부터 수유 20일까지) 동안 50 mg/kg/day(AUC 기반 추정 인체 노출량과 대략 동등)의 linezolid로 처리했을 때, 출생 후 1일부터 4일까지 새끼의 생존율이 감소했습니다. 성숙한 생식 연령까지 사육된 수컷 및 암컷 새끼를 교배시켰을 때, 착상 전 손실이 증가했습니다.
8.2 수유
위험 요약
Linezolid는 모유에 존재합니다. 발표된 사례 보고서의 데이터에 따르면 모유를 통해 영아가 받는 linezolid의 일일 용량은 권장 치료 영아 용량(8시간마다 10 mg/kg)의 약 6%~9%가 될 것입니다. Linezolid가 모유 수유 영아에 미치는 영향에 대한 정보는 없습니다. 그러나 설사와 구토는 linezolid를 치료 용량으로 받은 영아에서 임상 시험에서 보고된 가장 흔한 부작용이었습니다[이상반응(6.1) 참조] 및 (임상적 고려사항 참조). Linezolid가 모유 생성에 미치는 영향에 대한 정보는 없습니다. 모유 수유의 발달 및 건강상 이점은 linezolid에 대한 산모의 임상적 필요성 및 linezolid 또는 기저 모체 상태로 인한 모유 수유 아동에 대한 잠재적 부작용과 함께 고려되어야 합니다.
임상적 고려사항
모유 수유 여성에게 모유 수유 영아에서 설사와 구토를 모니터링하도록 권고합니다.
8.4 소아 사용
다음 감염증의 소아 환자 치료에 대한 linezolid의 안전성과 유효성은 성인에서의 적절하고 잘 통제된 연구의 근거, 소아 환자에서의 약동학 데이터, 출생부터 11세까지의 소아 환자에서 그람 양성균 감염증에 대한 비교 대조 연구의 추가 데이터에 의해 뒷받침됩니다[적응증 및 사용법(1), 임상약리학(12.3) 및 임상연구(14) 참조]:
- 원내 폐렴
- 복잡성 피부 및 피부 구조 감염
- 지역사회 획득 폐렴(8개월부터 12세까지의 환자에서의 비대조 연구의 근거에 의해서도 뒷받침됨)
- vancomycin 내성 Enterococcus faecium 감염
다음 감염증의 소아 환자 치료에 대한 linezolid의 안전성과 유효성은 5세부터 17세까지의 소아 환자에서의 비교 대조 연구에서 확립되었습니다[임상연구(14) 참조]:
- Staphylococcus aureus(methicillin 감수성 균주만 해당) 또는 Streptococcus pyogenes에 의한 비복잡성 피부 및 피부 구조 감염
뇌실복막 션트가 있는 소아 환자에서 생성된 약동학 정보는 linezolid 단회 및 다회 투여 후 뇌척수액(CSF)에서 다양한 linezolid 농도를 보여주었습니다. CSF에서 치료 농도가 일관되게 도달되거나 유지되지 않았습니다. 따라서 중추신경계 감염이 있는 소아 환자의 경험적 치료에 linezolid의 사용은 권장되지 않습니다.
리네졸리드의 약물동태는 출생부터 17세까지의 소아 환자에서 평가되었습니다. 일반적으로, 소아 환자의 연령이 증가함에 따라 리네졸리드의 체중 기준 청소율은 점진적으로 감소합니다. 그러나, 34주 미만의 재태 연령을 가진 조산아 중 생후 7일 미만의 경우, 리네졸리드 청소율은 종종 만삭아 중 생후 7일 미만의 경우보다 낮습니다. 따라서, 생후 7일 미만의 조산아는 12시간마다 10 mg/kg의 대체 리네졸리드 용법이 필요할 수 있습니다 [Dosage and Administration (2.1) 및 Clinical Pharmacology (12.3)] 참조.
제한된 임상 경험에서, MIC가 4 mcg/mL인 그람 양성 병원체 감염이 있는 6명의 소아 환자 중 5명(83%)이 리네졸리드 치료로 임상적 치료를 달성했습니다. 그러나, 소아 환자는 성인에 비해 리네졸리드 청소율 및 전신 노출(AUC)에서 더 큰 변동성을 보입니다. 임상 반응이 최적화되지 않은 소아 환자, 특히 MIC가 4 mcg/mL인 병원체를 가진 환자의 경우, 임상 반응을 평가할 때 낮은 전신 노출, 감염 부위 및 중증도, 기저 질환을 고려해야 합니다 [Clinical Pharmacology (12.3) 및 Dosage and Administration (2)] 참조.
8.5 노인에서의 사용
3상 비교 대조 임상 시험에서 리네졸리드로 치료받은 2,046명의 환자 중 589명(29%)은 65세 이상이었고 253명(12%)은 75세 이상이었습니다. 이들 환자와 젊은 환자 사이에 안전성 또는 유효성에 있어 전반적인 차이는 관찰되지 않았으며, 다른 보고된 임상 경험에서도 노인 환자와 젊은 환자 간의 반응 차이를 발견하지 못했지만, 일부 고령자의 더 높은 민감도는 배제할 수 없습니다.
10 과다 복용
과다 복용 시, 사구체 여과율 유지와 함께 지지요법이 권장됩니다. 혈액투석은 linezolid의 더 빠른 제거를 촉진할 수 있습니다. 1상 임상시험에서, linezolid 투여 후 3시간 뒤 시작하는 3시간 동안의 혈액투석 세션 동안 linezolid 용량의 약 30%가 제거되었습니다. 복막투석 또는 hemoperfusion으로 linezolid 제거에 대한 데이터는 없습니다. 동물에서 급성 독성의 임상 징후는 3,000 mg/kg/day를 투여한 랫드에서는 활동 저하 및 실조증, 2,000 mg/kg/day를 투여한 개에서는 구토 및 떨림이 나타났습니다.
11 설명
Linezolid 정제는 oxazolidinone 계열의 합성 항균제인 linezolid, USP를 함유하고 있습니다. Linezolid의 화학명은 (S)-N-[[3-[3-Fluoro-4-(4-morpholinyl) phenyl]-2-oxo-5-oxazolidinyl] methyl]-acetamide입니다.
분자식은 C16H20FN3O4이고, 분자량은 337.35g/mol이며, 그 화학구조는 아래와 같습니다:
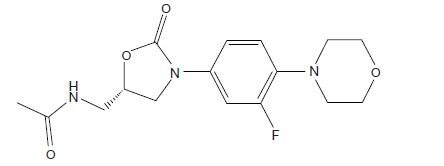
경구투여용 Linezolid 정제는 흰색에서 미백색의 변형된 캡슐 모양의 필름 코팅 정제로 600mg의 linezolid, USP를 함유하고 있습니다. 비활성 성분으로는 croscarmellose sodium, diethyl phthalate, ethyl cellulose, hypromellose, magnesium stearate, microcrystalline cellulose, povidone, silicon dioxide, talc, titanium dioxide이 포함됩니다. 600mg 정제 1정당 나트륨(Na+) 함량은 2.73mg (0.1 mEq/정)입니다.
12 CLINICAL PHARMACOLOGY
12.2 약력학
무작위 배정, 양성 및 위약 대조 교차 연구에서 40명의 건강한 지원자에게 리네졸리드 600mg을 1시간 정맥 주입으로 단회 투여, 리네졸리드 1,200mg을 1시간 정맥 주입으로 단회 투여, 위약, 양성 대조약물 단회 경구 투여가 이루어졌습니다. 리네졸리드 600mg 및 1,200mg 모두에서 최고 혈장 농도 또는 다른 시점에서 QTc 간격에 유의한 영향이 관찰되지 않았습니다.
12.3 약동학
성인에게 단회 및 반복 경구 및 정맥 투여 후 리네졸리드의 평균 약동학 파라미터는 표 8에 요약되어 있습니다. 12시간마다 600mg을 경구 투여했을 때 정상 상태에서의 리네졸리드 혈장 농도가 그림 1에 나와 있습니다.
표 8. 성인에서 리네졸리드의 평균(표준편차) 약동학 파라미터
| 리네졸리드 용량 | Cmax mcg/mL |
Cmin mcg/mL |
Tmax hrs |
AUC* mcg•h/mL |
t1/2 hrs |
CL mL/min |
|---|---|---|---|---|---|---|
|
400 mg 정제 12시간마다 반복투여 |
8.10 (1.83) 11.00 (4.37) |
– 3.08 (2.25) |
1.52 (1.01) 1.12 (0.47) |
55.10 (25.00) 73.40 (33.50) |
5.20 (1.50) 4.69 (1.70) |
146 (67) 110 (49) |
|
600 mg 정제 12시간마다 반복투여 |
12.70 (3.96) 21.20 (5.78) |
– 6.15 (2.94) |
1.28 (0.66) 1.03 (0.62) |
91.40 (39.30) 138.00 (42.10) |
4.26 (1.65) 5.40 (2.06) |
127 (48) 80 (29) |
|
600 mg IV 주사‡ 단회투여 12시간마다 반복투여 |
12.90 (1.60) 15.10 (2.52) |
– 3.68 (2.36) |
0.50 (0.10) 0.51 (0.03) |
80.20 (33.30) 89.70 (31.00) |
4.40 (2.40) 4.80 (1.70) |
138 (39) 123 (40) |
|
600 mg 경구 현탁액 단회투여 |
11.00 (2.76) |
– |
0.97 (0.88) |
80.80 (35.10) |
4.60 (1.71) |
141 (45) |
|
*단회투여 시 AUC = AUC0-∞; 반복투여 시 AUC = AUC0-τ †375 mg 용량에서 보정한 자료. ‡625 mg 정맥 용량에서 보정한 자료, 정맥 투여는 0.5시간 주입으로 이루어졌음. Cmax= 최대 혈장 농도; Cmin= 최소 혈장 농도; Tmax= Cmax 도달 시간; AUC = 혈중농도-시간 곡선하면적; t1/2= 반감기; CL = 전신 소실률. |
||||||
그림 1. 12시간마다 경구 투여 시 성인에서 정상 상태의 리네졸리드 혈장 농도(평균 ± 표준편차, n=16)
흡수
리네졸리드는 경구 투여 후 광범위하게 흡수됩니다. 최대 혈장 농도는 투여 약 1~2시간 후에 도달하며, 절대 생체이용율은 약 100%입니다. 따라서 리네졸리드는 경구 또는 정맥 투여 시 용량 조절이 필요 없습니다.
리네졸리드는 식사 여부와 관계없이 투여할 수 있습니다. 고지방 식이와 함께 투여하면 최대 농도 도달 시간이 1.5시간에서 2.2시간으로 지연되고 Cmax는 약 17% 감소하지만, 총 노출량(AUC0-∞)은 유사합니다.
분포
동물 및 인체 약동력 연구 결과 리네졸리드가 혈류가 잘 공급되는 조직에 잘 분포된다는 것이 확인되었습니다. 리네졸리드의 혈장 단백 결합률은 약 31%이며 농도와 무관합니다. 정상 상태에서 성인 지원자의 리네졸리드 분포 용적은 평균 40~50리터였습니다.
리네졸리드 다회 투여 후 제1상 지원자 연구에서 제한된 수의 피험자에 대해 여러 체액에서 리네졸리드 농도가 측정되었습니다. 타액 중 리네졸리드 농도 대 혈장 농도 비율은 1.2~1이었고, 땀에서는 0.55~1이었습니다.
대사
리네졸리드는 주로 모폴린 고리의 산화로 대사되며, 이로 인해 두 개의 비활성 개환 카르복실산 대사체인 아미노에톡시아세트산 대사체(A)와 하이드록시에틸 글리신 대사체(B)가 생성됩니다. 대사체 A의 형성은 효소 경로를 통해 이루어지는 것으로 추정되는 반면, 대사체 B는 in vitro에서 비효소적 화학 산화 기전에 의해 매개됩니다. in vitro 연구에서는 리네졸리드가 최소한으로 대사되며 사람 cytochrome P450에 의해 매개될 수 있음을 보여주었습니다. 그러나 리네졸리드의 대사 경로는 완전히 밝혀지지 않았습니다.
배설
리네졸리드의 총 클리어런스 중 약 65%가 신장 외 클리어런스에 해당합니다. 정상 상태에서, 투여량의 약 30%가 리네졸리드 형태로, 40%가 대사체 B 형태로, 10%가 대사체 A 형태로 소변에서 검출됩니다. 리네졸리드의 평균 신장 클리어런스는 40 mL/min로, 순 세뇨관 재흡수를 시사합니다. 리네졸리드는 거의 대변에서 검출되지 않으며, 투여량의 약 6%가 대사체 B 형태로, 3%가 대사체 A 형태로 대변에서 검출됩니다.
리네졸리드 용량이 증가함에 따라 클리어런스에 경미한 비선형성이 관찰되었으며, 이는 높은 농도에서 리네졸리드의 신장 및 비신장 클리어런스가 감소하기 때문인 것으로 보입니다. 그러나 클리어런스의 차이는 작았으며, 이는 겉보기 반감기에 반영되지 않았습니다.
특정 집단
고령 환자
고령 환자(65세 이상)에서 리네졸리드의 약동학은 유의한 변화가 없습니다. 따라서 고령 환자에 대한 용량 조절은 필요하지 않습니다.
소아 환자
단회 정맥 투여 후 리네졸리드의 약동학이 출생부터 17세까지의 소아 환자(미숙아 및 만삭아 포함), 12세부터 17세까지의 건강한 청소년 대상자 및 1주에서 12세 사이의 소아 환자에서 조사되었습니다. 연구된 소아 집단 및 성인 대상자에서 단회 정맥 투여 후 리네졸리드의 약동학 매개변수가 표 9에 요약되어 있습니다.
리네졸리드의 Cmax와 분포용적(Vss)은 소아 환자의 연령에 관계없이 유사합니다. 그러나 리네졸리드의 혈장 클리어런스는 연령에 따라 다릅니다. 생후 1주 미만의 미숙아를 제외하고, 체중 기반 클리어런스는 생후 1주에서 11세까지의 가장 어린 연령군에서 가장 빠르며, 이로 인해 성인에 비해 단회 투여 시 전신 노출(AUC)이 낮고 반감기가 짧습니다. 소아 연령이 증가함에 따라 리네졸리드의 체중 기반 클리어런스는 점차 감소하여 청소년기에는 평균 클리어런스 값이 성인 수준에 가까워집니다. 모든 소아 연령군에서 리네졸리드의 클리어런스와 전신 약물 노출(AUC)의 개체 간 변동성이 성인에 비해 증가합니다.
생후부터 11세까지의 소아 환자에서 8시간 간격으로 투여한 경우의 평균 일일 AUC 값이 12시간 간격으로 투여한 청소년 또는 성인의 값과 유사하였습니다. 따라서 11세 이하 소아 환자의 권장 용량은 8시간 간격으로 10 mg/kg입니다. 12세 이상의 소아 환자는 12시간 간격으로 600 mg를 투여해야 합니다[투여 정보 및 투여 방법 (2) 참조].
표 9. 단회 10 mg/kg 또는 600 mg 리네졸리드 정맥 주사 후 소아 및 성인에서의 리네졸리드 약동학 매개변수 (평균: (%CV); [최소, 최대 값])
|
연령 그룹 |
Cmaxmcg/mL |
Vss |
AUC*mcg•h/mL |
t1/2; |
CL |
|||||
|
신생아 환자 |
12.7 (30%) |
0.81 (24%) |
108 (47%) |
5.6 (46%) |
2.0 (52%) |
|||||
|
영아 환자 |
11.0 (27%) |
0.79 (26%) |
33 (26%) |
1.8 (28%) |
5.4 (32%) |
|||||
|
3개월~11세 소아 환자†(N=59) |
15.1 (30%) |
0.69 (28%) |
58 (54%) |
2.9 (53%) |
3.8 (53%) 12 임상 약리학 청소년 피험자 및 |
16.7 (24%) |
0.61 (15%) |
95 (44%) |
4.1 (46%) |
2.1 (53%) |
|
성인 피험자§ |
12.5 (21%) |
0.65 (16%) |
91 (33%) |
4.9 (35%) |
1.7 (34%) |
|||||
|
*AUC = 단회 투여 AUC0-∞ **이 데이터 세트에서 “미숙아”는 재태 기간 < 34주로 정의됩니다(주의: 단 1명의 신생아가 출생 후 1주일에서 28일 사이에 등록되었습니다). ***이 데이터 세트에서 “만삭아”는 재태 기간 ≥ 34주로 정의됩니다. †10 mg/kg 용량. ‡600 mg 또는 최대 600 mg까지 10 mg/kg 용량. §600 mg으로 보정된 용량. Cmax=최대 혈장 농도; Vss=분포 용적; AUC=농도-시간 곡선 하 면적; t1/2=소실 반감기; CL=체중으로 보정된 전신 클리어런스. |
||||||||||
성별
여성이 남성보다 리네졸리드의 분포 용적이 약간 낮습니다. 혈장 농도가 체중 차이로 인해 여성이 남성보다 높습니다. 600mg 투여 후 평균 경구 클리어런스는 여성이 남성보다 약 38% 낮습니다. 하지만 평균 소실 속도 상수나 반감기에는 유의한 성별 차이가 없습니다. 따라서 잘 내약되는 것으로 알려진 수준 이상의 약물 노출이 여성에게서 크게 증가하지 않을 것으로 예상됩니다. 따라서 성별에 따른 용량 조절은 필요하지 않은 것으로 보입니다.
신장 장애
모체약물인 리네졸리드의 약동학은 신장 장애 정도에 관계없이 변하지 않지만, 리네졸리드의 두 가지 주요 대사체는 신장 장애 환자에서 축적되며, 그 정도는 신장 기능 장애의 중증도에 따라 증가합니다(표 10 참조). 리네졸리드와 두 대사체의 약동학은 또한 투석을 받는 말기 신부전 환자에서 연구되었습니다. 말기 신부전 연구에서 14명의 환자에게 14.5일 동안 12시간마다 리네졸리드 600mg을 투여했습니다(표 11 참조). 신장 기능에 관계없이 유사한 리네졸리드 혈장 농도에 도달하므로 신장 장애 환자에게 용량 조절은 권장되지 않습니다. 하지만 주요 대사체의 축적 임상적 중요성에 대한 정보가 없으므로, 이러한 대사체 축적의 잠재적 위험과 리네졸리드 사용을 신중히 고려해야 합니다. 리네졸리드와 두 대사체 모두 혈액투석으로 제거됩니다. 리네졸리드의 약동학에 대한 복막투석의 영향에 관한 정보는 없습니다. 리네졸리드 투여 3시간 후 시작된 3시간 혈액투석 세션 동안 투여량의 약 30%가 제거되었으므로, 리네졸리드는 혈액투석 후에 투여해야 합니다.
표 10. 리네졸리드 단회 600mg 경구 투여 후 다양한 신장 장애 환자에서 리네졸리드 및 대사체 A, B의 평균(표준편차) AUC 및 소실 반감기
|
매개변수 |
건강한 피험자 CLCR> 80 mL/min |
중등증 신장 장애 30 < CLCR< 80 mL/min |
중증 신장 장애 10 < CLCR< 30 mL/min |
|
리네졸리드 |
|||
|
AUC0-∞, mcg h/mL |
110 (22) |
128 (53) |
127 (66) |
|
t1/2, 시간 |
6.4 (2.2) |
6.1 (1.7) |
7.1 (3.7) |
|
대사체 A |
|||
|
AUC0-48, mcg h/mL |
7.6 (1.9) |
11.7 (4.3) |
56.5 (30.6) |
|
t1/2, 시간 |
6.3 (2.1) |
6.6 (2.3) |
9.0 (4.6) |
|
대사체 B1 |
|||
|
AUC0-48, mcg h/mL |
30.5 (6.2) |
51.1 (38.5) |
203 (92) |
|
t1/2, 시간 |
6.6 (2.7) |
9.9 (7.4) |
11.0 (3.9) |
|
1 대사체 B는 리네졸리드의 주요 대사체입니다. |
|||
표 11. 매 12시간 600mg 리네졸리드를 14.5일간 투여 후 말기 신부전(ESRD) 환자에서 리네졸리드 및 대사체 A와 B의 평균(표준편차) AUC 및 반감기
|
매개 변수 |
ESRD 환자1 |
|
LINEZOLID |
|
|
AUC0-12, mcg h/mL (마지막 투여 후) |
181 (52.3) |
|
t1/2, h (마지막 투여 후) |
8.3 (2.4) |
|
대사체 A |
|
|
AUC0-12, mcg h/mL (마지막 투여 후) |
153 (40.6) |
|
t1/2, h (마지막 투여 후) |
15.9 (8.5) |
|
대사체 B2 |
|
|
AUC0-12, mcg h/mL (마지막 투여 후) |
356 (99.7) |
|
t1/2, h (마지막 투여 후) |
34.8 (23.1) |
|
1혈액투석 세션 사이에. 2대사체 B는 리네졸리드의 주요 대사체입니다. |
|
간장애
경증에서 중등도 간장애 환자(Child-Pugh class A 또는 B) 7명에서 리네졸리드의 약동학은 변화되지 않습니다. 이용 가능한 정보를 바탕으로, 경증에서 중등도 간장애 환자에서는 용량 조절이 권장되지 않습니다. 중증 간장애 환자에서는 리네졸리드 약동학이 평가되지 않았습니다.
약물 상호작용
시토크롬 P450으로 대사되는 약물
리네졸리드는 랫드에서 시토크롬 P450(CYP450) 유도체가 아닙니다. 또한 리네졸리드는 임상적으로 중요한 인간 CYP 이성체(예: 1A2, 2C9, 2C19, 2D6, 2E1, 3A4)의 활성을 억제하지 않습니다. 따라서 리네졸리드가 이러한 주요 효소에 의해 대사되는 다른 약물의 약동학에 영향을 미칠 것으로 예상되지 않습니다. 리네졸리드의 병용 투여는 CYP2C9에 의해 광범위하게 대사되는 (S)-와르파린의 약동학 특성을 크게 변화시키지 않습니다. 와르파린 및 페니토인과 같은 CYP2C9 기질 약물은 용량 조절 체제 변경 없이 리네졸리드와 함께 투여될 수 있습니다.
항균제
아즈트레오남: 리네졸리드 또는 아즈트레오남의 약동학은 병용 투여 시 변화되지 않습니다.
젠타마이신: 리네졸리드 또는 젠타마이신의 약동학은 병용 투여 시 변화되지 않습니다.
항산화제
리네졸리드와 항산화제인 비타민 C 및 비타민 E와의 잠재적 약물 상호작용이 건강한 지원자에서 연구되었습니다. 피험자는 1일차에 리네졸리드 600mg 경구 투여를 받았고, 8일차에 리네졸리드 600mg을 다시 투여받았습니다. 2일차부터 9일차까지 피험자는 비타민 C(1,000mg/일) 또는 비타민 E(800 IU/일)를 투여받았습니다. 비타민 C와 병용 시 리네졸리드의 AUC0-∞가 2.3% 증가했고, 비타민 E와 병용 시 10.9% 증가했습니다. 비타민 C 또는 비타민 E 병용 시 리네졸리드 용량 조절은 권장되지 않습니다.
강력한 CYP 3A4 유도제
리팜핀: 리팜핀이 리네졸리드 약동학에 미치는 영향이 16명의 건강한 성인 남성을 대상으로 한 연구에서 평가되었습니다. 지원자에게 리네졸리드 600mg을 하루 두 번 5회 투여했고, 리팜핀 600mg을 매일 1회 8일간 투여했습니다. 리팜핀과 리네졸리드 병용 시 리네졸리드 Cmax는 21% 감소[90% CI, 15% ~ 27%], 리네졸리드 AUC0-12는 32% 감소[90% CI, 27% ~ 37%]했습니다. 이 상호작용의 임상적 중요성은 알려져 있지 않습니다. 이 상호작용의 기전은 완전히 밝혀지지 않았지만 간 효소 유도와 관련이 있을 수 있습니다. 다른 강력한 간 효소 유도제(예: 카르바마제핀, 페니토인, 페노바르비탈)도 유사하거나 더 작은 리네졸리드 노출 감소를 유발할 수 있습니다.
모노아민 산화효소 억제
리네졸리드는 가역적이고 비선택적인 모노아민 산화효소 억제제입니다. 따라서 리네졸리드는 아드레날린성 및 세로토닌성 제제와 상호작용할 잠재력이 있습니다.
아드레날린성 약물
리네졸리드를 투여받는 일부 환자는 간접 교감신경작용 약물, 혈관수축제 또는 도파민성 약물에 대한 가역적 혈압 상승 반응이 나타날 수 있습니다. 흔히 사용되는 페닐프로판올아민 및 슈도에페드린의 경우가 구체적으로 연구되었습니다. 아드레날린성 약물 초기 용량(도파민 또는 에피네프린)을 줄여야 하며, 원하는 반응을 얻기 위해 점차 증량해야 합니다.
티라민: 정상 성인 피험자에게 리네졸리드와 100mg 이상의 티라민을 투여했을 때 중대한 혈압 상승 반응이 관찰되었습니다. 따라서 리네졸리드를 투여받는 환자는 다량의 티라민 함유 식품 또는 음료 섭취를 피해야 합니다 [환자용 안내서 정보(17) 참조].
12 임상약리학
Pseudoephedrine hydrochloride 또는 phenylpropanolamine hydrochloride: linezolid를 건강한 정상 혈압 대상자에게 투여할 때 pseudoephedrine hydrochloride (PSE) 또는 phenylpropanolamine hydrochloride (PPA)의 승압 반응이 가역적으로 증가하는 것이 관찰됩니다 [경고 및 주의사항 (5.6) 및 약물 상호작용 (7) 참조]. 유사한 연구는 고혈압 환자에서는 수행되지 않았습니다. 정상 혈압 대상자에서 수행된 상호작용 연구에서는 위약, PPA 또는 PSE 단독, linezolid 단독, 그리고 steady-state linezolid (3일 동안 12시간마다 600mg)와 4시간 간격으로 투여한 PPA (25mg) 또는 PSE (60mg) 2회 용량의 병용 투여가 혈압과 심박수에 미치는 영향을 평가했습니다. 어떤 치료에 의해서도 심박수는 영향을 받지 않았습니다. 혈압은 두 가지 병용 치료에 의해 상승했습니다. 최대 혈압 수치는 PPA 또는 PSE의 두 번째 용량 투여 후 2~3시간에 관찰되었으며, 최고치 도달 후 2~3시간 내에 기저치로 돌아왔습니다. PPA 연구의 결과는 다음과 같으며, mmHg 단위의 평균(및 범위) 최대 수축기 혈압을 보여줍니다: 위약 = 121 (103 ~ 158); linezolid 단독 = 120 (107 ~ 135); PPA 단독 = 125 (106 ~ 139); PPA + linezolid 병용 = 147 (129 ~ 176). PSE 연구의 결과는 PPA 연구와 유사했습니다. linezolid와 pseudoephedrine 또는 phenylpropanolamine 병용 투여 시 기저치 대비 최대 수축기 혈압 상승 평균값은 각각 32mmHg (범위: 20mmHg ~ 52mmHg) 및 38mmHg (범위: 18mmHg ~ 79mmHg)였습니다.
Serotonergic Agents
Dextromethorphan: dextromethorphan과의 잠재적 약물-약물 상호작용은 건강한 지원자에서 연구되었습니다. 대상자들은 linezolid 유무에 관계없이 dextromethorphan(4시간 간격으로 20mg씩 2회 용량)을 투여받았습니다. linezolid와 dextromethorphan을 투여받은 정상 대상자에서 serotonin 증후군 효과(혼란, 섬망, 안절부절, 떨림, 홍조, 발한, 고열)가 관찰되지 않았습니다.
12.4 미생물학
작용기전
Linezolid는 호기성 그람 양성균에 의한 감염 치료에 임상적 유용성을 가진 oxazolidinone 계열의 합성 항균제입니다. linezolid의 in vitro 활성 범위는 특정 그람 음성균 및 혐기성 세균도 포함합니다. Linezolid는 박테리아 23S ribosomal RNA의 50S 아단위에 있는 부위에 결합하여 박테리아 증식에 필수적인 기능적 70S 개시 복합체 형성을 방해합니다. time-kill 연구 결과에 따르면 linezolid는 enterococci 및 staphylococci에 대해 bacteriostatic한 것으로 나타났습니다. streptococci의 경우 linezolid는 대부분의 분리주에 대해 bactericidal한 것으로 확인되었습니다.
내성
In vitro 연구에서 23S rRNA의 point mutation이 linezolid 내성과 관련이 있는 것으로 나타났습니다. vancomycin 내성 Enterococcus faecium이 임상 사용 중 linezolid에 내성을 나타내게 되었다는 보고가 발표되었습니다. 임상 사용 중 Staphylococcus aureus (methicillin 내성)가 linezolid에 내성을 발현했다는 보고도 있습니다. 이러한 유기체의 linezolid 내성은 유기체의 23S rRNA (2,576 위치에서 guanine이 thymine으로 치환)의 point mutation과 관련이 있습니다. 23S rRNA 또는 리보솜 단백질 (L3 및 L4)을 인코딩하는 염색체 유전자의 돌연변이를 통해 oxazolidinone에 내성인 유기체는 일반적으로 linezolid에 교차 내성을 나타냅니다. 또한 효소 methyltransferase에 의해 매개되는 포도상구균의 linezolid 내성이 보고되었습니다. 이 내성은 포도상구균 사이에서 전달 가능한 plasmid에 위치한 cfr (chloramphenicol-florfenicol) 유전자에 의해 매개됩니다.
다른 항균제와의 상호작용
In vitro 연구에서 linezolid와 vancomycin, gentamicin, rifampin, imipenem-cilastatin, aztreonam, ampicillin 또는 streptomycin 사이에 상가 작용 또는 무관함이 입증되었습니다.
Linezolid는 in vitro 및 임상 감염에서 다음 미생물의 대부분의 분리주에 대해 활성을 나타내는 것으로 확인되었습니다 [적응증 및 사용법 (1) 참조].
그람 양성균
Enterococcus faecium (vancomycin 내성 분리주에 한함)
Staphylococcus aureus (methicillin 내성 분리주 포함)
Streptococcus agalactiae
Streptococcus pneumoniae
Streptococcus pyogenes
다음 in vitro 데이터를 사용할 수 있지만 임상적 의의는 알려져 있지 않습니다. 다음 박테리아의 90% 이상이 유사 속의 유기체에 대한 linezolid 감수성 breakpoint 이하의 in vitro MIC를 나타냅니다. 이러한 박테리아에 의한 임상 감염증을 치료하는 데 있어 linezolid의 안전성과 유효성은 적절하고 잘 통제된 임상시험에서 확립되지 않았습니다.
그람 양성균
Enterococcus faecalis (vancomycin 내성 분리주 포함)
Enterococcus faecium (vancomycin 감수성 분리주)
Staphylococcus epidermidis (methicillin 내성 분리주 포함)
Staphylococcus haemolyticus
Viridans group streptococci
그람 음성균
Pasteurella multocida
감수성 시험
이 약물에 대해 FDA가 인정하는 감수성 시험 해석 기준 및 관련 시험 방법과 품질 관리 표준에 대한 구체적인 정보는 다음을 참조하십시오: https://www.fda.gov/STIC.
13 비임상 독성학
13.1 발암성, 변이원성, 생식능력 장애
Linezolid의 발암 가능성을 평가하기 위한 동물에서의 평생 연구는 수행되지 않았습니다. 돌연변이성 검사(Ames bacterial reversion 및 CHO cell mutation), in vitro unscheduled DNA synthesis (UDS) 검사, 인간 림프구에서의 in vitro 염색체 이상 검사 및 in vivo 마우스 micronucleus 검사를 포함한 일련의 검사에서 돌연변이성 또는 clastogenic 가능성이 발견되지 않았습니다.
Linezolid는 교미 전 14일부터 임신 7일까지 최대 100 mg/kg/day의 경구 용량을 투여받은 성인 암컷 랫드의 수태능 또는 생식 능력에 영향을 미치지 않았습니다. 예상 인체 노출 수준과 거의 동일하거나 그 이상의 노출에서 ≥ 50 mg/kg/day의 용량을 투여했을 때 성인 수컷 랫드의 수태능과 생식 능력을 가역적으로 감소시켰습니다(노출 비교는 AUC 기준). 가역적인 생식능력 영향은 정자 형성의 변화를 통해 매개되었습니다. 영향을 받은 정자에는 비정상적으로 형성되고 배열된 미토콘드리아가 포함되어 있었고 생존 능력이 없었습니다. 생식능력 감소와 함께 epididymis에서 상피세포 비대 및 과형성이 관찰되었습니다. 개에서는 유사한 epididymis 변화가 관찰되지 않았습니다.
청소년기에 약물에 노출된 성적으로 성숙한 수컷 랫드에서는 linezolid로 치료한 후 생식 능력이 약간 감소한 것으로 관찰되었습니다(생후 7일부터 36일까지 50 mg/kg/day, 생후 37일부터 55일까지 100 mg/kg/day). 이는 3개월에서 11세 소아 환자에서 관찰된 평균 AUC보다 최대 1.7배 높은 노출에 해당합니다. 더 짧은 치료 기간, 즉 자궁 내부터 초기 신생아기(임신 6일부터 생후 5일), 신생아기 노출(생후 5일부터 21일) 또는 청소년기 노출(생후 22일부터 35일)에는 생식능력 감소가 관찰되지 않았습니다. 생후 22일부터 35일까지 치료받은 랫드에서는 정자 운동성의 가역적 감소와 정자 형태의 변화가 관찰되었습니다.
13.2 동물 독성학 및/또는 약리학
Linezolid 독성의 표적 장기는 청소년 및 성인 랫드와 개에서 유사했습니다. 골수 저형성/조혈 감소, 비장 및 간의 골수외 조혈 감소, 순환 적혈구, 백혈구 및 혈소판 수치 감소로 입증된 용량 및 시간 의존적 골수 억제가 동물 연구에서 관찰되었습니다. 흉선, 림프절 및 비장에서 림프구 고갈이 발생했습니다. 일반적으로 림프구 소견은 식욕부진, 체중 감소 및 체중 증가 억제와 관련이 있었으며, 이는 관찰된 영향에 기여했을 수 있습니다.
6개월 동안 경구 linezolid를 투여받은 랫드에서 80 mg/kg/day에서 좌골 신경의 비가역적이고 경미한 축삭 변성이 관찰되었습니다. 3개월 중간 부검에서 이 용량 수준에서 1마리 수컷에서도 좌골 신경의 경미한 변성이 관찰되었습니다. 시신경 변성의 증거를 조사하기 위해 관류 고정 조직의 민감한 형태학적 평가를 수행했습니다. 6개월 투여 후 2마리 수컷 랫드에서 경미에서 중등도의 시신경 변성이 명백했지만, 급성 소견의 특성과 비대칭적 분포로 인해 약물과의 직접적인 관련성은 불분명했습니다. 관찰된 신경 변성은 노화 랫드에서 보고된 자발적 편측 시신경 변성과 현미경적으로 유사하며 일반적인 배경 변화의 악화일 수 있습니다.
이러한 영향은 일부 인체 대상에서 관찰된 노출 수준과 유사한 노출 수준에서 관찰되었습니다. 조혈 및 림프구 영향은 가역적이었지만, 일부 연구에서는 회복 기간 내에 완전히 회복되지 않았습니다.
14 임상 연구
14.1 성인
병원 내 폐렴
임상적이고 방사선학적으로 확인된 병원 내 폐렴 환자들이 무작위 배정, 다기관, 이중 맹검 시험에 등록되었습니다. 환자들은 7일에서 21일 동안 치료를 받았습니다. 한 그룹은 12시간마다 리네졸리드 정맥 주사 600mg를 투여받았고, 다른 그룹은 12시간마다 반코마이신 1g를 정맥 주사로 투여받았습니다. 두 그룹 모두 임상적으로 지시된 경우 병행하여 아즈트레오남(8시간마다 1-2g 정맥 주사)을 투여받았습니다. 연구에는 리네졸리드 치료군 203명, 반코마이신 치료군 193명이 등록되었습니다. 122명(60%)의 리네졸리드 치료 환자와 103명(53%)의 반코마이신 치료 환자가 임상적으로 평가 가능했습니다. 임상적으로 평가 가능한 환자들의 치유율은 리네졸리드 치료군에서 57%, 반코마이신 치료군에서 60%였습니다. 인공호흡기 관련 폐렴 환자들 중 임상적으로 평가 가능한 환자들의 치유율은 리네졸리드 치료군에서 47%, 반코마이신 치료군에서 40%였습니다. 처치 전에 병원체가 분리된 94명의 리네졸리드 치료 환자와 83명의 반코마이신 치료 환자를 포함한 수정 의향 치료군(MITT) 분석에서는 리네졸리드 치료군의 치유율이 57%, 반코마이신 치료군의 치유율이 46%였습니다. 미생물학적으로 평가 가능한 환자들의 병원체별 치유율은 표 12에 제시되어 있습니다.
표 12. 미생물학적으로 평가 가능한 성인 병원 내 폐렴 환자의 치료 종결 시점 치유율
|
병원체 |
치유됨 |
|
|
리네졸리드 |
반코마이신 |
|
|
Staphylococcus aureus |
23/38 (61) |
14/23 (61) |
|
메티실린 내성S. aureus |
13/22 (59) |
7/10 (70) |
|
Streptococcus pneumoniae |
9/9 (100) |
9/10 (90) |
복합성 피부 및 피부구조 감염증
임상적으로 확인된 복합성 피부 및 피부구조 감염증 성인 환자들이 무작위 배정, 다기관, 이중 맹검, 이중 가짜약 시험에 등록되었습니다. 총 10일에서 21일간 치료를 위해 한 그룹은 정맥 주사 후 경구 투여 약물을 받았습니다. 한 그룹은 리네졸리드 정맥 주사 600mg를 12시간마다, 이어서 리네졸리드 정제 600mg를 12시간마다 투여받았고, 다른 그룹은 6시간마다 옥사실린 2g을 정맥 주사하고 이어서 6시간마다 디클록사실린 500mg을 경구 투여받았습니다. 임상적으로 지시된 경우 환자는 병행하여 아즈트레오남을 투여받을 수 있었습니다. 연구에는 리네졸리드 치료군 400명, 옥사실린 치료군 419명이 등록되었습니다. 245명(61%)의 리네졸리드 치료 환자와 242명(58%)의 옥사실린 치료 환자가 임상적으로 평가 가능했습니다. 임상적으로 평가 가능한 환자들의 치유율은 리네졸리드 치료군에서 90%, 옥사실린 치료군에서 85%였습니다. 연구 참여 기준을 모두 충족한 316명의 리네졸리드 치료 환자와 313명의 옥사실린 치료 환자를 포함한 수정 의향 치료군(MITT) 분석에서는 리네졸리드 치료군의 치유율이 86%, 옥사실린 치료군의 치유율이 82%였습니다. 미생물학적으로 평가 가능한 환자들의 병원체별 치유율은 표 13에 제시되어 있습니다.
표 13. 미생물학적으로 평가 가능한 성인 복합성 피부 및 피부구조 감염증 환자의 치료 종결 시점 치유율
|
병원체 |
치유됨 |
|
|
리네졸리드 |
옥사실린/디클록사실린 |
|
|
Staphylococcus aureus |
73/83 (88) |
72/84 (86) |
|
메티실린 내성S. aureus |
2/3 (67) |
0/0 (-) |
|
Streptococcus agalactiae |
6/6 (100) |
3/6 (50) |
|
Streptococcus pyogenes |
18/26 (69) |
21/28 (75) |
별도의 연구에서 메티실린 내성 Staphylococcus aureus(MRSA) 감염 치료를 위한 리네졸리드 사용에 대한 추가적인 경험을 제공했습니다. 이는 입원 중인 MRSA 감염이 확인되거나 의심되는 성인 환자를 대상으로 한 무작위 배정, 공개 시험이었습니다.
한 그룹의 환자들은 리네졸리드 정맥 주사 600mg를 12시간마다, 이어서 리네졸리드 정제 600mg를 12시간마다 투여받았습니다. 다른 그룹의 환자들은 반코마이신 1g을 12시간마다 정맥 주사로 투여받았습니다. 두 그룹 모두 7일에서 28일 동안 치료를 받았고, 임상적으로 지시된 경우 아즈트레오남 또는 젠타마이신을 병행 투여할 수 있었습니다. 미생물학적으로 평가 가능한 MRSA 피부 및 피부구조 감염 환자들의 치유율은 리네졸리드 치료군에서 26/33(79%), 반코마이신 치료군에서 24/33(73%)였습니다.
당뇨병성 족부 감염
임상적으로 문서화된 복잡한 피부 및 피부구조 감염(“당뇨병성 족부 감염”)이 있는 성인 당뇨병 환자가 무작위 배정(2:1 비율), 다기관, 공개 라벨 시험에 등록되었으며, 이 시험에서는 총 14일에서 28일 동안 정맥 내 또는 경구로 투여되는 연구 약물을 비교했습니다. 한 군의 환자는 리네졸리드 600mg을 12시간마다 정맥 내 또는 경구로 투여받았고, 다른 군의 환자는 암피실린/설박탐 1.5g부터 3g을 정맥 내로 또는 아목시실린/클라불란산 500mg부터 875mg을 8시간에서 12시간마다 경구로 투여받았습니다. 암피실린/설박탐이 시판되지 않는 국가에서는 정맥 요법으로 아목시실린/클라불란산을 6시간마다 500mg에서 2g 투여했습니다. 비교군 환자에서 MRSA가 족부 감염에서 분리되면 반코마이신 1g을 12시간마다 정맥 내로 투여받을 수 있었습니다. 양 치료군 환자 모두에서 병원균 음성 간균이 감염 부위에서 분리되는 경우 아즈트레오남 8시간마다 1g에서 2g을 정맥 내로 추가로 투여받을 수 있었습니다. 모든 환자는 당뇨병성 족부 감염 치료에 일반적으로 요구되는 적절한 보조 치료법인 반창고 제거와 압박 제거 등을 받을 수 있었으며, 대부분의 환자가 이러한 치료를 받았습니다. Intent-to-treat(ITT) 연구 집단에는 리네졸리드 치료 환자 241명과 비교 치료 환자 120명이 있었습니다. 212명(86%)의 리네졸리드 치료 환자와 105명(85%)의 비교 치료 환자가 임상적으로 평가 가능했습니다. ITT 집단에서는 불확정 및 누락 평가가 실패로 간주되는 경우 리네졸리드 치료 환자의 치유율이 68.5%(165/241), 비교 치료 환자의 치유율이 64%(77/120)였습니다. 불확정 및 누락 결과를 제외한 임상적으로 평가 가능한 환자에서 치유율은 리네졸리드 치료 환자 83%(159/192), 비교 치료 환자 73%(74/101)였습니다. 감염 부위나 혈액에서 그람 양성 병원균이 분리되고, 연구 전체 집단에 비해 기저 골수염 증거가 적으며, 금기 항균제를 투여받지 않은 121명의 리네졸리드 치료 환자와 60명의 비교 치료 환자를 대상으로 한 중요한 사후 분석에서는 리네졸리드 치료 환자의 치유율이 71%(86/121), 비교 치료 환자의 치유율이 63%(38/60)였습니다. 상기 분석에는 보조 요법 사용이 고려되지 않았습니다. 미생물학적으로 평가 가능한 환자의 병원균별 치유율은 표 14에 제시되었습니다.
표 14. 미생물학적으로 평가 가능한 당뇨병성 족부 감염 성인 환자에서 검사 시점 방문 시 치유율
|
병원균 |
치유 |
|
|
리네졸리드 |
비교군 |
|
|
Staphylococcus aureus |
49/63 (78) |
20/29 (69) |
|
메티실린 내성S. aureus |
12/17 (71) |
2/3 (67) |
|
Streptococcus agalactiae |
25/29 (86) |
9/16 (56) |
반코마이신 내성 엔테로코커스 감염
문서화되었거나 의심되는 반코마이신 내성 엔테로코커스 감염이 있는 성인 환자를 대상으로 무작위 배정, 다기관, 이중 맹검 시험이 수행되었으며, 이 시험에서는 7일에서 28일 동안 12시간마다 정맥 내 또는 경구로 고용량 리네졸리드(600mg)와 저용량 리네졸리드(200mg)를 비교했습니다. 환자는 아즈트레오남 또는 아미노글리코사이드를 병용할 수 있었습니다. 고용량 리네졸리드군에 79명, 저용량 리네졸리드군에 66명이 무작위 배정되었습니다. 기저치에서 문서화된 반코마이신 내성 엔테로코커스 감염이 있는 Intent-to-treat(ITT) 집단은 고용량군에 65명, 저용량군에 52명이었습니다.
기저치에서 문서화된 반코마이신 내성 엔테로코커스 감염이 있는 ITT 집단의 감염 부위별 치유율이 표 15에 제시되었습니다. 이 치유율에는 누락 또는 불확정 평가가 포함되지 않습니다. 고용량군의 치유율이 저용량군에 비해 높았으나 0.05 수준에서 통계적으로 유의하지는 않았습니다.
표 15. 기저치에서 문서화된 반코마이신 내성 엔테로코커스 감염이 있는 ITT 성인 환자군에서 검사 시점 방문 시 치유율
| 감염 부위 | 치유 | |
|---|---|---|
| 리네졸리드 600mg 12시간마다 n/N (%) |
리네졸리드 200mg 12시간마다 n/N (%) |
|
|
모든 부위 |
39/58 (67) |
24/46 (52) |
|
동반 균혈증이 있는 모든 부위 |
10/17 (59) |
4/14 (29) |
|
원인불명 균혈증 |
5/10 (50) |
2/7 (29) |
|
피부 및 피부구조 |
9/13 (69) |
5/5 (100) |
|
요로 |
12/19 (63) |
12/20 (60) |
|
폐렴 |
2/3 (67) |
0/1 (0) |
|
기타* |
11/13 (85) |
5/13 (39) |
|
*간농양, 담도 패혈증, 괴사성 담낭, 복막 농양, 췌장염 및 카테터 관련 감염과 같은 감염원을 포함합니다. |
||
14.2 소아 환자
그람 양성균에 의한 감염
한 안전성 및 유효성 연구는 메티실린 내성 및 감수성 Staphylococcus aureus 및 반코마이신 내성 Enterococcus faecium을 포함한 그람 양성균 병원체로 인한 병원 내 폐렴, 복잡한 피부 및 피부 구조 감염 및 기타 감염에 대한 리네졸리드의 소아 환자 사용 경험을 제공했습니다. 문서화되거나 의심되는 그람 양성균으로 인한 감염이 있는 출생에서 11세까지의 소아 환자들이 무작위 배정, 공개 라벨, 비교 대조 시험에 등록되었습니다. 한 그룹의 환자는 리네졸리드 정맥 주사 10 mg/kg를 8시간마다 투여받았고 이어서 리네졸리드 현탁액 10 mg/kg를 8시간마다 투여받았습니다. 두 번째 그룹은 vancomycin 10~15 mg/kg를 연령과 신장 클리어런스에 따라 6~24시간 마다 정맥 투여받았습니다. 확인된 VRE 감염이 있는 환자는 연구의 세 번째 군으로 배치되어 리네졸리드 10 mg/kg를 8시간마다 정맥 및/또는 경구 투여받았습니다. 모든 환자는 총 10~28일간 치료받았으며 임상적으로 지시된 경우 그람 음성 항균제를 병용할 수 있었습니다. 의향 치료(ITT) 집단에서 리네졸리드 군에 206명, 반코마이신 군에 102명의 환자가 무작위 배정되었습니다. ITT, MITT 및 임상적으로 평가 가능한 환자의 치유율은 표 16에 제시되어 있습니다. 연구가 완료된 후 추가로 4일에서 16세 사이의 13명의 환자가 이 연구의 VRE 군 공개 라벨 연장부에 등록되었습니다. 표 17은 이 연구의 연장 부분에서 반코마이신 내성 Enterococcus faecium을 가진 미생물학적으로 평가 가능한 환자를 포함하여 그람 양성 병원체로 인한 감염이 있는 미생물학적으로 평가 가능한 소아 환자의 병원체별 임상 치유율을 제공합니다.
표 16. 전체 집단 및 기저 진단별 의향 치료, 수정 의향 치료 및 임상적으로 평가 가능한 소아 환자의 검사 시점 치유율
| 집단 | ITT | MITT* | 임상적으로 평가 가능 | |||
|---|---|---|---|---|---|---|
| 리네졸리드 n/N (%) |
반코마이신 n/N (%) |
리네졸리드 n/N (%) |
반코마이신 n/N (%) |
리네졸리드 n/N (%) |
반코마이신 n/N (%) |
|
|
모든 진단 |
150/186 (81) |
69/83 (83) |
86/108 (80) |
44/49 (90) |
106/117 (91) |
49/54 (91) |
|
복잡한 피부 및 피부 구조 감염 |
61/72 (85) |
31/34 (91) |
37/43 (86) |
22/23 (96) |
46/49 (94) |
26/27 (96) |
|
병원 내 폐렴 |
13/18 (72) |
11/12 (92) |
5/6 (83) |
4/4 (100) |
7/7 (100) |
5/5 (100) |
|
*MITT = 기저 시 그람 양성 병원체가 단일로 분리된 ITT 환자. |
||||||
표 17. 그람 양성 병원체 감염이 있는 미생물학적으로 평가 가능한 소아 환자의 검사 시점 치유율
|
병원체 |
미생물학적으로 평가 가능 |
|
|
리네졸리드 |
반코마이신 |
|
|
반코마이신 내성Enterococcus faecium |
6/8 (75)* |
0/0 (-) |
|
Staphylococcus aureus |
36/38 (95) |
23/24 (96) |
|
메티실린 내성S. aureus |
16/17 (94) |
9/9 (100) |
|
Streptococcus pyogenes |
2/2 (100) |
1/2 (50) |
|
*이 연구의 공개 라벨 연장부에 등록된 7명의 환자 데이터를 포함합니다. |
||
16 공급/보관 및 취급 방법
16.2 정제
Linezolid 정제, 600 mg은 한 면에 “AN 777″이 각인되어 있고 다른 면은 무지의 흰색에서 미백색을 띠는 변형된 캡슐 모양의 필름코팅정으로 공급됩니다.
다음과 같이 제공됩니다:
20정 병: NDC 65162-777-02
30정 병: NDC 65162-777-03
100정 병: NDC 65162-777-10
16.4 보관 및 취급
20°~25°C (68°~77°F)에서 보관합니다[USP Controlled Room Temperature 참조]. 빛으로부터 보호하십시오. 습기로부터 보호하기 위해 병을 꼭 닫아 두십시오.
17 환자 상담 정보
중요 투여 지침
환자에게 linezolid 정제는 식사와 함께 또는 식사 없이 복용할 수 있음을 알려줍니다.
말초 및 시신경 신경병증
환자에게 linezolid 정제 복용 중 시력 변화가 나타나면 의사에게 알리도록 조언합니다 [경고 및 주의사항 (5.2) 참조].
세로토닌 증후군
환자에게 세로토닌 재흡수 억제제 또는 기타 항우울제 및 opioid를 포함한 세로토닌성 약물을 복용 중이라면 의사에게 알리도록 조언합니다 [경고 및 주의사항 (5.3) 참조].
혈압 상승을 유발할 수 있는 잠재적 상호작용
- 환자에게 고혈압 병력이 있다면 의사에게 알리도록 조언합니다.
- 환자에게 linezolid 정제 복용 중에는 tyramine 함량이 높은 음식이나 음료를 많이 섭취하지 않도록 조언합니다. Tyramine 함량이 높은 식품에는 숙성 치즈, 발효 또는 건조 육류, sauerkraut, 간장, tap beers, 그리고 적포도주와 같이 풍미를 개선하기 위해 숙성, 발효, 절임 또는 훈연 과정을 거친 단백질 변화 식품이 포함됩니다. 단백질이 풍부한 음식을 장기간 보관하거나 부적절하게 냉장할 경우 tyramine 함량이 증가할 수 있습니다.
- 환자에게 감기약 및 충혈 완화제와 같이 pseudoephedrine hydrochloride 또는 phenylpropanolamine hydrochloride를 함유한 약물을 복용 중이라면 의사에게 알리도록 조언합니다 [경고 및 주의사항 (5.6) 참조].
젖산 산증
환자에게 linezolid 정제 투여 중 반복적인 구역 또는 구토 증상이 나타나면 의사에게 알리도록 조언합니다 [경고 및 주의사항 (5.7) 참조].
경련
환자에게 경련 또는 발작 병력이 있다면 의사에게 알리도록 조언합니다 [경고 및 주의사항 (5.8) 참조].
저혈당
환자에게 당뇨병이 있다면 의사에게 알리도록 조언합니다. Linezolid 치료 시 발한 및 진전과 함께 저혈당이 발생할 수 있습니다. 이러한 반응이 발생하면 환자는 적절한 치료를 위해 의사 또는 다른 의료 전문가에게 연락해야 합니다 [경고 및 주의사항 (5.9) 참조].
저나트륨혈증 및/또는 SIADH
저나트륨혈증 위험이 있는 환자에게 혼동, 기면, 전신 쇠약 및 호흡 곤란 등 저나트륨혈증 및/또는 SIADH의 징후와 증상이 나타나면 의사에게 알리도록 조언합니다 [경고 및 주의사항 (5.10) 참조].
항균 내성
환자에게 linezolid를 포함한 항균제는 세균 감염 치료에만 사용해야 한다고 조언해야 합니다. 이들은 바이러스 감염(예: 감기)은 치료하지 않습니다. 세균 감염 치료를 위해 linezolid가 처방되면, 치료 초기에 증상이 호전되는 것이 일반적이지만 약물은 정확히 지시된 대로 복용해야 한다고 환자에게 알려야 합니다. 복용을 건너뛰거나 치료 과정을 완료하지 않으면 (1) 즉각적인 치료 효과가 감소하고 (2) 세균이 내성을 발현하여 향후 linezolid 또는 다른 항균제로 치료할 수 없게 될 가능성이 높아집니다.
설사
설사는 항균제로 인해 흔히 발생하는 문제이며, 보통 항균제 복용을 중단하면 사라집니다. 때로는 항균제 복용을 시작한 후, 마지막 항균제 복용 후 2개월 이상이 지난 시점에도 (복통 및 발열을 동반하거나 동반하지 않은) 물설사 및 혈변이 발생할 수 있습니다. 이런 증상이 발생하면 환자는 가능한 빨리 의사에게 연락해야 합니다 [경고 및 주의사항 (5.5) 참조].
불임
남성 환자에게 linezolid 정제가 가역적으로 생식력을 손상시킬 수 있음을 알려줍니다 [특정 집단에서의 사용 (8.3) 참조].
이 제품의 라벨링은 업데이트되었을 수 있습니다. 가장 최근의 처방 정보는 www.amneal.com을 방문하십시오.
제조사:
Amneal Pharmaceuticals Pvt. Ltd.
Ahmedabad 382220, INDIA
판매사:
Amneal Pharmaceuticals LLC
Bridgewater, NJ 08807
Rev. 11-2023-10
주요 표시 패널
NDC 65162-777-02
Linezolid 정제, 600 mg
20 정
Amneal Pharmaceuticals LLC


