의약품 제조업체: AstraZeneca Pharmaceuticals LP (Updated: 2024-02-08)
의약품 정보 요약
LOKELMA® (소듐 지르코늄 사이클로실리케이트) 경구 현탁액
최초 미국 승인: 2018년
적응증 및 용법
투여 용량 및 투여 방법
금기사항
없음. (4)
주의사항
이상반응
LOKELMA 치료 시 가장 흔한 이상반응: 경증 ~ 중등도 부종. (6.1)
의심되는 이상반응이 있으면 AstraZeneca 1-800-236-9933번 또는 FDA 1-800-FDA-1088번 또는 www.fda.gov/medwatch에 연락해 주십시오.
환자 상담 정보는 17을 참조하십시오.
수정: 2024년 2월
목차
전체 처방 정보: 목차*
1 적응증 및 용법
2 투여량 및 투여방법
2.1 권장 투여량
2.2 만성 혈액투석 환자의 투여량 조정
2.3 재구성 및 투여
3 제형 및 강도
4 금기사항
5 경고 및 주의사항
5.1 운동 장애가 있는 환자의 위장관 부작용
5.2 부종
5.3 혈액투석 환자의 저칼륨혈증
5.4 진단 검사
6 이상반응
6.1 임상시험 경험
7 약물 상호작용
8 특정 집단에서의 사용
8.1 임신
8.2 모유수유
8.4 소아 사용
8.5 고령 사용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
14 임상 연구
14.1 연구 1
14.2 연구 2
14.3 11개월 연장 연구
14.4 연구 3
14.5 연구 4
16 공급 형태/보관 및 취급 방법
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
LOKELMA는 성인의 고칼륨혈증 치료에 사용됩니다.
사용 제한
LOKELMA는 발현 지연 효과 때문에 생명을 위협하는 고칼륨혈증의 응급 치료에 사용해서는 안 됩니다[임상 약리학(12.2) 및 임상 연구(14) 참조].
2 투약량 및 투여방법
2.1 권장 투여량
고칼륨혈증의 초기 치료를 위해 LOKELMA의 권장 투여량은 48시간 동안 하루 세번 10g입니다. LOKELMA를 물에 현탁액 형태로 경구 투여하십시오[투여량 및 투여방법(2.3)참조].
지속 치료를 위한 권장 투여량은 하루 10g입니다. 혈청 칼륨 수치를 모니터링하고 목표 범위에 따라 LOKELMA의 투여량을 조절하십시오. 유지 치료 중 혈청 칼륨 수치에 따라 1주일 이상의 간격으로 5g씩 증량할 수 있습니다. 혈청 칼륨 수치가 목표 범위 이하이면 LOKELMA의 투여량을 줄이거나 투여를 중단하십시오. 권장 유지 투여량 범위는 2일에 한번 5g에서 하루 15g입니다.
2.2 만성 혈액투석 환자의 투여량 조절
만성 혈액투석 환자의 경우, 투석이 없는 날에만 LOKELMA를 투여하십시오.
투석이 없는 날, 시작 투여량은 하루 5g입니다. 혈청 칼륨 수치가 6.5 mEq/L 이상인 환자의 경우, 투석이 없는 날 하루 10g으로 시작할 수 있습니다. 긴 간격의 투석이 없는 기간 후 투석 전 혈청 칼륨 수치를 모니터링하고 목표 범위에 따라 LOKELMA의 투여량을 조절하십시오.
투여 시작 및 투여량 조절 후 1주일 후에 혈청 칼륨을 평가하십시오. 투석이 없는 날 권장 유지 투여량 범위는 하루 5g에서 15g입니다.
다음과 같은 경우 LOKELMA의 투여를 중단하거나 투여량을 줄이십시오:
- •
- 긴 간격의 투석이 없는 기간 후 투석 전 수치 기준으로 혈청 칼륨 수치가 목표 범위 이하로 떨어지는 경우, 또는;
- •
- 임상적으로 중요한 저칼륨혈증이 발생하는 경우
2.3 현탁 및 투여
일반적으로 다른 경구 약물은 LOKELMA 투여 최소 2시간 전 또는 2시간 후에 투여해야 합니다[약물 상호작용(7)참조].
환자에게 약포 전체 내용물을 약 3큰술의 물이 담긴 컵에 넣고 잘 저어 즉시 마시도록 지시하십시오. 컵에 가루가 남아 있으면 물을 더 넣고 저어서 남김없이 마시도록 하십시오.
3 투여 형태 및 강도
경구 현탁액: 호일 라이너 포장에 5g 또는 10g의 흰색에서 회색 가루.
4 금기 사항
없음.
5 경고 및 주의사항
5.1 운동 장애 환자에서의 위장관 이상반응
LOKELMA는 중증 변비, 장폐색 또는 장폐쇄, 비정상적인 수술 후 장운동 장애 등의 질환을 가진 환자에서 연구되지 않았으며 효과가 없을 수 있고 위장관 상태를 악화시킬 수 있으므로 이러한 환자에서는 LOKELMA 사용을 피하십시오.
5.2 부종
LOKELMA 5g 당 약 400mg의 나트륨을 함유하고 있지만 환자에 의한 흡수 정도는 알려져 있지 않습니다. LOKELMA의 임상시험에서 부종이 관찰되었으며 일반적으로 경증에서 중등증 정도였고, 1일 15g 투여군에서 더 흔히 나타났습니다. 나트륨 섭취를 제한해야 하거나 체액 과다에 민감한 환자(예: 심부전 또는 신질환)에서는 부종 증상을 모니터링하십시오. 필요 시 환자에게 식이 나트륨 조절을 조언하십시오. 필요에 따라 이뇨제 용량을 증가시키십시오 [이상반응(6) 참조].
만성 혈액투석 환자를 대상으로 한 LOKELMA 임상시험에서 대부분 환자는 투석 없는 날 1일 5-10g을 투여받았으며, LOKELMA군과 위약군 간 투석 간 체중 증가(체액 저류 척도)의 평균 변화값에 차이가 없었습니다.
5.3 혈액투석 환자에서의 저칼륨혈증
혈액투석 환자는 LOKELMA로 인한 급성 질환(예: 경구 섭취 감소, 설사 등과 관련된 질환)으로 저칼륨혈증 위험이 증가할 수 있습니다. 이러한 경우 칼륨 수치에 따라 LOKELMA 용량을 조절하는 것을 고려하십시오.
6 이상반응
다음의 이상반응은 라벨의 다른 부분에서 더 자세히 다루어집니다:
- •
- 부종 [경고 및 주의사항 (5.2) 참조].
6.1 임상 연구 경험
임상시험은 광범위하게 다양한 조건 하에서 실시되므로, 한 약물의 임상시험에서 관찰된 이상반응 발생률을 다른 약물의 임상시험 발생률과 직접 비교할 수 없으며, 실제 사용 환경에서의 발생률을 반영하지 않을 수 있습니다.
고칼륨혈증이 있는 비투석 환자를 대상으로 한 LOKELMA의 안전성 및 유효성 임상시험에서의 총 노출은 1,760명의 환자였으며, 그 중 652명은 최소 6개월, 507명은 최소 1년 동안 LOKELMA에 노출되었습니다.
위약-대조 시험에 참여한 인구 집단(n=1,009)은 22세에서 96세의 연령, 여성(n=454), 백인(n=859) 및 흑인(n=130)이 포함되었습니다. 환자들은 만성 신질환, 심부전, 당뇨병과 같은 동반 질환과 관련하여 고칼륨혈증이 있었습니다.
최대 28일 동안 1일 1회 LOKELMA 5g, 10g 또는 15g 투여 군에서의 부종 발생률은 각각 4.4%, 5.9%, 16.1%였으며, 위약 군에서는 2.4%였습니다. 대부분의 환자가 1일 1회 15g 미만의 용량으로 투여받은 장기 비대조 시험에서는 부종(부종, 전신부종, 말초부종)의 이상반응 발생률이 8 ~ 11%였습니다.
주로 아시아 인구가 포함된 국가에서 실시된 임상 시험의 통합 분석에서 LOKELMA 투여군의 예상 발생률은 10g 및 5g의 경우 각각 9% 및 5%였습니다. 변비는 용량 조절 또는 투여 중단으로 해결되었습니다. 위약군에서는 변비 사례가 보고되지 않았습니다.
검사실 검사치 이상
비투석 환자를 대상으로 한 임상시험에서 LOKELMA 투여군의 4.1%에서 혈청 칼륨 수치 3.5 mEq/L 미만의 저칼륨혈증이 발생했으며, 이는 용량 감량 또는 LOKELMA 투여 중단으로 해결되었습니다. 만성 혈액투석 환자를 대상으로 한 LOKELMA 임상시험에서는 LOKELMA군과 위약군 모두에서 5%의 환자에서 투석 전 저칼륨혈증(혈청 칼륨 <3.5 mEq/L)이 발생했으며, LOKELMA군과 위약군에서 각각 3%와 1%의 환자에서 혈청 칼륨 <3.0 mEq/L이 발생했습니다.
7 약물 상호작용
LOKELMA는 일시적으로 위 pH를 높일 수 있습니다. 그 결과 LOKELMA는 pH 의존적 용해도를 나타내는 병용 투여 약물의 흡수를 변화시켜, 이러한 약물이 LOKELMA 투여 시점과 가까운 시간에 투여되는 경우 해당 약물의 유효성이나 안전성이 변화될 수 있습니다. 일반적으로, 다른 경구 약물은 LOKELMA 투여 최소 2시간 전 또는 2시간 후에 투여해야 합니다 [투여량 및 투여방법(2.3) 및 임상 약리학(12.3) 참조]. pH 의존적 용해도를 나타내지 않는 약물의 경우, LOKELMA가 전신 노출에 영향을 미치지 않을 것으로 예상되므로 시간 간격을 둘 필요가 없습니다.
8 특정 인구에서의 사용
8.5 노인 사용
LOKELMA의 임상 연구에 참여한 총 대상자 중 58%가 65세 이상이었고, 25%가 75세 이상이었습니다. 이들 환자와 젊은 환자 간에 전반적인 안전성이나 효능의 차이는 관찰되지 않았습니다.
11 설명
LOKELMA는 경구 현탁액용 분말입니다. LOKELMA의 활성 성분은 potassium 결합제인 sodium zirconium cyclosilicate입니다. Sodium zirconium cyclosilicate는 potassium을 수소 및 나트륨과 선택적으로 교환하는 비흡수성 지르코늄 실리케이트입니다. LOKELMA는 무취의 불용성 백색 내지 회색 경구 현탁액용 분말입니다. 평균 입자 크기는 20 µm이며 직경이 3 µm 미만인 입자는 3% 이하입니다. Sodium zirconium cyclosilicate 5 g당 나트륨 함량은 400 mg입니다.
Sodium zirconium cyclosilicate의 화학식은 Na~1.5H~0.5ZrSi3O9•2–3H2O입니다.
그림 1: Sodium Zirconium Cyclosilicate 결정 구조
12 임상 약리학
12.1 작용 기전
LOKELMA(나트륨 지르코늄 사이클로실리케이트)는 수소와 나트륨을 교환하여 칼륨을 선택적으로 포착하는 비흡수성 지르코늄 실리케이트입니다. 시험관 내 실험에서 LOKELMA는 칼슘이나 마그네슘과 같은 다른 양이온이 존재해도 칼륨 이온에 높은 친화력을 갖습니다. LOKELMA는 위장관 내강에서 칼륨을 결합하여 분변으로 칼륨 배설을 증가시킵니다. 칼륨 결합으로 인해 위장관 내강의 유리 칼륨 농도가 낮아져 혈중 칼륨 수치가 감소합니다.
12.2 약력학
건강한 성인 대상자에서 LOKELMA를 1회 5g 또는 10g을 4일간 투여했을 때 용량 의존적으로 분변 내 칼륨 배설이 증가했습니다. 그에 상응하여 요 중 칼륨 배설과 혈중 칼륨 수치는 용량 의존적으로 감소하였습니다.
고칼륨혈증 환자에게 LOKELMA 10g을 하루 세 번 최대 48시간 동안 투여했을 때, 투여 개시 1시간 후부터 혈중 칼륨 수치가 감소하기 시작했으며 48시간 치료 기간 동안 계속해서 감소했습니다[임상연구 결과 (14.2) 참조]. LOKELMA를 중단하면 칼륨 수치가 다시 증가합니다. 치료 시작 시 혈중 칼륨 수치가 높거나 고용량으로 투여할수록 혈중 칼륨 수치 감소 폭이 더 큽니다.
LOKELMA는 용량 의존적으로 혈중 중탄산염 농도를 소량 상승시킵니다(1회 용량 5g에서 1.1 mmol/L, 10g에서 2.3 mmol/L, 15g에서 2.6 mmol/L 증가했으나 위약군에서는 평균 0.6 mmol/L 증가). 이 소견의 임상적 의의는 불분명합니다.
12.3 약동학
LOKELMA는 효소 대사에 영향을 받지 않는 불용성 무기물입니다. 고칼륨혈증 환자를 대상으로 한 임상시험에서 소변과 혈액 내 지르코늄 농도를 측정했을 때, 치료군과 대조군에서 지르코늄 농도가 비슷하였거나(검출되지 않거나 분석법의 정량 한계 수준이었습니다). 랫트를 대상으로 한 생체 내 물질 분포 시험에서 LOKELMA는 분변으로 배설되었으며 전신 흡수되지 않았습니다.
약물 상호작용
36종의 의약품을 시험관 내에서 LOKELMA와의 잠재적 상호작용을 확인하였습니다. 16종의 의약품에서는 LOKELMA와 시험관 내 상호작용이 없었습니다(알로푸리놀, 아픽사반, 아스피린, 캡토프릴, 사이클로스포린, 디곡신, 에티닐 에스트라디올, 리시노프릴, 마그네슘, 메트포르민, 페니토인, 프레드니손, 프로프라놀롤, 퀴나프릴, 스피로노락톤, 티카그렐로르).
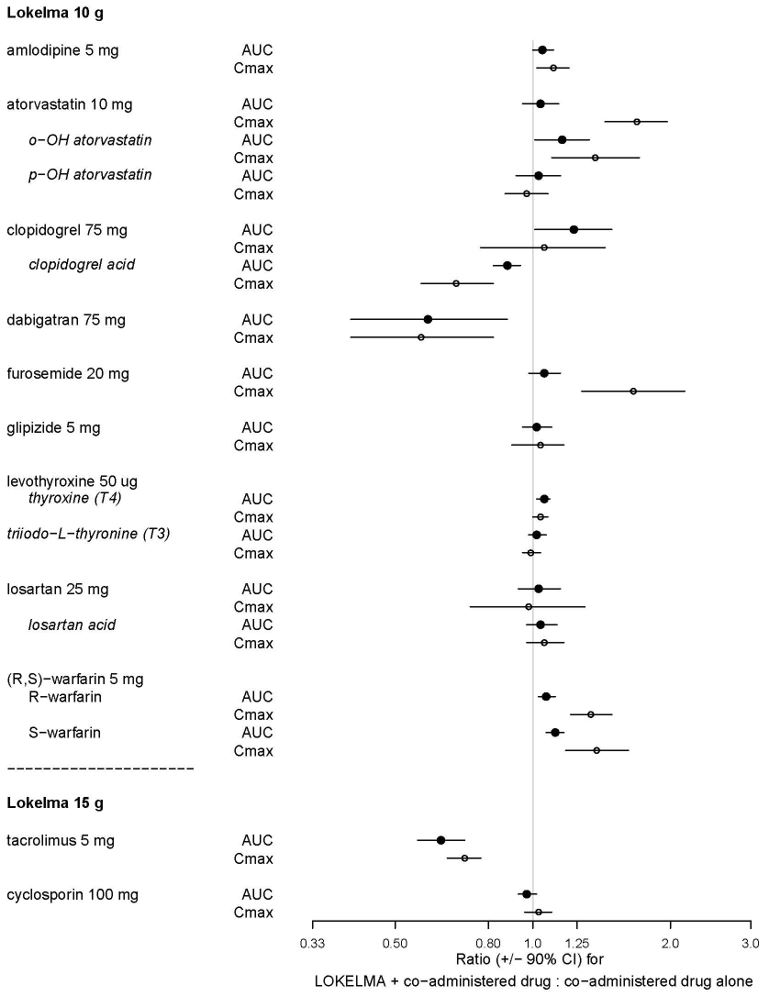
나머지 20종에서 시험관 내 상호작용이 있었으며, 그 중 9종에 대해 건강한 자원자를 대상으로 LOKELMA 10g과 함께 생체 내 시험을 실시했습니다. 로사르탄, 글리피자이드, 레보티록신은 LOKELMA와 병용 시 전신 노출량에 변화가 없었습니다. 그러나 푸로세미드와 아토르바스타틴 같은 약한 산성 약물은 전신 노출량이 증가했고, 다비가트란 같은 약한 염기성 약물은 전신 노출량이 감소했습니다(그림 2 참조). 이러한 변화는 LOKELMA가 위 pH를 높여 pH 의존성 용해도를 가진 병용 약물의 전신 노출량에 영향을 미치는 것과 일치합니다. [약물상호작용 (7) 참조]
건강한 자원자를 대상으로 한 다른 약물상호작용 시험에서 LOKELMA 15g과 타크로리무스를 병용하면 타크로리무스의 전신 노출량이 감소했으며(그림 2), 이는 LOKELMA가 위 pH를 높이기 때문으로 여겨집니다. 동일한 시험에서 LOKELMA와 사이클로스포린을 병용했을 때에는 임상적으로 유의미한 상호작용이 없었습니다.
그림 2: LOKELMA 10g 또는 15g가 경구 투여 약물의 약동학 프로파일에 미치는 영향
13 비임상 독성
13.1 발암성, 변이원성, 생식능력 손상
나트륨 지르코늄 사이클로실리케이트의 변이원성 잠재력에 대한 다음 시험 결과는 음성이었다: (1) 에임스(Ames) 시험(S. typhimurium 및 E. coli); (2) 중국 햄스터 배아(CHO) 세포에서의 염색체 이상 분석; (3) in vivo 랫드 소핵 시험. 지르코늄 사이클로실리케이트가 유전독성이 없고, 위장관에서 흡수되지 않으며, 개에서 만성 독성 연구에서 국소 위장관 변화를 일으키지 않았기 때문에 나트륨 지르코늄 사이클로실리케이트의 종양 생성 잠재력을 평가하기 위한 동물 발암성 연구는 필요하지 않은 것으로 간주되었다.
수컷과 암컷 랫드에서의 생식능력은 최대 가능 용량인 58g/일(인체 등가 용량)까지 부작용이 없었다.
14 임상 연구
14.1 연구 1
LOKELMA의 혈중 칼륨 저하 효과는 고칼륨혈증 환자(5-6.5 mEq/L, 평균 칼륨 5.3 mEq/L)를 대상으로 한 이중맹검, 무작위배정, 위약대조 임상시험(NCT01737697) 연구 1의 두 부분에서 입증되었습니다.
이 임상시험의 첫 번째 단계(급성 단계)에서 753명의 환자가 LOKELMA의 4가지 용량(1.25, 2.5, 5 또는 10g) 중 하나 또는 위약을 하루 세 번 식사와 함께 48시간 동안 투여받도록 무작위배정되었습니다.
환자들의 평균 연령은 66세였고, 59%는 남성, 86%는 백인이었습니다. 약 60%의 환자가 만성 신장 질환이 있었고, 10%는 심부전, 62%는 당뇨병, 67%는 기저 시점에서 레닌-안지오텐신-알도스테론계(RAAS) 억제제를 투여받고 있었습니다.
급성 단계의 일차 평가 변수는 위약대조군과 LOKELMA군의 첫 48시간 동안 혈중 칼륨 수치의 지수함수적 변화율의 차이였습니다. 연구에서는 2.5, 5 및 10g(하루 3회) 군에서 위약군에 비해 혈중 칼륨 수치의 감소가 컸음을 보여 일차 평가 변수를 달성하였습니다(p<0.001). 표 1에 제시된 바와 같이 기저치 대비 칼륨 변화에 대한 이차 평가 변수에서, LOKELMA는 2.5, 5 및 10g에서 용량 의존적으로 혈중 칼륨 수치를 감소시켰습니다. 하루 세 번 10g를 투여받은 환자에서는 48시간에 평균 혈중 칼륨 수치가 -0.7 mEq/L 감소했습니다. 기저 칼륨 수치가 높을수록 LOKELMA에 대한 반응이 더 컸습니다. LOKELMA는 만성 신장 질환, 심부전, 당뇨병 및 RAAS 억제제 투여 환자에서 칼륨 수치 저하 효과를 보였습니다.
| 평균 혈중 칼륨 변화 mEq/L (95% 신뢰구간) 표본 크기 |
위약 | 1.25g 하루 3회 | 2.5g 하루 3회 | 5g 하루 3회 | 10g 하루 3회 |
|---|---|---|---|---|---|
|
전체 환자 |
-0.2 |
-0.3 |
-0.5 |
-0.5 |
-0.7 |
|
기저 혈중 칼륨 |
-0.4 |
-0.3 |
-0.6 |
-0.9 |
-1.1 |
급성 단계에서 LOKELMA 투여 후 혈중 칼륨 수치가 3.5-5 mEq/L 범위에 도달한 환자는 12일 동안 아침 식사와 함께 위약 또는 LOKELMA 1.25, 2.5, 5 또는 10g 중 하나를 하루 한 번 투여받도록 무작위배정되었습니다.
유지기 단계의 일차 평가 변수는 LOKELMA군과 위약군의 12일 투여 기간 동안 혈중 칼륨 수치의 지수함수적 변화율 차이였습니다. 연구에서는 각각의 위약군과 비교하여 5 및 10g 용량군에서 일차 평가 변수를 달성하였습니다(p<0.01 및 p<0.001).
14.2 연구 2
LOKELMA의 효능은 공개형 급성기 단계와 한 달간의 무작위배정, 이중맹검, 위약대조 철회 단계로 구성된 두 부분 임상시험(연구 2; NCT02088073)에서도 입증되었습니다.
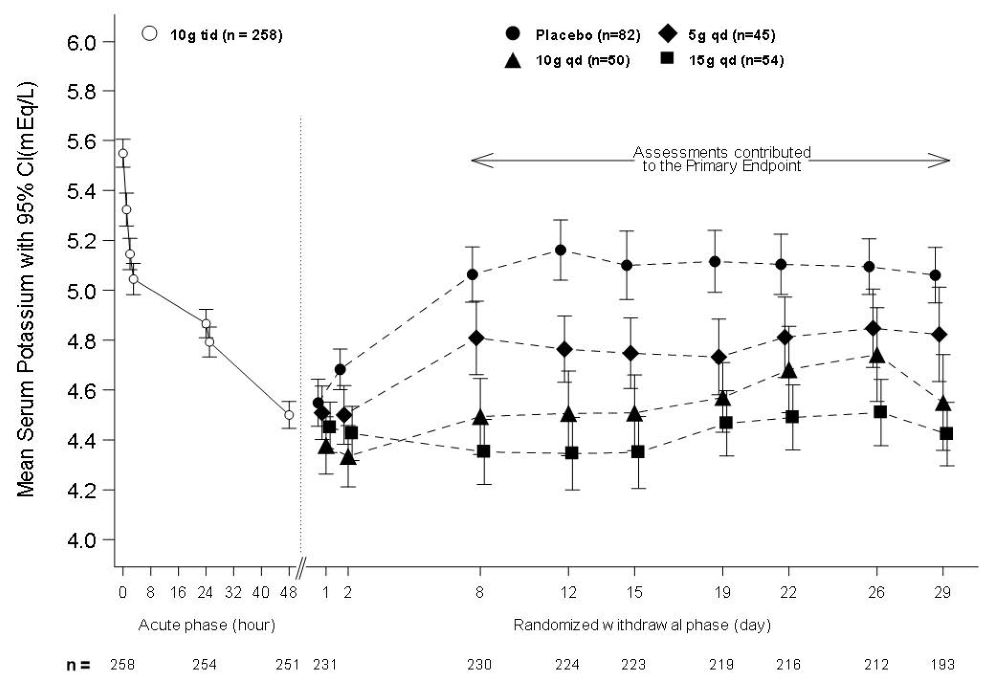
연구 2의 공개 급성기 단계에서 고칼륨혈증 환자(기저치 평균 5.6 mEq/L, 범위 5.1-7.4 mEq/L) 258명이 48시간 동안 하루 세 번 식사와 함께 LOKELMA 10g을 투여받았습니다. 그림 3 왼쪽에 나타난 것처럼, LOKELMA 투여로 인해 급성기 단계에서 평균 혈중 칼륨 수치가 5.6 mEq/L에서 4.5 mEq/L로 감소하였습니다.
연구의 급성기 단계 후에는 이중맹검 무작위배정 철회 단계가 진행되었으며, 혈중 칼륨 수치가 3.5-5 mEq/L 범위에 도달한 환자는 28일 동안 아침 식사 전에 LOKELMA 한 번 용량(5, 10 또는 15g) 중 하나 또는 위약을 투여받도록 무작위배정되었습니다. 급성기 단계에 등록된 환자의 92%가 이 범위의 칼륨 수치에 도달했고 두 번째 단계에 등록되었습니다.
무작위배정 철회 단계의 일차 평가 변수는 8일차에서 29일차까지 LOKELMA군과 위약군의 평균 혈중 칼륨 수치 비교였습니다. 하루 한 번 LOKELMA 세 용량(5, 10 및 15g) 모두 위약군보다 평균 칼륨 수치가 낮게 유지되었습니다(평균 혈중 칼륨 수치는 각각 5, 10 및 15g 용량군에서 4.8, 4.5 및 4.4 mEq/L였으며, 위약군에서는 5.1 mEq/L였고, 모든 용량군에서 p≤0.001, 그림 3 오른쪽). LOKELMA 투여군에서 정상 범위(3.5-5 mEq/L)의 평균 혈중 칼륨 수치를 나타낸 환자 비율이 위약군보다 높았습니다(5, 10 및 15g 용량에서 각각 80%, 90% 및 94%, 위약군 46%).
그림 3: 연구 2 – 급성기 및 무작위배정 철회 단계에서의 평균 혈중 칼륨 수치
치료 의도 집단에는 8일 또는 그 이후에 최소 한 번의 유효한 혈청 칼륨 측정값이 있는 대상자가 포함됩니다.
14.3 11개월 연장 연구
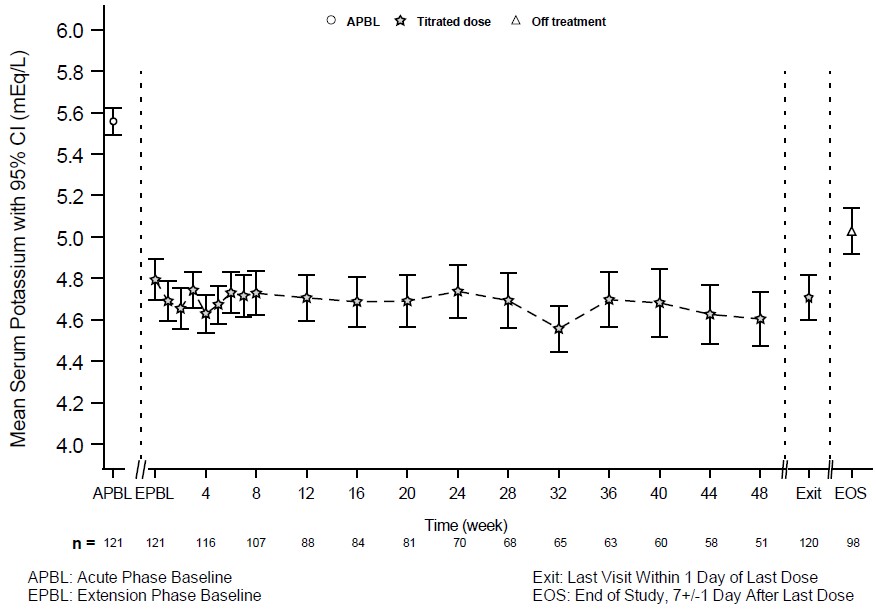
28일 무작위 철회기를 완료한 환자들은 최대 11개월까지 LOKELMA 치료를 계속할 수 있는 공개 연장기로 옵션을 선택할 수 있었습니다(n=123; NCT02107092). 그림 4는 계속된 치료 중에도 혈청 칼륨에 대한 치료 효과가 유지되었음을 보여줍니다.
그림 4: 연구 2의 11개월 공개 연장기 – 평균 혈청 칼륨(mEq/L)
14.4 연구 3
LOKELMA는 과칼륨혈증 환자 751명을 대상으로 한 12개월 공개 연구에서 평가되었습니다(NCT02163499). 이 연구의 기준선 평균 칼륨 수치는 5.6 mEq/L였습니다. LOKELMA 10 g을 하루 세 번 투여한 후 72시간 이내에 정상 칼륨 혈증(3.5-5.0 mEq/L)에 도달한 환자(n=746; 99%)는 유지기에 진입했습니다. 유지 치료를 위해 초기 LOKELMA 용량은 하루 5 g 한 번이었고, 혈청 칼륨 수치에 따라 최소 이틀에 한 번 5 g에서 최대 하루 15 g까지 조절되었습니다. 계속된 치료 중에도 혈청 칼륨에 대한 치료 효과가 유지되었습니다.
14.5 연구 4
LOKELMA의 혈청 칼륨 저하 효과는 지속적인 투석 전 과칼륨혈증(기준선 평균 칼륨 5.8 mEq/L)이 있는 만성 혈액투석 환자 196명(평균 연령 58세, 범위 20-86세)을 대상으로 한 이중 맹검, 위약 대조 시험에서 연구되었습니다(NCT03303521). 용량 조절기(초기 4주)에는 장기 투석 간격 후 투석 전 혈청 칼륨 측정값에 따라 4.0-5.0 mEq/L의 투석 전 혈청 칼륨 수준을 달성하기 위해 5 g 단위로 최대 하루 15 g까지 용량이 매주 조절되었습니다. 용량 조절기 종료 시 도달한 용량은 이후 4주간의 평가기 전체에 걸쳐 유지되었습니다.
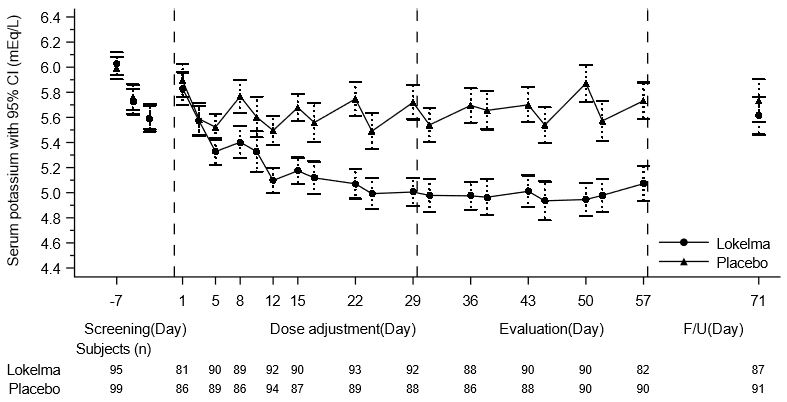
이 시험의 주요 평가변수는 반응자 비율로, 장기 투석 간격 후 4회의 투석치료 중 최소 3회에서 투석 전 혈청 칼륨 수치가 4.0-5.0 mEq/L 범위를 유지하고 평가기 중 구제 요법을 받지 않은 환자의 비율을 의미합니다. LOKELMA 군에서 위약군에 비해 더 많은 비율의 환자가 반응자였습니다(각각 41% vs 1%; p<0.001). 투석 전 평균 혈청 칼륨 수준에 대한 치료 효과도 계속된 치료 중에 유지되었습니다. 연구 기간 중 투석 전 평균 혈청 칼륨 수준은 그림 5에 제시되어 있습니다.
그림 5: 만성 혈액투석 환자의 시간에 따른 투석 전 평균 혈청 칼륨 수준
F/U – 추적 관찰기
표시된 오차 막대는 95% 신뢰구간에 해당합니다.
n = 특정 방문 시점에서 결측치가 없는 칼륨 측정치를 가진 환자 수입니다.
16 제공/보관 및 취급 방법
LOKELMA (sodium zirconium cyclosilicate) 경구 현탁액은 다음과 같이 호일 라인 포장지에 백색에서 회백색 가루 형태로 공급됩니다:
|
LOKELMA (그램) |
단일 포장지 |
11개 포장지 상자 |
30개 포장지 상자 |
|
5 |
NDC 0310-1105-01 |
NDC 0310-1105-39 |
NDC 0310-1105-30 |
|
10 |
NDC 0310-1110-01 |
NDC 0310-1110-39 |
NDC 0310-1110-30 |
보관 및 취급
LOKELMA를 15°C-30°C (59°F-86°F)에 보관하십시오.
17 환자 상담 정보
투여량
환자에게 LOKELMA를 조제하는 방법을 지시하십시오. 전체 투여량을 마셔야 한다고 알려주십시오 [투여량 및 투여방법(2.3) 참조].
급성 질환(예: 경구 섭취 감소, 설사)이 있는 투석 환자에게는 의료진에게 연락하도록 지시하십시오. Lokelma의 투여량을 조정해야 할 수 있습니다 [경고 및 주의사항(5.3) 참조].
진단 검사
복부 X-레이 검사 전에 의사에게 알리도록 환자에게 권고하십시오 [경고 및 주의사항(5.4) 참조].
약물 상호작용
다른 경구 약물을 복용하는 환자에게는 LOKELMA 투여 시 최소 2시간 전후로 다른 약물과 시간을 띄우도록 권고하십시오 [약물 상호작용(7) 참조].
식단
필요한 경우, 식단에서 나트륨 섭취량을 조절하도록 환자에게 권고하십시오 [경고 및 주의사항(5.2) 참조].
U.S. 특허 번호: 6332985, 8808750, 8877255, 8802152, 9592253
© AstraZeneca 2024
제조업체: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850
패키지/라벨 주요 디스플레이 패널 – 5g
NDC 0310-1105-30 30개 패킷 포함
LOKELMA®
(sodium zirconium cyclosilicate)
경구 현탁액용
패킷 당 5g
Rx Only
AstraZeneca
패키지/라벨 주요 디스플레이 패널 – 10g
NDC 0310-1110-30 30개 패킷 포함
LOKELMA®
(나트륨 지르코늄 cyclicsilicate)
경구 현탁액
1 패킷 당 10g
Rx Only
AstraZeneca