의약품 제조업체: E.R. Squibb & Sons, L.L.C. (Updated: 2023-02-08)
처방 정보 강조사항
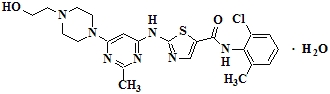
SPRYCEL (다사티닙) 정제, 경구용
미국 최초 승인: 2006년
최근 주요 변경 사항
경고 및 주의사항 (5.11) 2/2023
지시 및 사용법
SPRYCEL은 다음의 치료를 위해 키나아제 억제제로 표시됩니다.
- •
- 만성 기간의 필라델피아 염색체 양성(Ph+) 만성 골수성 백혈병(CML)을 처음 진단받은 성인. (1, 14)
- •
- 이마티닙을 비롯한 이전 치료에 내성 또는 불내성을 가진 성인의 가속기, 골수성 또는 림프성 폭발기 CML. (1, 14)
- •
- 이전 치료에 내성 또는 불내성을 가진 필라델피아 염색체 양성 급성 림프구성 백혈병(Ph+ ALL)의 성인. (1, 14)
- •
- 만성 기간의 필라델피아 염색체 양성(Ph+) CML을 가진 1세 이상 소아 환자. (1, 14)
- •
- 화학요법과 연관하여 처음 진단받은 1세 이상 소아 환자의 필라델피아 염색체 양성(Ph+) ALL. (1, 14)
용량 및 투여 방법
제형 및 강도
정제: 20mg, 50mg, 70mg, 80mg, 100mg 및 140mg. (3)
금기 사항
없음. (4)
경고 및 주의사항
- •
- 골수억제 및 출혈 사건: 심한 혈소판 감소, 중성구 감소 및 빈혈이 발생할 수 있습니다. 혈소판 기능을 억제하는 약물 또는 항응고제와 동시에 사용할 경우 주의하십시오. 정기적으로 완전한 혈액 검사를 모니터링하십시오. 필요한 경우 혈액 수혈 및 SPRYCEL 투여 중단. (2.5, 5.1, 5.2)
- •
- 체액 저장: 가끔 심한 체액 저장, 폐흉수 포함. 지지적 치료 조치 및/또는 용량 조정으로 관리하십시오. (2.5, 5.3)
- •
- 심혈관 독성: 환자의 심혈관 증상 또는 증상을 모니터링하고 적절하게 치료하십시오. (5.4)
- •
- 폐동맥 고혈압 (PAH): SPRYCEL은 PAH 발생 위험을 증가시킬 수 있으며, 중단 시 회복될 수 있습니다. 치료 중 기저 위험을 고려하고 환자를 PAH의 증상 및 징후로 평가하십시오. PAH가 확인되면 SPRYCEL 중단. (5.5)
- •
- QT 간격 연장: QT 간격 연장이 있는 환자에서 SPRYCEL을 주의하여 사용하십시오. (5.6)
- •
- 심한 피부 반응: 심각한 점막 피부 반응 사례가 보고되었습니다. (5.7)
- •
- 종양 용해 증후군: 종양 용해 증후군이 보고되었습니다. SPRYCEL 투여 전에 적절한 수분 보충 및 요산 수치 교정 유지. (5.8)
- •
- 배아-태아 독성: 태아에 유해할 수 있습니다. 생식 가능한 환자에게 태아에 대한 잠재적 위험과 효과적인 피임 사용을 알립니다. (5.9, 8.1, 8.3)
- •
- 소아 환자의 성장 및 발달에 미치는 영향: 발육 연장, 골다공증, 성장 지연 및 유방증이 보고되었습니다. 소아 환자의 골 성장과 발달을 모니터링하십시오. (5.10)
- •
- 간독성: 치료 시작 전에 간 기능을 평가하고 이후에는 임상적으로 표시되는 경우 매월 간 기능을 모니터링하십시오. 간 기능이 저하되는 것으로 알려진 화학요법과 병용할 때 간 기능을 모니터링하십시오. (5.11)
부작용
단일 요법으로 SPRYCEL을 투여받은 환자에서 가장 흔한 부작용(≥15%)은 골수억제, 체액 저장 사건, 설사, 두통, 피부 발진, 출혈, 호흡곤란, 피로, 구토, 근골격 통증입니다. (6)
화학요법과 연관하여 SPRYCEL을 병용한 소아 환자에서 가장 흔한 부작용(≥30%)은 구내염, 열성 중성구감소증, 발열, 설사, 구토, 근골격 통증, 복통, 기침, 두통, 발진, 피로, 변비, 부정맥, 고혈압, 부종, 감염(세균성, 바이러스성 및 곰팡이성), 저혈압, 식욕 감소, 과민성 반응, 호흡곤란, 코피, 말초 신경병증 및 의식 상태 변화입니다. (6)
의심되는 부작용을 보고하려면, Bristol-Myers Squibb(브리스톨-마이어스 스퀴브)에 전화 1-800-721-5072 또는 FDA에 전화 1-800-FDA-1088 또는 www.fda.gov/medwatch로 문의하십시오.
약물 상호작용
환자 상담 정보 및 FDA 승인 환자 라벨링은 17을 참조하십시오.
개정일: 2/2023
목차
전체 처방 정보 목차*
1 적응증 및 사용법
2 용법 및 용량
2.1 성인 환자의 SPRYCEL 용량
2.2 CML 또는 Ph+ ALL 소아 환자의 SPRYCEL 용량
2.3 용량 조절
2.4 CML 및 Ph+ ALL 성인 환자, CML 소아 환자의 용량 증량
2.5 이상반응에 대한 용량 조절
2.6 치료 기간
3 제형 및 함량
4 금기사항
5 경고 및 주의사항
5.1 골수억제
5.2 출혈 관련 이상반응
5.3 체액저류
5.4 심혈관계 독성
5.5 폐동맥고혈압
5.6 QT 간격 연장
5.7 중증 피부 반응
5.8 종양용해증후군
5.9 태아 독성
5.10 소아 환자의 성장 및 발달에 미치는 영향
5.11 간독성
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 Dasatinib에 대한 다른 약물의 영향
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.3 가임여성 및 가임남성
8.4 소아에 대한 사용
8.5 노인에 대한 사용
10 과량 투여
11 약물 설명
12 임상약리
12.1 작용기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이유발성, 생식능력 장애
14 임상시험
14.1 성인에서 새로 진단된 만성기 CML
14.2 Imatinib 저항성 또는 불내성 성인 CML 또는 Ph+ ALL
14.3 소아 환자의 CML
14.4 소아 환자의 Ph+ ALL
15 참고문헌
16 공급/보관 및 취급방법
17 환자상담정보
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위섹션은 목록에 포함되지 않았습니다.
1 적응증 및 사용법
SPRYCEL (dasatinib)은 다음과 같은 성인 환자의 치료에 적응증이 있습니다.
- •
- 새로 진단된 Philadelphia 염색체 양성(Ph+) 만성기 만성 골수성 백혈병(CML)
- •
- imatinib을 포함한 이전 치료에 내성 또는 불내성을 보이는 만성기, 가속기 또는 골수성이나 림프구성 발작기 Ph+ CML
- •
- 이전 치료에 내성 또는 불내성을 보이는 Philadelphia 염색체 양성 급성 림프구성 백혈병(Ph+ ALL)
SPRYCEL (dasatinib)은 다음과 같은 1세 이상 소아 환자의 치료에 적응증이 있습니다.
- •
- 만성기 Ph+ CML
- •
- 화학요법과 병용하여 새로 진단된 Ph+ ALL
2 용량 및 투여
2.1 스프라이셀의 성인환자 투여량
만성기 CML 환자에서 스프라이셀의 권장 초기 투여량은 1일 1회 100mg을 경구 투여합니다. 가속기 CML, 골수모구 또는 림프모구 급성기 CML 또는 Ph+ ALL 환자에서 스프라이셀의 권장 초기 투여량은 1일 1회 140mg을 경구 투여합니다. 정제는 부수거나, 자르거나, 씹어서는 안 되며 통째로 삼켜야 합니다. 스프라이셀은 식사와 관계없이 아침 또는 저녁에 복용할 수 있습니다.
2.2 CML 또는 Ph+ ALL 소아환자에서의 스프라이셀 투여량
소아환자의 권장 초기 투여량은 표 1에 나온 체중에 따라 결정됩니다. 권장 용량은 식사 여부와 관계없이 1일 1회 경구 투여합니다. 체중 변화에 따라 3개월마다 용량을 다시 계산하거나 필요 시 더 자주 계산합니다.
정제를 부수거나 자르거나 씹어서는 안 됩니다. 통째로 삼켜야 합니다. 정제 통째로 삼키기 어려운 소아환자를 위해 추가 투여 고려사항이 있습니다 [특정 환자군에 대한 사용(8.4) 및 임상약리학(12.3) 참고].
| 체중(kg)b | 일일 투여량(mg) |
|---|---|
| a Ph+ ALL 소아환자의 경우, 진단 확인 시 또는 유도 화학요법 15일 이내에 스프라이셀 치료를 시작하여 2년간 지속합니다. b 체중이 10kg 미만인 환자에게는 정제 투여를 권장하지 않습니다. |
|
|
10 – 20kg 미만 |
40mg |
|
20 – 30kg 미만 |
60mg |
|
30 – 45kg 미만 |
70mg |
|
45kg 이상 |
100mg |
CML 및 Ph+ ALL 성인환자와 CML 소아환자의 용량 증량에 대한 권고사항은 2.4항을 참조하십시오.
2.3 용량 조절
강력한 CYP3A4 유도제
강력한 CYP3A4 유도제와 St. John’s wort 병용을 피하십시오. 환자가 반드시 강력한 CYP3A4 유도제를 병용해야 한다면 스프라이셀 용량 증량을 고려하십시오. 스프라이셀 용량을 증량한 경우 환자의 독성을 주의 깊게 모니터링하십시오 [약물상호작용(7.1) 참고].
강력한 CYP3A4 억제제
강력한 CYP3A4 억제제와 자몽주스 병용을 피하십시오. 가능한 효소 억제 가능성이 없거나 최소인 대체 병용 약물을 선택하는 것이 좋습니다. 스프라이셀을 강력한 CYP3A4 억제제와 병용해야 한다면 다음과 같이 용량 감소를 고려합니다:
• 스프라이셀 140mg/일을 복용 중인 경우 40mg/일로 감량
• 스프라이셀 100mg/일을 복용 중인 경우 20mg/일로 감량
• 스프라이셀 70mg/일을 복용 중인 경우 20mg/일로 감량
스프라이셀 60mg 또는 40mg/일을 복용 중인 경우 억제제 중단 시까지 스프라이셀 투여를 중단합니다.
억제제 중단 후 약 1주일의 washout 기간을 거친 후 스프라이셀 투여를 재개합니다.
이렇게 감량된 스프라이셀 용량으로 CYP3A4 억제제 없이 관찰된 체내 노출 범위로 AUC를 조절할 수 있을 것으로 예상되지만, 강력한 CYP3A4 억제제 병용 시 이 용량 조절에 대한 임상 데이터는 없습니다. 용량 감량 후에도 스프라이셀 내약성이 없다면 강력한 CYP3A4 억제제를 중단하거나 억제제 중단 시까지 스프라이셀 투여를 중단합니다. 억제제 중단 후 약 1주일의 washout 기간을 거친 후 스프라이셀 용량을 증량합니다 [약물상호작용(7.1) 참고].
2.4 CML 및 Ph+ ALL 성인환자와 CML 소아환자의 용량 증량
CML 및 Ph+ ALL 성인환자의 경우, 권장 초기 용량에서 혈액학적 또는 세포유전학적 반응을 보이지 않을 때 1일 1회 140mg(만성기 CML) 또는 180mg(진행기 CML 및 Ph+ ALL)로 용량 증량을 고려합니다. CML 소아환자의 경우, 120mg 1일 1회(표 2 참고)까지 용량 증량을 고려합니다. Ph+ ALL 소아환자에서는 화학요법과 병용하여 스프라이셀을 투여하므로 용량 증량은 권장되지 않습니다.
만성기 CML 소아환자 중 권장 초기 용량에서 혈액학적 또는 세포유전학적 반응을 보이지 않은 경우, 표 2에 따라 스프라이셀 용량을 증량합니다.
|
제형 |
투여량(1일 최대 용량) |
|
|
초기 용량 |
증량 |
|
|
정제 |
40mg |
50mg |
|
60mg |
70mg |
|
|
70mg |
90mg |
|
|
100mg |
120mg |
|
2.5 이상반응에 대한 용량 조절
2.5.1 골수억제
임상 시험에서 골수억제는 투여 중단, 용량 감소 또는 연구 치료 중단으로 관리되었습니다. 저항성 골수억제 환자에게 조혈 성장인자가 사용되었습니다. 성인 및 소아 환자의 용량 조절 지침은 표 3과 4에 각각 요약되어 있습니다.
| * ANC: 절대 호중구 수 | ||
|
만성기 CML (초기 용량 100 mg 1일 1회) |
ANC* <0.5 × 109/L |
|
|
가속기 CML, 급성기 CML 및 Ph+ ALL (초기 용량 140 mg 1일 1회) |
ANC* <0.5 × 109/L |
|
| *ANC: 절대 호중구 수 ** 낮은 용량의 정제가 없음 |
||||
|
||||
|
1. 골수억제가 3주 이상 지속되면 골수 흡인 또는 생검으로 백혈병과 관련이 있는지 확인합니다. 2. 골수 억제가 백혈병과 관련이 없으면, ANC* ≥1.0 × 109/L 및 혈소판 ≥75 × 109/L이 될 때까지 SPRYCEL 투여를 중지한 후 원래 초기 용량 또는 감량된 용량으로 재개합니다. 3. 골수억제가 재발하면 골수 흡인/생검을 반복하고 감량된 용량으로 SPRYCEL 투여를 재개합니다. |
|
|
|
|
|
정제 |
|
|
|
|
|
|
|
||
|
|
|
||
|
|
|
||
만성기 CML 소아 환자에서 완전 혈액학적 반응(CHR) 중 3등급 이상의 호중구감소증 또는 혈소판감소증이 재발하면 SPRYCEL 투여를 중단하고 감량된 용량으로 재개합니다. 중등도 골수억제 및 질병 반응에 따라 일시적 용량 감량을 실시합니다.
Ph+ ALL 소아 환자의 경우, 호중구감소증 및/또는 혈소판감소증으로 다음 치료 주기가 14일 이상 지연되면 SPRYCEL 투여를 중단하고 다음 치료 주기가 시작되면 동일 용량 수준으로 재개합니다. 호중구감소증 및/또는 혈소판감소증이 지속되어 추가로 7일 이상 지연되는 경우 골수 세포 밀도와 모세포 분율을 평가하기 위해 골수 검사를 실시합니다. 골수 세포 밀도가 <10%인 경우 ANC >500/μL(0.5 x 109/L)이 될 때까지 SPRYCEL 투여를 중단한 뒤 전체 용량으로 재개할 수 있습니다. 골수 세포 밀도가 >10%인 경우 SPRYCEL 투여 재개를 고려할 수 있습니다.
2.5.2 비혈액학적 이상반응
Ph+ CML 및 ALL 환자에서 SPRYCEL로 인한 중증 비혈액학적 이상반응이 발생하면 해당 이상반응이 해결되거나 개선될 때까지 투여를 중지해야 합니다. 그 후 중증도와 재발 여부에 따라 감량된 용량으로 투여를 재개할 수 있습니다 [경고 및 주의사항 (5)을 참조하십시오].
Ph+ ALL 환아의 경우, 3등급 이상의 비혈액학적 부작용이 발생하면 간기능 이상을 제외하고 치료를 중단한 후 1등급 이하로 회복되면 감량된 용량으로 재개합니다. 정상 상한치의 5배 이상으로 직접 빌리루빈이 상승하면 기저 수준으로 회복되거나 1등급 이하가 될 때까지 치료를 중단합니다. AST/ALT가 정상 상한치의 15배 이상 상승하면 기저 수준으로 회복되거나 1등급 미만이 될 때까지 치료를 중단합니다. 상기와 같은 간기능 이상이 재발하면 재개 시 용량을 감량합니다. 용량 감량 권고사항은 표 5에 설명되어 있습니다.
| ** 낮은 정제 용량 없음 | ||||
|
용량 (1일 최대 용량) |
||||
|
1. 2등급의 비혈액학적 독성이 발생하면 대증 요법에도 불구하고 회복되지 않을 경우 스프라이셀 중단을 고려하고, 1등급 이하로 회복되면 초기 시작 용량으로 재개합니다. 재발 시 감량된 용량으로 스프라이셀을 재개합니다. 2. 3등급의 비혈액학적 독성이 발생하면 1등급 이하로 회복될 때까지 스프라이셀을 중단한 다음 감량된 용량으로 재개합니다. 3. 직접 빌리루빈이 정상 상한치의 5배 이상이거나 AST/ALT가 15배 이상이면 1등급 이하로 회복될 때까지 스프라이셀을 중단한 다음 초기 시작 용량으로 스프라이셀을 재개합니다. 재발성 간독성이 있으면 감량된 용량으로 스프라이셀을 재개합니다. |
초기 시작 용량 |
1단계 용량 감량 |
2단계 용량 감량 |
|
|
정제 |
40mg |
20mg |
** |
|
|
60mg |
40mg |
20mg |
||
|
70mg |
60mg |
50mg |
||
|
100mg |
80mg |
70mg |
||