의약품 제조업체: Novartis Pharmaceuticals Corporation (Updated: 2024-07-11)
처방 정보의 주요 내용
MEKINIST® (트라메티닙) 정제, 경구용
MEKINIST® (트라메티닙) 경구용 현탁액
미국 최초 승인: 2013
최근 주요 변경 사항
| 적응증 및 용법, BRAF V600E 돌연변이 양성 절제 불가능 또는 전이성 고형 종양 (1.5) | 2023년 8월 |
처방 정보 주요 내용
MEKINIST는 단일 요법으로 FDA 승인 검사로 확인된 BRAF V600E 또는 V600K 돌연변이가 있는 절제 불가능하거나 전이성 흑색종 환자의 BRAF 억제제 치료를 받지 않은 환자의 치료에 사용됩니다. (1.1, 2.1)
MEKINIST는 다브라페닙과 병용하여 다음과 같은 경우에 사용됩니다.
- FDA 승인 검사로 확인된 BRAF V600E 또는 V600K 돌연변이가 있는 절제 불가능하거나 전이성 흑색종 환자의 치료. (1.1, 2.1)
- FDA 승인 검사로 확인된 BRAF V600E 또는 V600K 돌연변이가 있고 완전 절제 후 림프절에 침범된 흑색종 환자의 보조 치료. (1.2, 2.1)
- FDA 승인 검사로 확인된 BRAF V600E 돌연변이가 있는 전이성 비소세포폐암(NSCLC) 환자의 치료. (1.3, 2.1)
- FDA 승인 검사로 확인된 BRAF V600E 돌연변이가 있고 만족스러운 국소 치료 옵션이 없는 국소 진행성 또는 전이성 갑상선암(ATC) 환자의 치료. (1.4, 2.1)
- 이전 치료 후 진행되었고 만족스러운 대체 치료 옵션이 없는 BRAF V600E 돌연변이가 있는 절제 불가능하거나 전이성 고형 종양이 있는 1세 이상의 성인 및 소아 환자의 치료. 이 적응증은 전체 반응률과 반응 지속 기간을 기반으로 한 가속 승인에 따라 승인되었습니다. 이 적응증에 대한 지속적인 승인은 확인 시험에서 임상적 이점의 검증 및 설명에 따라 달라질 수 있습니다. (1.5, 2.1)
- 전신 치료가 필요한 BRAF V600E 돌연변이가 있는 저등급 교모세포종(LGG)이 있는 1세 이상의 소아 환자의 치료. (1.6, 2.1)
사용 제한: MEKINIST는 BRAF 억제에 대한 알려진 내재성 저항성으로 인해 대장암 환자의 치료에 사용되지 않습니다. (1.7, 12.1)
투여량 및 투여 방법
- 성인 환자의 경우 MEKINIST 권장 용량은 1일 1회 경구로 2mg입니다. 소아 환자의 경우 MEKINIST 권장 용량은 체중에 따라 다릅니다. MEKINIST는 식사 1시간 전 또는 식사 2시간 후에 복용하십시오. (2)
금기 사항
없음. (4)
처방 정보 주요 사항
- 새로운 일차 악성 종양, 피부 및 비피부: MEKINIST를 다브라페닙과 함께 사용하면 발생할 수 있습니다. 치료 전 또는 치료 중 및 치료 중단 후에 새로운 악성 종양을 모니터링합니다. (5.1)
- 출혈: 주요 출혈 사건이 발생할 수 있습니다. 출혈의 징후와 증상을 모니터링합니다. (5.2)
- 대장염 및 위장 천공: MEKINIST를 투여받는 환자에서 대장염 및 위장 천공이 발생할 수 있습니다. (5.3)
- 정맥혈전색전증: MEKINIST를 투여받는 환자에서 심부 정맥 혈전증(DVT) 및 폐색전증(PE)이 발생할 수 있습니다. (5.4, 2.4)
- 심근병증: 치료 전, 치료 1개월 후, 그 후 2~3개월마다 좌심실 박출 분율(LVEF)을 평가합니다. (5.5, 2.4)
- 안구 독성: 시력 장애에 대한 안과 검사를 실시합니다. 망막 정맥 폐쇄(RVO)의 경우 MEKINIST를 영구적으로 중단합니다. (5.6, 2.4)
- 간질성 폐 질환(ILD)/폐렴: 새로운 또는 진행성 설명되지 않는 폐 증상의 경우 MEKINIST를 중단합니다. 치료 관련 ILD 또는 폐렴의 경우 MEKINIST를 영구적으로 중단합니다. (5.7, 2.4)
- 중증 발열 반응: MEKINIST를 다브라페닙과 함께 사용하면 발생할 수 있습니다. (5.8, 2.4)
- 중증 피부 독성: 피부 독성 및 이차 감염을 모니터링합니다. MEKINIST 중단에도 불구하고 3주 이내에 호전되지 않는 참을 수 없는 등급 2 또는 등급 3 또는 4 발진의 경우 MEKINIST를 영구적으로 중단합니다. 심각한 피부 부작용(SCAR)의 경우 영구적으로 중단합니다. (5.9, 2.4)
- 고혈당증: 기존 당뇨병 또는 고혈당증이 있는 환자의 혈청 포도당 수치를 모니터링합니다. (5.10)
- 식세포성 림프조직구증(HLH): HLH가 의심되는 경우 치료를 중단합니다. HLH가 확인되면 치료를 중단합니다. (5.12)
- 태아 독성: 태아에게 해를 끼칠 수 있습니다. 임신 가능성이 있는 여성에게 태아에 대한 잠재적 위험을 알리고 효과적인 피임을 사용하도록 조언합니다. (5.13, 8.1, 8.3)
부작용
단독 요법으로 MEKINIST를 사용한 경우 가장 흔한 부작용(≥ 20%)은 발진, 설사 및 림프부종입니다. (6.1)
다브라페닙과 병용하여 MEKINIST를 사용한 경우 가장 흔한 부작용(≥ 20%)은 다음과 같습니다.
- 절제 불가능하거나 전이성 흑색종: 발열, 메스꺼움, 발진, 오한, 설사, 구토, 고혈압 및 말초 부종. (6.1)
- 흑색종의 보조 치료: 발열, 피로, 메스꺼움, 두통, 발진, 오한, 설사, 구토, 관절통 및 근육통. (6.1)
- 비소세포폐암: 발열, 피로, 메스꺼움, 구토, 설사, 건조한 피부, 식욕 감소, 부종, 발진, 오한, 출혈, 기침 및 호흡 곤란. (6.1)
- 고형 종양이 있는 성인 환자: 발열, 피로, 메스꺼움, 발진, 오한, 두통, 출혈, 기침, 구토, 변비, 설사, 근육통, 관절통 및 부종. (6.1)
- 고형 종양이 있는 소아 환자: 발열, 발진, 구토, 피로, 건조한 피부, 기침, 설사, 여드름 모양 피부염, 두통, 복통, 메스꺼움, 출혈, 변비 및 손톱 주위염. (6.1)
- LGG가 있는 소아 환자: 발열, 발진, 두통, 구토, 근골격계 통증, 피로, 설사, 건조한 피부, 메스꺼움, 출혈, 복통 및 여드름 모양 피부염. (6.1)
의심되는 부작용을 보고하려면 Novartis Pharmaceuticals Corporation에 1-888-669-6682 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
특정 인구 집단에서의 사용
환자 상담 정보 및 FDA 승인 환자 라벨은 17을 참조하십시오.
개정: 2024년 7월
목차
전문 정보: 목차*
1
적응증 및 사용법
1.1
BRAF V600E 또는 V600K 돌연변이 양성 절제 불가능 또는 전이성 흑색종
1.2
BRAF V600E 또는 V600K 돌연변이 양성 흑색종의 보조 치료
1.3
BRAF V600E 돌연변이 양성 전이성 비소세포폐암
1.4
BRAF V600E 돌연변이 양성 국소 진행성 또는 전이성 갑상선암
1.5
BRAF V600E 돌연변이 양성 절제 불가능 또는 전이성 고형 종양
1.6
BRAF V600E 돌연변이 양성 저등급 교모세포종
1.7
사용 제한
2
투여량 및 투여 방법
2.1
환자 선택
2.2
권장 용량
2.3
투여
2.4
유해 반응에 대한 용량 조절
3
제형 및 강도
4
금기 사항
5
경고 및 주의 사항
5.1
새로운 일차 악성 종양
5.2
출혈
5.3
대장염 및 위장관 천공
5.4
정맥혈전색전증
5.5
심근병증
5.6
안과적 독성
5.7
간질성 폐 질환/폐렴
5.8
중증 발열 반응
5.9
중증 피부 독성
5.10
고혈당
5.11
병용 치료와 관련된 위험
5.12
식세포성 림프조직구증
5.13
태아-태아 독성
6
유해 반응
6.1
임상 시험 경험
6.2
시판 후 경험
7
약물 상호 작용
8
특정 인구 집단에서의 사용
8.1
임신
8.2
수유
8.3
생식 능력이 있는 여성 및 남성
8.4
소아 사용
8.5
노인 사용
8.6
간 기능 장애
10
과량 투여
11
설명
12
임상 약리
12.1
작용 기전
12.2
약력학
12.3
약동학
13
비임상 독성학
13.1
발암성, 돌연변이 유발성, 생식 능력 저해
14
임상 연구
14.1
BRAF V600E 또는 V600K 돌연변이 양성 절제 불가능 또는 전이성 흑색종
14.2
BRAF V600E 또는 V600K 돌연변이 양성 흑색종의 보조 치료
14.3
BRAF V600E 돌연변이 양성 전이성 비소세포폐암
14.4
BRAF V600E 돌연변이 양성 국소 진행성 또는 전이성 갑상선암
14.5
BRAF 억제제 치료 후 전이성 흑색종에서 임상적 활성 부족
14.6
BRAF V600E 돌연변이 양성 절제 불가능 또는 전이성 고형 종양
14.7
BRAF V600E 돌연변이 양성 저등급 교모세포종
16
포장 단위/보관 및 취급
17
환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
1.1
BRAF V600E 또는 V600K 돌연변이 양성 절제 불가능 또는 전이성 흑색종
MEKINIST®는 FDA 승인 검사를 통해 확인된 BRAF V600E 또는 V600K 돌연변이가 있는 절제 불가능 또는 전이성 흑색종 환자의 치료를 위해 BRAF 억제제 치료를 받지 않은 환자에서 단일 요법으로 또는 dabrafenib와 병용하여 사용하도록 승인되었습니다. [용량 및 투여(2.1) 참조].
1.2
BRAF V600E 또는 V600K 돌연변이 양성 흑색종의 보조 요법
MEKINIST는 FDA 승인 검사를 통해 확인된 BRAF V600E 또는 V600K 돌연변이가 있고 림프절이 침범된 흑색종 환자의 완전 절제 후 보조 요법으로 dabrafenib와 병용하여 사용하도록 승인되었습니다. [용량 및 투여(2.1) 참조].
1.3
BRAF V600E 돌연변이 양성 전이성 비소세포폐암
MEKINIST는 FDA 승인 검사를 통해 확인된 BRAF V600E 돌연변이가 있는 전이성 비소세포폐암(NSCLC) 환자의 치료를 위해 dabrafenib와 병용하여 사용하도록 승인되었습니다. [용량 및 투여(2.1) 참조].
1.4
BRAF V600E 돌연변이 양성 국소 진행성 또는 전이성 역형성 갑상선암
MEKINIST는 만족스러운 국소 치료 옵션이 없는 BRAF V600E 돌연변이가 있는 국소 진행성 또는 전이성 역형성 갑상선암(ATC) 환자의 치료를 위해 dabrafenib와 병용하여 사용하도록 승인되었습니다. [용량 및 투여(2.1) 참조].
1.5
BRAF V600E 돌연변이 양성 절제 불가능 또는 전이성 고형 종양
MEKINIST는 이전 치료 후 질병이 진행되었고 만족스러운 대체 치료 옵션이 없는 BRAF V600E 돌연변이가 있는 1세 이상의 소아 및 성인 환자의 절제 불가능 또는 전이성 고형 종양 치료를 위해 dabrafenib와 병용하여 사용하도록 승인되었습니다. [용량 및 투여(2.1) 참조]. 이 적응증은 전체 반응률 및 반응 지속 기간에 근거하여 신속 승인 절차에 따라 승인되었습니다. [임상 연구(14.6) 참조]. 이 적응증에 대한 지속적인 승인은 확증 임상시험에서 임상적 이점이 검증되고 설명되는지 여부에 따라 달라질 수 있습니다.
1.6
BRAF V600E 돌연변이 양성 저등급 신경교종
MEKINIST는 전신 요법이 필요한 BRAF V600E 돌연변이가 있는 1세 이상의 소아 환자의 저등급 신경교종(LGG) 치료를 위해 dabrafenib와 병용하여 사용하도록 승인되었습니다. [용량 및 투여(2.1) 참조].
1.7
사용 제한
MEKINIST는 알려진 BRAF 억제에 대한 내성으로 인해 대장암 환자의 치료에는 사용하도록 승인되지 않았습니다. [적응증 및 용법(1.5), 임상 약리학(12.1) 참조].
2 투여 및 관리
2.1
환자 선택
흑색종
- MEKINIST를 단독 요법 또는 다브라페닙과 병용 요법으로 치료를 시작하기 전에 종양 검체에서 BRAF V600E 또는 V600K 돌연변이가 있는지 확인하십시오 [임상 연구 (14.1, 14.2) 참조].
- 흑색종에서 BRAF V600 돌연변이 검출을 위한 FDA 승인 검사에 대한 정보는 다음 웹사이트에서 확인할 수 있습니다: http://www.fda.gov/CompanionDiagnostics.
비소세포폐암
- MEKINIST와 다브라페닙으로 치료를 시작하기 전에 종양 검체에서 BRAF V600E 돌연변이가 있는지 확인하십시오 [임상 연구 (14.3) 참조].
- 비소세포폐암에서 BRAF V600E 돌연변이 검출을 위한 FDA 승인 검사에 대한 정보는 다음 웹사이트에서 확인할 수 있습니다: http://www.fda.gov/CompanionDiagnostics.
갑상선암
- MEKINIST와 다브라페닙으로 치료를 시작하기 전에 종양 검체에서 BRAF V600E 돌연변이가 있는지 확인하십시오 [임상 연구 (14.4) 참조]. 현재 갑상선암에서 BRAF V600E 돌연변이 검출을 위한 FDA 승인 검사는 제공되지 않습니다.
고형 종양
- MEKINIST와 다브라페닙으로 치료를 시작하기 전에 종양 검체에서 BRAF V600E 돌연변이가 있는지 확인하십시오 [임상 연구 (14.6) 참조]. 현재 흑색종 및 비소세포폐암을 제외한 다른 고형 종양에서 BRAF V600E 돌연변이 검출을 위한 FDA 승인 검사는 제공되지 않습니다.
저등급 교모세포종
- MEKINIST와 다브라페닙으로 치료를 시작하기 전에 종양 검체에서 BRAF V600E 돌연변이가 있는지 확인하십시오 [임상 연구 (14.7) 참조]. 현재 저등급 교모세포종에서 BRAF V600E 돌연변이 검출을 위한 FDA 승인 검사는 제공되지 않습니다.
2.2
권장 용량
MEKINIST 정제
성인 환자
성인 환자의 경우 MEKINIST 정제의 권장 용량은 1일 1회 경구로 2mg입니다 [용법 및 용량 (2.3) 참조].
소아 환자
체중이 26kg 이상인 소아 환자의 경우 MEKINIST 정제의 권장 용량은 체중에 따라 결정됩니다(표 1) [용법 및 용량 (2.3) 참조]. 체중이 26kg 미만인 환자의 경우 MEKINIST 정제의 권장 용량은 확립되지 않았습니다.
| 체중 | 권장 용량 |
| 26~37kg | 1일 1회 경구로 1mg |
| 38~50kg | 1일 1회 경구로 1.5mg |
| 51kg 이상 | 1일 1회 경구로 2mg |
경구용 MEKINIST
경구용 MEKINIST의 권장 용량은 체중에 따라 결정됩니다(표 2) [용법 및 용량 (2.3) 참조].
| 체중 | 권장 용량 1일 1회 경구 용액 총량 (트라메티닙 함량) |
| 8kg | 0.3mg (6mL) |
| 9kg | 0.35mg (7mL) |
| 10kg | 0.35mg (7mL) |
| 11kg | 0.4mg (8mL) |
| 12~13kg | 0.45mg (9mL) |
| 14~17kg | 0.55mg (11mL) |
| 18~21kg | 0.7mg (14mL) |
| 22~25kg | 0.85mg (17mL) |
| 26~29kg | 0.9mg (18mL) |
| 30~33kg | 1mg (20mL) |
| 34~37kg | 1.15mg (23mL) |
| 38~41kg | 1.25mg (25mL) |
| 42~45kg | 1.4mg (28mL) |
| 46~50kg | 1.6mg (32mL) |
| ≥ 51kg | 2mg (40mL) |
- 절제 불가능하거나 전이성 흑색종 또는 고형 종양, 전이성 비소세포폐암 또는 국소 진행성 또는 전이성 갑상선암 환자의 경우 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 치료를 지속하는 것이 권장됩니다.
- 보조 흑색종 환경에서 권장되는 치료 기간은 질병 재발 또는 용납할 수 없는 독성이 나타날 때까지 최대 1년까지입니다.
- LGG 소아 환자의 경우 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 치료를 지속하는 것이 권장됩니다.
dabrafenib 처방 정보를 참조하여 권장되는 dabrafenib 투여 정보를 확인하십시오.
2.3
투여
- MEKINIST는 매일 같은 시간에 약 24시간 간격으로 복용하십시오.
- MEKINIST는 식사 1시간 전 또는 2시간 후에 복용하십시오 [임상 약리학 (12.3) 참조].
- 다음 MEKINIST 복용 시간 12시간 이내에 MEKINIST를 놓친 경우 복용하지 마십시오.
- MEKINIST 투여 후 구토가 발생하면 추가 복용하지 마십시오. 다음 복용 시간에 예정된 복용량을 복용하십시오.
MEKINIST 정제
- MEKINIST 정제를 부수거나 쪼개지 마십시오.
MEKINIST 경구용 용액
- MEKINIST 경구용 용액은 보호자가 투여하도록 되어 있습니다. 경구용 용액을 사용하기 전에 보호자가 MEKINIST 경구용 용액의 적절한 투여 및 투여 방법에 대한 교육을 받았는지 확인하십시오.
준비 및 투여
- MEKINIST 경구용 용액을 준비하려면 분말이 자유롭게 흐를 때까지 병을 두드립니다. 병에 있는 분말에 증류수 또는 정제수 90mL를 넣고 재부착된 뚜껑으로 병을 뒤집거나 부드럽게 흔들어 분말이 완전히 용해될 때까지 최대 5분 동안 흔들어 투명한 용액을 만듭니다. 병 어댑터를 경구 주사기에서 분리합니다. 용액을 재구성한 후 병 어댑터를 병 목에 삽입합니다. 폐기 날짜를 적으십시오. 재구성 후 MEKINIST 경구용 용액은 35일 동안 사용할 수 있습니다.
- 용액의 최종 농도는 0.05 mg/mL입니다.
- 경구 주사기 또는 영양 튜브(4 프랑스 게이지 또는 그 이상)로 MEKINIST 경구용 용액을 투여하십시오.
- 재구성 후에는 원래 병에 넣어 25°C(77°F) 이하에서 보관하고 냉동하지 마십시오.
2.4
부작용에 대한 투여량 조절
MEKINIST와 관련된 부작용에 대한 투여량 감소는 표 3과 4에 나와 있습니다.
| 권장 투여량 | 1일 1회 경구 1mg | 1일 1회 경구 1.5mg | 1일 1회 경구 2mg |
| 첫 번째 투여량 감소 | 1일 1회 경구 0.5mg | 1일 1회 경구 1mg | 1일 1회 경구 1.5mg |
| 두 번째 투여량 감소 | 해당 없음 | 1일 1회 경구 0.5mg | 1일 1회 경구 1mg |
| 후속 수정 | 최대 두 번의 투여량 감소를 용납할 수 없으면 MEKINIST 정제를 영구적으로 중단하십시오. | ||
| 체중 (권장 용량 1일 1회) |
첫 번째 용량 감소 (1일 1회 투여) |
두 번째 용량 감소 (1일 1회 투여) |
| 8 kg [0.3 mg (6 mL)] |
0.25 mg (5 mL) | 0.15 mg (3 mL) |
| 9 kg [0.35 mg (7 mL)] |
0.25 mg (5 mL) | 0.2 mg (4 mL) |
| 10 kg [0.35 mg (7 mL)] |
0.25 mg (5 mL) | 0.2 mg (4 mL) |
| 11 kg [0.4 mg (8 mL)] |
0.3 mg (6 mL) | 0.2 mg (4 mL) |
| 12 to 13 kg [0.45 mg (9 mL)] |
0.35 mg (7 mL) | 0.25 mg (5 mL) |
| 14 to 17 kg [0.55 mg (11 mL)] |
0.4 mg (8 mL) | 0.3 mg (6 mL) |
| 18 to 21 kg [0.7 mg (14 mL)] |
0.55 mg (11 mL) | 0.35 mg (7 mL) |
| 22 to 25 kg [0.85 mg (17 mL)] |
0.65 mg (13 mL) | 0.45 mg (9 mL) |
| 26 to 29 kg [0.9 mg (18 mL)] |
0.7 mg (14 mL) | 0.45 mg (9 mL) |
| 30 to 33 kg [1 mg (20 mL)] |
0.75 mg (15 mL) | 0.5 mg (10 mL) |
| 34 to 37 kg [1.15 mg (23 mL)] |
0.85 mg (17 mL) | 0.6 mg (12 mL) |
| 38 to 41 kg [1.25 mg (25 mL)] |
0.95 mg (19 mL) | 0.65 mg (13 mL) |
| 42 to 45 kg [1.4 mg (28 mL)] |
1.05 mg (21 mL) | 0.7 mg (14 mL) |
| 46 to 50 kg [1.6 mg (32 mL)] |
1.2 mg (24 mL) | 0.8 mg (16 mL) |
| ≥ 51 kg [2 mg (40 mL)] |
1.5 mg (30 mL) | 1 mg (20 mL) |
| 최대 두 번의 용량 감소를 견딜 수 없으면 MEKINIST 경구용 용액을 영구적으로 중단하십시오. | ||
MEKINIST와 관련된 이상 반응에 대한 용량 조절은 표 5에 제시되어 있습니다.
| a국립 암 연구소의 이상 사례에 대한 일반 용어 기준 (NCI CTCAE) 버전 4.0. bMEKINIST의 권장 용량 감소에 대해서는 표 3과 4를 참조하십시오. c다브라페닙과 함께 투여할 때 다음과 같은 다브라페닙의 이상 반응에 대해서는 MEKINIST의 용량 조절을 권장하지 않습니다. 비피부 악성 종양 및 포도막염. MEKINIST의 용량 조절은 새로운 일차 피부 악성 종양의 경우 필요하지 않습니다. |
|
| 이상 반응의 중증도a | MEKINIST 용량 조절b |
| 출혈 [경고 및 주의 사항 (5.2) 참조] | |
|
MEKINIST 투여 중단.
|
|
MEKINIST를 영구적으로 중단합니다. |
| 정맥혈전색전증 [경고 및 주의 사항 (5.4) 참조] | |
|
MEKINIST를 최대 3주 동안 중단합니다.
|
|
MEKINIST를 영구적으로 중단합니다. |
| 심근병증 [경고 및 주의 사항 (5.5) 참조] | |
|
MEKINIST를 최대 4주 동안 중단합니다.
|
|
MEKINIST를 영구적으로 중단합니다. |
| 안과 독성 [경고 및 주의 사항 (5.6) 참조] | |
|
MEKINIST를 최대 3주 동안 중단합니다.
|
|
MEKINIST를 영구적으로 중단합니다. |
| 폐 [경고 및 주의 사항 (5.7) 참조] | |
|
MEKINIST를 영구적으로 중단합니다. |
| 발열 반응 [경고 및 주의 사항 (5.8) 참조] | |
|
발열이 해소될 때까지 MEKINIST를 중단한 다음 동일하거나 낮은 용량으로 MEKINIST를 재개합니다. |
|
또는
|
| 피부 독성 [경고 및 주의 사항 (5.9) 참조] | |
|
MEKINIST를 최대 3주 동안 중단합니다.
|
|
MEKINIST를 영구적으로 중단합니다. |
| 기타 이상 반응c | |
|
MEKINIST를 중단합니다.
|
|
또는
|
|
MEKINIST를 영구적으로 중단하십시오. |
다브라페닙 처방 정보를 참조하여 다브라페닙과 관련된 유해 반응에 대한 용량 조절을 확인하십시오.
3 제형 및 함량
MEKINIST 정제:
- 0.5 mg 정제: 노란색, 변형된 타원형, 양쪽 볼록, 필름 코팅 정제로 한쪽 면에는 ‘GS’가 각인되어 있고 반대쪽 면에는 ‘TFC’가 각인되어 있습니다.
- 0.5 mg 정제: 노란색, 타원형, 양쪽 볼록, 필름 코팅 정제로 경사면이 있고 한쪽 면에는 노바티스 로고가 각인되어 있고 반대쪽 면에는 ‘TT’가 각인되어 있습니다.
- 2 mg 정제: 분홍색, 둥근 모양, 양쪽 볼록, 필름 코팅 정제로 한쪽 면에는 ‘GS’가 각인되어 있고 반대쪽 면에는 ‘HMJ’가 각인되어 있습니다.
- 2 mg 정제: 분홍색, 둥근 모양, 양쪽 볼록, 필름 코팅 정제로 경사면이 있고 한쪽 면에는 노바티스 로고가 각인되어 있고 반대쪽 면에는 ‘LL’가 각인되어 있습니다.
MEKINIST 경구용 용액:
- 병당 4.7 mg의 트라메티닙을 함유한 백색에서 거의 백색의 분말. 재구성된 딸기 맛 트라메티닙 용액 1 mL에는 트라메티닙 0.05 mg이 함유되어 있습니다.
4 금기사항
없음.
5 경고 및 주의사항
5.1
새로운 원발성 악성종양
피부 악성종양
다브라페닙과 함께 투여한 MEKINIST(성인): 통합 안전성 모집단에서 [부작용(6.1) 참조] 피부 편평상피세포암(cuSCC) 및 각화극세포종은 환자의 2%에서 발생했습니다. 기저세포암과 새로운 원발성 흑색종은 각각 환자의 3% 및 < 1%에서 발생했습니다.
다브라페닙과 함께 투여한 MEKINIST(소아): 통합 안전성 모집단에서 새로운 원발성 흑색종은 환자의 < 1%에서 발생했습니다.
다브라페닙과 함께 사용하는 경우 MEKINIST 치료 시작 전, 치료 중 2개월마다, 병용 치료 중단 후 최대 6개월 동안 피부과적 평가를 수행하십시오.
비피부 악성종양
작용 기전에 따라 다브라페닙은 돌연변이나 다른 기전을 통해 RAS를 활성화하여 악성종양의 성장과 발달을 촉진할 수 있습니다. 다브라페닙의 처방 정보를 참조하십시오.
다브라페닙과 함께 투여한 MEKINIST의 통합 안전성 모집단에서 비피부 악성종양은 환자의 1%에서 발생했습니다.
MEKINIST 및 다브라페닙을 투여받는 환자에게서 비피부 악성종양의 징후나 증상이 나타나는지 면밀히 모니터링하십시오. 비피부 악성종양이 발생한 환자의 경우 MEKINIST 용량을 수정할 필요가 없습니다.
5.2
출혈
MEKINIST를 사용하면 중요 부위나 장기에서 증상이 있는 출혈로 정의되는 주요 출혈을 포함한 출혈이 발생할 수 있습니다. 사망 사례가 보고되었습니다.
다브라페닙과 함께 투여한 MEKINIST(성인): 통합 안전성 모집단에서 [부작용(6.1) 참조] 출혈성 사건은 환자의 17%에서 발생했습니다. 위장관 출혈은 환자의 3%에서 발생했습니다. 두개내 출혈은 환자의 0.6%에서 발생했습니다. 치명적인 출혈은 환자의 0.5%에서 발생했습니다. 치명적인 사건은 뇌출혈과 뇌간 출혈이었습니다.
다브라페닙과 함께 투여한 MEKINIST(소아): 통합 안전성 모집단에서 출혈성 사건은 환자의 25%에서 발생했습니다. 가장 흔한 출혈 유형은 코피(16%)였습니다. 심각한 출혈 사건은 환자의 3.6%에서 발생했으며 위장관 출혈(1.2%), 뇌출혈(0.6%), 자궁 출혈(0.6%), 시술 후 출혈(0.6%), 코피(0.6%)를 포함했습니다.
모든 4등급 출혈성 사건과 개선되지 않는 3등급 출혈성 사건에 대해서는 MEKINIST를 영구적으로 중단하십시오. 3등급 출혈성 사건에 대해서는 MEKINIST를 보류하십시오. 개선되면 다음으로 낮은 용량 수준에서 MEKINIST를 재개하십시오.
5.3
대장염 및 위장관 천공
다음을 복용하는 환자에서 사망을 포함한 대장염 및 위장관 천공이 보고되었습니다.
MEKINIST 단독 요법 및 다브라페닙과 함께 투여(성인): 통합 안전성 모집단에서 [부작용(6.1) 참조] 대장염은 환자의 < 1%에서 발생했으며 위장관 천공은 환자의 < 1%에서 발생했습니다.
다브라페닙과 함께 투여한 MEKINIST(소아): 통합 안전성 모집단에서 대장염 사건은 환자의 <1%에서 발생했습니다.
대장염 및 위장관 천공이 있는지 환자를 면밀히 모니터링하십시오.
5.4
정맥 혈전색전증
다브라페닙과 함께 투여한 MEKINIST(성인): 통합 안전성 모집단에서 [부작용(6.1) 참조] 심부정맥 혈전증(DVT) 및 폐색전증(PE)은 환자의 2%에서 발생했습니다.
다브라페닙과 함께 투여한 MEKINIST(소아): 통합 안전성 모집단에서 색전증 사건은 환자의 < 1%에서 발생했습니다.
숨가쁨, 흉통 또는 팔이나 다리 부기와 같은 DVT 또는 PE 증상이 나타나면 즉시 치료를 받도록 환자에게 조언하십시오. 생명을 위협하는 PE의 경우 MEKINIST를 영구적으로 중단하십시오. 합병증이 없는 DVT 및 PE의 경우 최대 3주 동안 MEKINIST를 보류하십시오. 개선되면 MEKINIST를 더 낮은 용량 수준에서 재개할 수 있습니다. [용량 및 투여(2.4) 참조].
5.5
심근병증
MEKINIST를 사용하면 심부전을 포함한 심근병증이 발생할 수 있습니다.
다브라페닙과 함께 투여한 MEKINIST(성인): 통합 안전성 모집단에서 [부작용(6.1) 참조] 심근병증은 좌심실 박출률(LVEF)이 기준치에서 ≥ 10% 감소하고 기관의 정상 하한(LLN) 미만으로 정의되며 환자의 6%에서 발생했습니다. 심근병증이 발생하여 환자의 3% 및 < 1%에서 각각 MEKINIST의 용량 중단 또는 중단이 발생했습니다. 다브라페닙과 함께 투여한 MEKINIST를 투여받은 50명의 환자 중 45명에서 심근병증이 해결되었습니다.
다브라페닙과 함께 투여한 MEKINIST(소아): 통합 안전성 모집단에서 심근병증은 LVEF가 기준치에서 ≥ 10% 감소하고 기관 LLN 미만으로 정의되며 환자의 9%에서 발생했습니다.
단일 제제로 또는 다브라페닙과 함께 MEKINIST 치료를 시작하기 전, 시작 1개월 후, 그런 다음 치료 중 2~3개월 간격으로 심초음파 또는 다중 게이트 획득(MUGA) 스캔으로 LVEF를 평가하십시오. 기준치에서 LLN 미만으로 10% 이상의 무증상 절대 LVEF 감소의 경우 최대 4주 동안 MEKINIST를 보류하십시오. 정상 LVEF 값으로 개선되면 더 낮은 용량으로 MEKINIST를 재개하십시오. 4주 이내에 정상 LVEF 값으로 개선되지 않으면 MEKINIST를 영구적으로 중단하십시오. 증상이 있는 심근병증 또는 기준치에서 LLN 미만으로 20%를 초과하는 절대 LVEF 감소의 경우 MEKINIST를 영구적으로 중단하십시오. [용량 및 투여(2.4) 참조].
5.6
눈 독성
망막 정맥 폐쇄
MEKINIST 단독 요법의 통합 안전성 모집단 [부작용 (6.1) 참조] 에서 망막 정맥 폐쇄(RVO) 발생률은 0.6%였습니다. 다브라페닙과 함께 투여한 MEKINIST의 통합 안전성 모집단 [부작용 (6.1) 참조]에서는 RVO 사례가 없었습니다. RVO는 황반 부종, 시력 저하, 신생혈관 형성 및 녹내장으로 이어질 수 있습니다.
시력 상실 또는 기타 시각 장애를 보고한 환자에 대해 즉시(24시간 이내) 안과적 평가를 수행하십시오. 문서화된 RVO 환자에게는 MEKINIST를 영구적으로 중단하십시오. [용량 및 투여(2.4) 참조].
망막 색소 상피 박리
MEKINIST를 사용하면 망막 색소 상피 박리(RPED)가 발생할 수 있습니다. 망막 박리는 양측성 및 다초점성일 수 있으며 망막의 중심 황반 부위 또는 망막의 다른 곳에서 발생합니다. 흑색종 및 NSCLC 임상시험에서는 무증상 RPED를 감지하기 위해 환자를 정기적으로 모니터링하지 않았습니다. 따라서 이 소견의 실제 발생률은 알 수 없습니다.
다브라페닙과 함께 투여한 MEKINIST(소아): 통합 안전성 모집단에서 RPED 사건은 환자의 < 1%에서 발생했습니다.
정기적으로 그리고 환자가 시각 장애를 보고할 때마다 안과적 평가를 수행하십시오. RPED가 진단되면 MEKINIST를 보류하십시오. 3주 이내에 반복적인 안과적 평가에서 RPED의 해결이 문서화되면 동일하거나 감량된 용량으로 MEKINIST를 재개하십시오. 3주 후에도 개선이 없으면 감량된 용량으로 MEKINIST를 재개하거나 MEKINIST를 영구적으로 중단하십시오. [용량 및 투여(2.4) 참조].
5.7
간질성 폐 질환/폐렴
MEKINIST 단독 요법의 통합 안전성 모집단 [부작용 (6.1) 참조]에서 간질성 폐 질환 또는 폐렴이 환자의 2%에서 발생했습니다. 다브라페닙과 함께 투여한 MEKINIST의 통합 안전성 모집단 [부작용 (6.1) 참조] 에서 ILD 또는 폐렴이 환자의 1%에서 발생했습니다.
기침, 호흡곤란, 저산소증, 흉막 삼출 또는 침윤을 포함한 새롭거나 진행성 폐 증상 및 소견이 있는 환자의 경우 임상 조사가 완료될 때까지 MEKINIST를 보류하십시오. 치료 관련 ILD 또는 폐렴으로 진단된 환자의 경우 MEKINIST를 영구적으로 중단하십시오. [용량 및 투여(2.4) 참조].
5.8
심각한 열성 반응
MEKINIST를 다브라페닙과 함께 투여할 경우 심각한 열성 반응과 저혈압, 떨림 또는 오한, 탈수증 또는 신부전을 동반한 모든 등급의 발열이 발생할 수 있습니다.
다브라페닙과 함께 투여한 MEKINIST(성인): 통합 안전성 모집단 [부작용 (6.1) 참조]에서 발열은 환자의 58%에서 발생했습니다. 저혈압, 떨림 또는 오한, 탈수증 또는 신부전으로 인해 복잡해진 심각한 열성 반응과 모든 등급의 발열은 환자의 5%에서 발생했습니다. 발열은 저혈압 4%, 탈수증 3%, 실신 2%, 신부전 1%, 심한 오한/떨림 < 1%의 환자에서 발생했습니다.
다브라페닙과 함께 투여한 MEKINIST(소아): 통합 안전성 모집단 [부작용 (6.1) 참조]에서 열은 환자의 66%에서 발생했습니다.
환자의 체온이 ≥ 100.4°F인 경우 단독 요법으로 사용할 때는 MEKINIST를, 병용 요법으로 사용할 때는 MEKINIST와 다브라페닙을 모두 보류하십시오. 재발의 경우 열의 첫 번째 증상에서 치료를 중단할 수도 있습니다. [부작용 (6.1) 참조]. 발열은 저혈압, 떨림 또는 오한, 탈수증 또는 신부전으로 인해 복잡해질 수 있습니다. 심한 열이 나는 동안과 후에 감염 징후와 증상을 평가하고 혈청 크레아티닌 및 기타 신장 기능 증거를 모니터링하십시오. 적절한 경우 환자가 열성 반응에서 최소 24시간 동안 회복된 경우 동일하거나 더 낮은 용량으로 MEKINIST 또는 병용 요법으로 사용할 때 MEKINIST와 다브라페닙을 모두 다시 시작할 수 있습니다. [용량 및 투여(2.4) 참조]. 환자가 이전에 심각한 열성 반응이나 합병증과 관련된 발열을 경험한 경우 MEKINIST를 재개할 때 2차 예방 조치로 해열제를 투여하십시오. 열이 시작된 후 3일 이내에 체온이 기준치로 돌아오지 않거나 탈수증, 저혈압, 신부전 또는 심한 오한/떨림과 같은 합병증과 관련된 열이 있고 활동성 감염의 증거가 없는 경우 두 번째 또는 후속 열에 대해 최소 5일 동안 코르티코스테로이드(예: 프레드니손 10mg 매일)를 투여하십시오.
5.9
심각한 피부 독성
다브라페닙과 함께 MEKINIST를 투여하는 동안 생명을 위협하거나 치명적일 수 있는 스티븐스-존슨 증후군(SJS) 및 호산구 증가증 및 전신 증상을 동반한 약물 반응(DRESS)을 포함한 심각한 피부 이상 반응(SCAR)이 보고되었습니다. [부작용 (6.2) 참조].
다브라페닙과 함께 투여한 MEKINIST(성인): 통합 안전성 모집단 [부작용 (6.1) 참조]에서 기타 심각한 피부 독성은 환자의 < 1%에서 발생했습니다.
다브라페닙과 함께 투여한 MEKINIST(소아): 통합 안전성 모집단에서 피부 및 피하 조직 장애의 심각한 이상 반응은 환자의 1.8%에서 발생했습니다.
새롭거나 악화되는 심각한 피부 반응을 모니터링하십시오. SCAR의 경우 MEKINIST를 영구적으로 중단하십시오. [용량 및 투여(2.4) 참조]. 다른 피부 독성의 경우 참을 수 없거나 심각한 피부 독성에 대해 MEKINIST를 보류하십시오. 3주 이내에 피부 독성이 개선되거나 회복된 환자의 경우 더 낮은 용량으로 MEKINIST를 재개하십시오. 3주 이내에 피부 독성이 개선되지 않으면 MEKINIST를 영구적으로 중단하십시오. [용량 및 투여(2.4) 참조].
5.10
고혈당증
다브라페닙과 함께 투여한 MEKINIST(성인): 통합 안전성 모집단에서 [부작용(6.1) 참조], 다브라페닙과 함께 MEKINIST를 투여받은 당뇨병 병력이 있는 환자의 15%에서 더욱 집중적인 저혈당 치료가 필요했습니다. 3등급 및 4등급 고혈당증은 환자의 2%에서 발생했습니다.
다브라페닙과 함께 투여한 MEKINIST(소아): 통합 안전성 모집단에서 3등급 및 4등급 고혈당증 사례는 환자의 1% 미만에서 발생했습니다.
당뇨병 또는 고혈당증이 있는 환자에게 다브라페닙과 함께 MEKINIST를 투여할 때 투여 시작 시 및 임상적으로 적절한 경우 혈청 포도당 수치를 모니터링하십시오. 임상적으로 필요에 따라 항고혈당제를 시작하거나 최적화하십시오.
5.11
병용 치료와 관련된 위험
MEKINIST는 다브라페닙과 병용하여 사용하도록 승인되었습니다. 다브라페닙과 함께 MEKINIST 치료를 시작하기 전에 다브라페닙의 심각한 위험에 대한 정보는 다브라페닙의 처방 정보를 검토하십시오.
5.12
혈구탐식성 림프조직구증
다브라페닙과 함께 MEKINIST를 투여했을 때 시판 후 환경에서 혈구탐식성 림프조직구증(HLH)이 관찰되었습니다. HLH가 의심되는 경우 치료를 중단하십시오. HLH가 확인되면 치료를 중단하고 적절한 HLH 관리를 시작하십시오.
5.13
태아 독성
동물 연구 결과 및 작용 기전에 따라 MEKINIST는 임산부에게 투여했을 때 태아에게 해를 끼칠 수 있습니다. 트라메티닙은 권장 성인 임상 용량에서 인체 노출량의 약 0.3배에 해당하는 노출량 이상의 용량을 토끼에게 투여했을 때 배아 독성 및 유산 효과를 나타냈습니다. 임산부에게 태아에 대한 잠재적 위험을 알리십시오. 가임 여성에게는 MEKINIST 치료 중 및 치료 후 4개월 동안 효과적인 피임법을 사용하도록 권고하십시오. [특정 환자군에서의 사용(8.1, 8.3) 참조].
6 부작용
다음 임상적으로 중요한 유해 반응은 라벨링의 다른 부분에서 설명됩니다.
- 새로운 일차 악성 종양 [경고 및 주의 사항 (5.1)]
- 출혈 [경고 및 주의 사항 (5.2)]
- 대장염 및 위장관 천공 [경고 및 주의 사항 (5.3)]
- 정맥혈전색전증 [경고 및 주의 사항 (5.4)]
- 심근병증 [경고 및 주의 사항 (5.5)]
- 안구 독성 [경고 및 주의 사항 (5.6)]
- 간질성 폐 질환/폐렴 [경고 및 주의 사항 (5.7)]
- 중증 발열 반응 [경고 및 주의 사항 (5.8)]
- 중증 피부 독성 [경고 및 주의 사항 (5.9)]
- 고혈당증 [경고 및 주의 사항 (5.10)]
- 식세포성 림프조직구증 [경고 및 주의 사항 (5.12)]
다브라페닙과 관련된 추가적인 유해 반응이 있습니다. 추가 정보는 다브라페닙 처방 정보를 참조하십시오.
6.1
임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 유해 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제에서 관찰된 발생률을 반영하지 않을 수 있습니다.
성인 안전성 집단
경고 및 주의 사항에 설명된 풀링된 안전성 집단은 METRIC, MEK113583 및 MEK111054에 등록된 다양한 고형 종양 환자 329명에서 단일 요법으로 MEKINIST 2mg을 경구로 1일 1회 투여한 노출을 반영합니다. 단일 요법으로 MEKINIST를 투여받은 이 329명의 환자 중 33%는 6개월 이상 노출되었고 9%는 1년 이상 노출되었습니다.
경고 및 주의 사항에 설명된 풀링된 안전성 집단은 COMBI-d, COMBI-v, COMBI-AD 및 BRF113928에 등록된 절제 불가능 또는 전이성 흑색종, 보조 흑색종 또는 비소세포폐암 환자 1087명에서 다브라페닙 150mg을 경구로 1일 2회 투여와 병용하여 MEKINIST 2mg을 경구로 1일 1회 투여한 노출을 반영합니다. 다브라페닙과 병용하여 MEKINIST를 투여받은 이 1087명의 환자 중 70%는 6개월 이상 노출되었고 21%는 1년 이상 노출되었습니다.
소아 안전성 집단
경고 및 주의 사항에 설명된 소아 풀링된 안전성 집단은 두 가지 시험에서 다브라페닙과 병용하여 체중 기반 MEKINIST를 경구로 1일 1회 투여한 노출을 반영합니다. 두 가지 시험은 BRAF V600E 돌연변이 양성 교모세포종으로 전신 치료가 필요한 소아 환자를 대상으로 한 다기관, 공개, 다군 연구(연구 G2201; n = 123)와 MAPK 경로 활성화가 있는 난치성 또는 재발성 고형 종양이 있는 소아 환자를 대상으로 한 다기관, 공개, 다군 연구(연구 X2101; n = 43)입니다. [임상 연구 (14.6, 14.7) 참조]. 다브라페닙과 병용하여 MEKINIST를 투여받은 166명의 환자 중 85%는 6개월 동안 노출되었고 69%는 1년 이상 노출되었습니다. 가장 흔한(> 20%) 유해 반응은 발열(66%), 발진(54%), 두통(40%), 구토(38%), 근골격계 통증(36%), 피로(31%), 건조한 피부(31%), 설사(30%), 메스꺼움(26%), 코피 및 기타 출혈 사건(25%), 복통(24%) 및 여드름성 피부염(23%)이었습니다. 가장 흔한(> 2%) 등급 3 또는 4 실험실 이상은 호중구 수 감소(20%), 알라닌 아미노트랜스퍼라제 증가(3.1%) 및 아스파르테이트 아미노트랜스퍼라제 증가(3.1%)였습니다.
절제 불가능 또는 전이성 BRAF V600E 또는 V600K 돌연변이 양성 흑색종
단일 요법으로 MEKINIST
MEKINIST의 안전성은 METRIC 연구에서 평가되었습니다. METRIC 연구는 BRAF V600E 또는 V600K 돌연변이 양성 절제 불가능 또는 전이성 흑색종 환자를 대상으로 한 무작위 배정, 공개 시험으로, MEKINIST(N = 211) 2mg을 경구로 1일 1회 투여하거나 화학 요법(N = 99)(다카바진 1000mg/m2를 3주마다 투여하거나 파클리탁셀 175mg/m2를 3주마다 투여)을 투여했습니다. [임상 연구 (14.1) 참조]. 비정상적인 LVEF, 6개월 이내의 급성 관상 동맥 증후군 병력 또는 현재 II등급 이상의 심부전(뉴욕 심장 협회) 증거가 있는 환자는 제외되었습니다. MEKINIST 치료의 중앙값 기간은 4.3개월이었습니다.
이 연구에서 MEKINIST를 투여받은 환자의 9%는 시험 약물의 영구적인 중단으로 이어지는 유해 반응을 경험했습니다. MEKINIST의 영구적인 중단으로 이어지는 가장 흔한 유해 반응은 LVEF 감소, 폐렴, 신부전, 설사 및 발진이었습니다. 유해 반응으로 인해 MEKINIST를 투여받은 환자의 27%에서 용량 감소가 발생했습니다. 발진과 LVEF 감소는 MEKINIST 용량 감소의 가장 흔한 이유였습니다. 표 6과 표 7은 METRIC 연구에서 단일 요법으로 MEKINIST를 투여한 경우의 유해 반응과 실험실 이상을 각각 보여줍니다.
| aNCI CTCAE 버전 4.0. b4등급 부작용은 trametinib군에서 발진(n = 1)과 화학 요법군에서 설사(n = 1)로 제한됨. c구내염, 아프타성 구내염, 구강 궤양 및 점막 염증 포함. d복통, 하복통, 상복통 및 복부 압통 포함. e림프부종, 부종 및 말초 부종 포함. f코피, 잇몸 출혈, 혈변, 직장 출혈, 흑색 변, 질 출혈, 치핵 출혈, 혈뇨 및 결막 출혈 포함. |
||||
| 부작용 | MEKINIST | 화학 요법 | ||
| N = 211 | N = 99 | |||
| 모든 등급a (%) |
등급 3 및 4b (%) |
모든 등급a (%) |
등급 3 및 4b (%) |
|
| 피부 및 피하 조직 | ||||
| 발진 | 57 | 8 | 10 | 0 |
| 여드름성 피부염 | 19 | < 1 | 1 | 0 |
| 건조한 피부 | 11 | 0 | 0 | 0 |
| 가려움증 | 10 | 2 | 1 | 0 |
| 손톱 주위염 | 10 | 0 | 1 | 0 |
| 위장 | ||||
| 설사 | 43 | 0 | 16 | 2 |
| 구내염c | 15 | 2 | 2 | 0 |
| 복통d | 13 | 1 | 5 | 1 |
| 혈관 | ||||
| 림프부종e | 32 | 1 | 4 | 0 |
| 고혈압 | 15 | 12 | 7 | 3 |
| 출혈f | 13 | < 1 | 0 | 0 |
| 약어: ALT, 알라닌 아미노 전이효소; AST, 아스파르트산 아미노 전이효소. a두 치료군 모두에서 3등급 이상반응만 보고되었습니다. |
||||
| 실험실 이상 | MEKINIST | 화학 요법 | ||
| N = 211 | N = 99 | |||
| 모든 등급 (%) |
등급 3 및 4 (%) |
모든 등급 (%) |
등급 3 및 4 (%) |
|
| AST 증가 | 60 | 2 | 16 | 1 |
| 저알부민혈증 | 42 | 2 | 23 | 1 |
| ALT 증가 | 39 | 3 | 20 | 3 |
| 빈혈 | 38 | 2 | 26 | 3 |
| 알칼리성 인산 가수분해효소 증가 | 24 | 2 | 18 | 3 |
MEKINIST 단독 요법 임상 연구에서 MEKINIST를 투여받은 환자의 10% 미만에서 관찰된 다른 임상적으로 중요한 유해 반응은 다음과 같습니다.
심장: 서맥, 방실 블록, bundle branch block
위장: 구강 건조
감염 및 기생충: 모낭염, 농포성 발진, 봉와직염
근골격 및 결합 조직: 횡문근 융해증
신경계: 현기증, 미각 이상, 말초 신경병증
안과: 시력 흐림, 안구 건조증
MEKINIST와 다브라페닙
다브라페닙과 함께 투여했을 때 MEKINIST의 안전성은 두 가지 임상 시험, 즉 COMBI-d 연구(n = 209, 다기관, 이중맹검, 무작위 배정(1:1), 활성 대조군 임상 시험)와 COMBI-v 연구(n = 350, 다기관, 공개, 무작위 배정(1:1), 활성 대조군 임상 시험)에서 이전에 치료받지 않은, 절제 불가능하거나 전이성 BRAF V600 돌연변이 양성 흑색종 환자 559명을 대상으로 평가되었습니다. 두 임상 시험 모두에서 환자는 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 MEKINIST 2mg을 1일 1회 경구 투여하고 다브라페닙 150mg을 1일 2회 경구 투여받았습니다. 두 임상 시험 모두 비정상적인 LVEF, 6개월 이내의 급성 관상 동맥 증후군 병력, 2등급 이상의 심부전(뉴욕 심장 협회), RVO 또는 RPED 병력, QTcB 간격 ≥ 480msec, 조절되지 않는 고혈압, 조절되지 않는 부정맥, 활성 뇌 전이 또는 알려진 포도당-6-인산 탈수소 효소 결핍 병력이 있는 환자는 제외되었습니다. [임상 연구(14.1) 참조].
이 559명의 환자 중 197명(35%)은 MEKINIST에 6개월에서 12개월 이상 노출되었고 185명(33%)은 MEKINIST에 1년 이상 노출되었습니다. 중앙값 연령은 55세(범위: 18~91세)였으며, 남성이 57%, 백인이 98%, 기준 ECOG 수행 상태가 0인 환자가 72%, 기준 ECOG 수행 상태가 1인 환자가 28%, M1c 질환이 64%, 기준 젖산 탈수소 효소(LDH)가 상승한 환자가 35%, 뇌 전이 병력이 있는 환자가 0.5%였습니다.
COMBI-d 및 COMBI-v 연구에서 MEKINIST와 다브라페닙을 함께 투여받은 환자에서 MEKINIST에 대한 가장 흔한 유해 반응(≥ 20%)은 발열, 메스꺼움, 발진, 오한, 설사, 구토, 고혈압 및 말초 부종이었습니다.
COMBI-d 연구에 등록된 환자의 인구 통계학적 특징과 기준 종양 특징은 임상 연구에 요약되어 있습니다. [임상 연구(14.1) 참조]. MEKINIST와 다브라페닙을 함께 투여받은 환자는 MEKINIST에 대한 중앙값 노출 기간이 11개월(범위: 3일~30개월)이었습니다. MEKINIST와 다브라페닙을 함께 투여받은 209명의 환자 중 26%는 MEKINIST에 6개월에서 12개월 이상 노출되었고 46%는 MEKINIST에 1년 이상 노출되었습니다.
COMBI-d 연구에서 MEKINIST와 다브라페닙을 함께 투여받은 환자의 11%에서 MEKINIST 중단으로 이어지는 유해 반응이 발생했으며, 가장 흔한 유해 반응은 발열(1.4%)과 박출 분율 감소(1.4%)였습니다. MEKINIST와 다브라페닙을 함께 투여받은 환자의 18%에서 MEKINIST 용량 감소로 이어지는 유해 반응이 발생했으며, 가장 흔한 유해 반응은 발열(2.9%), 호중구 감소증(1.9%), 박출 분율 감소(1.9%) 및 발진(1.9%)이었습니다. MEKINIST와 다브라페닙을 함께 투여받은 환자의 46%에서 MEKINIST 투여 중단으로 이어지는 유해 반응이 발생했으며, 가장 흔한 유해 반응은 발열(18%), 오한(7%), 구토(6%) 및 박출 분율 감소(4.8%)였습니다.
표 8과 표 9는 각각 COMBI-d 연구에서 관찰된 MEKINIST의 선택된 유해 반응과 실험실 이상을 보여줍니다.
|
* 단독 다브라페닙을 투여받은 환자와 비교하여 MEKINIST와 다브라페닙을 함께 투여받은 환자에서 모든 등급의 경우 ≥ 5% 또는 3~4등급의 경우 ≥ 2% 발생 빈도. aNCI CTCAE 버전 4.0. b말초 부종, 부종, 림프 부종, 국소 부종 및 전신 부종 포함. c복통, 상복부 통증, 하복부 통증 및 복부 불편함 포함. d발진, 전신 발진, 가려움증을 동반한 발진, 홍반성 발진, 구진성 발진, 수포성 발진, 반점성 발진, 반점구진성 발진 및 모낭성 발진 포함. e가장 흔한 사건(≥ 1%)은 코피, 혈변, 헤모글로빈 감소, 자반증 및 직장 출혈입니다. 4등급 사건은 간혈종 및 십이지장 궤양 출혈(각각 혼합 병용군에서 n = 1)로 제한되었습니다. |
||||||
| 유해 반응 | MEKINIST와 다브라페닙 병용 N = 559 |
COMBI-d 연구 | ||||
| MEKINIST와 다브라페닙 병용 N = 209 |
다브라페닙 N = 211 |
|||||
| 전체 등급 (%) |
등급 3 및 4 (%) |
전체 등급 (%) |
등급 3 및 4 (%) |
전체 등급 (%) |
등급 3 및 4 (%) |
|
| 일반 | ||||||
|
발열 |
54 | 5 | 57 | 7 | 33 | 1.9 |
|
오한 |
31 | 0.5 | 31 | 0 | 17 | 0.5 |
|
말초 부종b |
21 | 0.7 | 25 | 1.4 | 11 | 0.5 |
| 위장 | ||||||
|
메스꺼움 |
35 | 0.4 | 34 | 0.5 | 27 | 1.4 |
|
설사 |
31 | 1.3 | 30 | 1.4 | 16 | 0.9 |
|
구토 |
27 | 1.1 | 25 | 1.0 | 14 | 0.5 |
|
복통c |
18 | 0.9 | 26 | 1.0 | 14 | 2.4 |
| 피부 및 피하 조직 | ||||||
|
발진d |
32 | 1.1 | 42 | 0 | 27 | 1.4 |
| 혈관 | ||||||
|
고혈압 |
26 | 11 | 25 | 6 | 16 | 6 |
|
출혈e |
18 | 2.0 | 19 | 1.9 | 15 | 1.9 |
| 신경계 | ||||||
|
현기증 |
11 | 0.2 | 14 | 0 | 7 | 0 |
COMBI-d 및 COMBI-v 연구(N = 559)에서 다브라페닙과 병용하여 MEKINIST를 투여받은 환자의 10% 미만에서 관찰된 MEKINIST의 다른 임상적으로 중요한 유해 반응은 다음과 같습니다.
심장: 서맥, 방실 블록, 방실 블록
면역 체계: 사르코이드증
근골격계 및 결합 조직: 횡문근 융해증
신경계: 말초 신경병증
피부 및 피하 조직: 광과민성
| 약어: ALT, 알라닌 아미노 전이효소; AST, 아스파르트산 아미노 전이효소. * 다브라페닙과 함께 MEKINIST를 투여받은 환자에서 단일 요법 다브라페닙을 투여받은 환자에 비해 모든 등급의 경우 ≥ 5% 또는 3~4등급의 경우 ≥ 2% 발생률. a이러한 실험실 검사의 경우 분모는 556입니다. b이러한 실험실 검사의 경우 분모는 병용 요법 군의 경우 208, 다브라페닙 군의 경우 207-209입니다. c4등급 유해 반응은 림프구 감소증 및 고혈당(각각 n = 4), ALT 증가 및 AST 증가(각각 n = 3), 호중구 감소증(n = 2) 및 저나트륨혈증(n = 1)이 병용 요법 군에 국한됩니다. COMBI-d 연구 병용 요법 군에서 호중구 감소증, 림프구 감소증, ALT 증가, AST 증가 및 고혈당(각각 n = 1); 다브라페닙 군에서 호중구 감소증, 혈소판 감소증, ALT 증가 및 AST 증가(각각 n = 1). |
||||||
| 실험실 이상 | MEKINIST 플러스 다브라페닙 N = 559a |
COMBI-d 연구 | ||||
| MEKINIST 플러스 다브라페닙 N = 209b |
다브라페닙 N = 211b |
|||||
| 모두 등급 (%) |
등급 3 및 4c (%) |
모두 등급 (%) |
등급 3 및 4c (%) |
모두 등급 (%) |
등급 3 및 4c (%) |
|
| 화학 | ||||||
|
고혈당 |
60 | 4.7 | 65 | 6 | 57 | 4.3 |
|
저알부민혈증 |
48 | 1.1 | 53 | 1.4 | 27 | 0 |
|
저나트륨혈증 |
25 | 8 | 24 | 6 | 14 | 2.9 |
| 간 | ||||||
|
AST 증가 |
59 | 4.1 | 60 | 4.3 | 21 | 1.0 |
| 혈액 알칼리성 포스파타제 증가 | 49 | 2.7 | 50 | 1.0 | 25 | 0.5 |
|
ALT 증가 |
48 | 4.5 | 44 | 3.8 | 28 | 1.0 |
| 혈액학 | ||||||
|
Neutropenia |
46 | 7 | 50 | 6 | 16 | 1.9 |
|
Anemia |
43 | 2.3 | 43 | 2.4 | 38 | 4.3 |
|
Lymphopenia |
32 | 8 | 38 | 9 | 28 | 7 |
|
Thrombocytopenia |
21 | 0.7 | 19 | 0.5 | 10 | 0.5 |
BRAF V600E 또는 V600K 돌연변이 양성 흑색종의 보조 치료
COMBI-AD 연구에서 연구 치료를 최소 1회 투여 받은 BRAF V600E 또는 V600K 돌연변이가 있는 3기 흑색종 환자 435명을 대상으로 다브라페닙과 함께 투여했을 때 MEKINIST의 안전성을 평가했습니다 [임상 연구(14.2) 참조]. 환자는 MEKINIST 2mg을 1일 1회 경구 투여하고 다브라페닙 150mg을 1일 2회 경구 투여하여 12개월 동안 치료를 받았습니다. 이 시험은 LVEF 이상, 6개월 이내에 급성 관상 동맥 증후군, 관상 동맥 혈관 성형술 또는 스텐트 삽입 병력, 2등급 이상의 심부전(뉴욕 심장 협회), QTc 간격 ≥ 480msec, 치료 불응성 고혈압, 조절되지 않는 부정맥 또는 RVO 병력이 있는 환자는 제외했습니다.
다브라페닙과 함께 MEKINIST를 투여받은 환자의 MEKINIST 노출 기간 중앙값은 11개월(범위: 0~12)이었습니다. 다브라페닙과 함께 MEKINIST를 투여받은 435명의 환자 중 72%가 6개월 이상 MEKINIST에 노출되었습니다. 다브라페닙과 함께 MEKINIST를 투여받은 환자의 중앙값 연령은 50세(범위: 18~89)였으며, 56%가 남성, 99%가 백인, 92%가 기준 ECOG 수행 상태가 0이었고, 8%가 기준 ECOG 수행 상태가 1이었습니다.
다브라페닙과 함께 MEKINIST를 투여받은 환자에서 가장 흔한 이상 반응(≥ 20%)은 발열, 피로, 오심, 두통, 발진, 오한, 설사, 구토, 관절통 및 근육통이었습니다.
MEKINIST 중단 및 투여 중단으로 이어진 이상 반응은 각각 환자의 24% 및 54%에서 발생했으며, 가장 흔한 원인은 발열과 오한이었습니다. MEKINIST 투여량 감소로 이어진 이상 반응은 환자의 23%에서 발생했으며, 가장 흔한 원인은 발열과 박출 분율 감소였습니다.
표 10은 다브라페닙과 함께 MEKINIST를 투여받은 환자의 20% 이상에서 발생한 이상 반응을 요약한 것입니다.
| aNCI CTCAE 버전 4.0. b발열 및 고열 포함. c피로, 무력증 및 권태감 포함. d두통 및 긴장성 두통 포함. e발진, 구진-반점상 발진, 반점상 발진, 전신 발진, 홍반성 발진, 구진성 발진, 가려움증이 있는 발진, 결절성 발진, 수포성 발진 및 농포성 발진 포함. f근육통, 근골격계 통증 및 근골격계 흉통 포함. |
||||
| 이상 반응 | MEKINIST + 다브라페닙 N = 435 |
위약 N = 432 |
||
| 모든 등급 (%) |
등급 3 및 4 (%) |
모든 등급 (%) |
등급 3 및 4 (%) |
|
| 일반 | ||||
| 발열b | 63 | 5 | 11 | < 1 |
| 피로c | 59 | 5 | 37 | < 1 |
| 오한 | 37 | 1 | 4 | 0 |
| 위장 | ||||
| 오심 | 40 | < 1 | 20 | 0 |
| 설사 | 33 | < 1 | 15 | < 1 |
| 구토 | 28 | < 1 | 10 | 0 |
| 신경계 | ||||
| 두통d | 39 | 1 | 24 | 0 |
| 피부 및 피하 조직 | ||||
| 발진e | 37 | < 1 | 16 | < 1 |
| 근골격계 및 결합 조직 | ||||
| 관절통 | 28 | < 1 | 14 | 0 |
| 근육통f | 20 | < 1 | 14 | 0 |
COMBI-AD 연구에서 다브라페닙과 병용하여 MEKINIST를 투여받은 환자의 20% 미만에서 관찰된 MEKINIST의 다른 임상적으로 중요한 유해 반응은 다음과 같습니다. 시력흐림(6%), 박출 분율 감소(5%), 말초 신경병증(2.5%), 횡문근 융해증(< 1%), 방실 블록(< 1%), 사르코이드증(< 1%).
실험실 이상은 표 11에 요약되어 있습니다.
| 약어: ALT, 알라닌 아미노 전이효소; AST, 아스파르트산 아미노 전이효소. a발생률은 기준선과 연구 중 적어도 한 번의 실험실 측정치를 모두 가진 환자 수를 기반으로 합니다. MEKINIST 플러스 다브라페닙(범위: 429~431) 및 위약군(범위: 426~428). |
||||
| 실험실 이상 | MEKINIST 플러스 다브라페닙a N = 435 |
위약a N = 432 |
||
| 모두 등급 (%) |
등급 3 및 4 (%) |
모두 등급 (%) |
등급 3 및 4 (%) |
|
| 화학 | ||||
| 고혈당증 | 63 | 3 | 47 | 2 |
| 저인산혈증 | 42 | 7 | 10 | < 1 |
| 저알부민혈증 | 25 | < 1 | < 1 | 0 |
| 간 | ||||
| AST 증가 | 57 | 6 | 11 | < 1 |
| ALT 증가 | 48 | 5 | 18 | < 1 |
| 혈액 알칼리성 포스파타제 증가 | 38 | 1 | 6 | < 1 |
| 혈액학 | ||||
| 호중구 감소증 | 47 | 6 | 12 | < 1 |
| 림프구 감소증 | 26 | 5 | 6 | < 1 |
| 빈혈 | 25 | < 1 | 6 | < 1 |
COMBI-APlus 시험 (발열 관리 연구)
COMBI-APlus는 완전 절제 후 BRAF V600 돌연변이 양성 흑색종의 보조 치료에서 트라메티닙과 함께 투여된 다브라페닙을 받은 환자에서 개정된 발열 관리 알고리즘의 발열 관련 결과에 대한 영향을 평가했습니다. 발열 관리 알고리즘은 환자의 체온이 ≥ 100.4°F일 때 다브라페닙과 트라메티닙 모두를 중단했습니다.
3-4등급 발열은 환자의 4.3%에서 발생했고, 발열로 인한 입원은 환자의 5.1%에서 발생했으며, 합병증이 있는 발열(탈수, 저혈압, 신장 기능 장애, 실신, 심한 오한)은 환자의 2.2%에서 발생했고, 발열로 인한 치료 중단은 환자의 2.5%에서 발생했습니다.
전이성 BRAF V600E 돌연변이 양성 비소세포폐암
다브라페닙과 함께 투여했을 때 MEKINIST의 안전성은 다기관, 다군, 비무작위, 공개 표지 시험(연구 BRF113928)에서 이전에 치료받지 않은(n = 36) 및 이전에 치료받은(n = 57) 전이성 BRAF V600E 돌연변이 양성 NSCLC 환자 93명에서 평가되었습니다. 환자는 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 MEKINIST 2mg을 1일 1회 경구 투여하고 다브라페닙 150mg을 1일 2회 경구 투여했습니다. 이 시험은 비정상적인 LVEF, 6개월 이내의 급성 관상 동맥 증후군 병력, 2등급 이상의 심부전(뉴욕 심장 협회), QTc 간격 ≥ 480msec, 치료에 반응하지 않는 고혈압, 조절되지 않는 부정맥, 활성 뇌 전이, ILD 또는 폐렴 병력, 또는 RVO 병력 또는 현재 RVO가 있는 환자를 제외했습니다. [임상 연구(14.3) 참조].
이 93명의 환자 중 53명(57%)은 MEKINIST와 다브라페닙에 6개월 이상 노출되었고 27명(29%)은 MEKINIST와 다브라페닙에 1년 이상 노출되었습니다. 중앙값 연령은 65세(범위: 41~91세)였고, 46%가 남성이었으며, 85%가 백인이었습니다. 32%는 기준 ECOG 수행 상태가 0이었고 61%는 ECOG 수행 상태가 1이었습니다. 98%는 비편평 상피 조직학을 가졌고, 12%는 현재 흡연자였으며, 60%는 과거 흡연자였으며, 28%는 흡연 경험이 없었습니다.
이 93명의 환자에서 가장 흔한 유해 반응(≥ 20%)은 발열, 피로, 메스꺼움, 구토, 설사, 건조한 피부, 식욕 감소, 부종, 발진, 오한, 출혈, 기침 및 호흡 곤란이었습니다.
MEKINIST 중단으로 이어진 유해 반응은 환자의 19%에서 발생했으며, 가장 흔한 것은 발열(2.2%), 박출 분율 감소(2.2%) 및 호흡 곤란(2.2%)이었습니다. MEKINIST 용량 감소로 이어진 유해 반응은 환자의 30%에서 발생했으며, 가장 흔한 것은 발열(5%), 메스꺼움(4.3%), 구토(4.3%), 설사(3.2%) 및 호중구 감소증(3.2%)이었습니다. MEKINIST 용량 중단으로 이어진 유해 반응은 환자의 57%에서 발생했으며, 가장 흔한 것은 발열(16%), 구토(10%), 호중구 감소증(8%), 메스꺼움(5%) 및 박출 분율 감소(5%)였습니다.
표 12와 표 13은 연구 BRF113928에서 다브라페닙과 병용한 MEKINIST의 유해 반응과 실험실 이상을 각각 보여줍니다.
| aNCI CTCAE 버전 4.0. b피로, 불쾌감 및 무력증 포함. c말초 부종, 부종 및 전신 부종 포함. d발진, 전신 발진, 구진성 발진, 반점성 발진, 반점구진성 발진 및 농포성 발진 포함. e객혈, 혈종, 코피, 자반, 혈뇨, 지주막하 출혈, 위 출혈, 방광 출혈, 타박상, 혈변, 주사 부위 출혈, 폐 출혈 및 복막 후 출혈 포함. |
||
| 유해 반응 | MEKINIST와 다브라페닙 N = 93 |
|
| 모든 등급 (%) |
등급 3 및 4 (%) |
|
| 일반 | ||
| 발열 | 55 | 5 |
| 피로b | 51 | 5 |
| 부종c | 28 | 0 |
| 오한 | 23 | 1.1 |
| 위장관 | ||
| 메스꺼움 | 45 | 0 |
| 구토 | 33 | 3.2 |
| 설사 | 32 | 2.2 |
| 식욕 감소 | 29 | 0 |
| 피부 및 피하 조직 | ||
| 건조한 피부 | 31 | 1.1 |
| 발진d | 28 | 3.2 |
| 혈관 | ||
| 출혈e | 23 | 3.2 |
| 호흡기계 | ||
| 기침 | 22 | 0 |
| 호흡곤란 | 20 | 5 |
다브라페닙과 함께 투여된 MEKINIST를 투여받은 환자의 20% 미만에서 관찰된 MEKINIST에 대한 다른 임상적으로 중요한 유해 반응은 다음과 같습니다.
심장: 심방 세동
신경계: 말초 신경병증
| 약어: ALT, 알라닌 아미노 전이효소; AST, 아스파르테이트 아미노 전이효소. a이러한 실험실 검사의 경우, 분모는 90입니다. b이러한 실험실 검사의 경우, 분모는 91입니다. |
||
| 실험실 이상 | MEKINIST plus Dabrafenib N = 93 |
|
| 모든 등급 (%) |
등급 3 및 4 (%) |
|
| 화학a | ||
| 고혈당증 | 71 | 9 |
| 저나트륨혈증 | 57 | 17 |
| 저인산혈증 | 36 | 7 |
| 크레아티닌 증가 | 21 | 1.1 |
| 간a | ||
| 혈액 알칼리성 포스파타제 증가 | 64 | 0 |
| AST 증가 | 61 | 4.4 |
| ALT 증가 | 32 | 6 |
| 혈액학b | ||
| 백혈구 감소증 | 48 | 8 |
| 빈혈 | 46 | 10 |
| 호중구 감소증 | 44 | 8 |
| 림프구 감소증 | 42 | 14 |
BRAF V600E 돌연변이 양성 진행성 종양
연구 BRF117019
다브라페닙과 함께 투여했을 때 MEKINIST의 안전성은 BRAF V600E 돌연변이가 있는 암 환자를 대상으로 다중 코호트, 다기관, 비무작위 배정, 공개 표지 연구(연구 BRF117019)에서 평가되었습니다. 총 206명의 환자가 시험에 등록되었으며, 그 중 36명은 ATC 코호트에 등록되었고, 105명은 특정 고형 종양 코호트에 등록되었고, 65명은 기타 악성 종양에 등록되었습니다. [임상 연구(14.4, 14.6) 참조]. 환자는 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 MEKINIST 2mg을 1일 1회 경구 투여하고 다브라페닙 150mg을 1일 2회 경구 투여했습니다.
이 206명의 환자 중 101명(49%)은 MEKINIST에 1년 이상 노출되었고 103명(50%)은 다브라페닙에 1년 이상 노출되었습니다. 중앙값 연령은 60세(범위: 18~89세)였으며, 남성이 56%, 백인이 79%, 기준 ECOG 수행 상태가 0인 환자가 34%, ECOG 수행 상태가 1인 환자가 60%였습니다.
다브라페닙과 함께 MEKINIST를 투여받은 환자의 45%에서 중대한 유해 반응이 발생했습니다. 환자의 5% 이상에서 발생한 중대한 유해 반응에는 발열(11%)과 폐렴(6%)이 포함되었습니다. 다브라페닙과 함께 MEKINIST를 투여받은 환자의 3.9%에서 치명적인 유해 반응이 발생했습니다. 환자의 1% 이상에서 발생한 치명적인 유해 반응에는 패혈증(1.9%)이 포함되었습니다.
유해 반응으로 인한 영구적인 치료 중단은 환자의 13%에서 발생했습니다. 환자의 1% 이상에서 영구적인 치료 중단을 초래한 유해 반응에는 메스꺼움(1.5%)이 포함되었습니다.
유해 반응으로 인한 투약 중단은 환자의 55%에서 발생했습니다. 환자의 5% 이상에서 투약 중단을 요구한 유해 반응에는 발열(22%), 오한(9%), 피로(6%), 호중구 감소증(6%), 메스꺼움(5%)이 포함되었습니다.
유해 반응으로 인한 투약 감량은 환자의 44%에서 발생했습니다. 환자의 5% 이상에서 투약 감량을 요구한 유해 반응에는 발열(18%), 오한(8%), 피로(6%)가 포함되었습니다.
실험실 이상을 포함한 가장 흔한(≥ 20%) 유해 반응은 표 14와 표 15에 나와 있습니다.
표 14는 연구 BRF117019의 유해 반응을 요약한 것입니다.
| aNCI CTCAE 버전 4.0. b피로, 무력증, 불쾌감 포함. c말초 부종 및 말초 팽윤 포함. d발진, 구진-반점상 발진, 홍반성 발진, 농포성 발진, 구진성 발진 포함. e코피, 혈뇨, 타박상, 혈종, 객혈, 결막 출혈, 혈변, 직장 출혈, 치핵 출혈, 흑변, 자반, 안구 타박상, 안구 출혈, 위 출혈, 치은 출혈, 토혈, 두개내 출혈, 출혈성 뇌졸중, 혈흉, 멍이 잘 드는 경향 증가, 대장 출혈, 구강 출혈, 점상 출혈, 인두 출혈, 프로트롬빈 시간 연장, 폐 혈종, 망막 출혈, 질 출혈, 유리체 출혈 포함. f기침 및 객담 포함. g근육통, 근골격계 흉통, 근골격계 통증 포함. |
||
| 유해 반응 | MEKINIST와 다브라페닙a (N = 206) |
|
| 모든 등급 (%) |
3등급 또는 4등급 (%) |
|
| 일반 | ||
| 발열 | 55 | 4.95 |
| 피로b | 50 | 5 |
| 오한 | 30 | 0.5 |
| 말초 부종c | 22 | 0 |
| 위장관 | ||
| 메스꺼움 | 40 | 1.5 |
| 변비 | 27 | 0 |
| 구토 | 27 | 1.5 |
| 설사 | 26 | 2.93 |
| 피부 및 피하 조직 | ||
| 발진d | 40 | 2.4 |
| 신경계 | ||
| 두통 | 30 | 1.5 |
| 혈관 | ||
| 출혈e | 29 | 4.4 |
| 호흡기계 | ||
| 기침f | 29 | 0 |
| 근골격계 및 결합 조직 | ||
| 근육통g | 24 | 0.5 |
| 관절통 | 23 | 0.5 |
다브라페닙과 병용하여 MEKINIST를 투여받은 환자의 20% 미만에서 관찰된 MEKINIST의 임상적으로 관련된 유해 반응은 다음과 같습니다. 말초 신경병증(9%), 박출 분율 감소(8%), 방실 블록(2.9%), 포도막염(1.9%), 과민 반응(1.9%).
표 15는 연구 BRF117019의 실험실 이상을 요약한 것입니다.
| 약어: ALT, 알라닌 아미노 전이효소; AST, 아스파르트산 아미노 전이효소. a율을 계산하는 데 사용된 분모는 기준선 값과 적어도 하나의 치료 후 값이 있는 환자 수에 따라 199에서 202까지 다양했습니다. |
||
| 실험실 이상 | MEKINIST plus Dabrafeniba | |
| 모든 등급 (%) |
3등급 또는 4등급 (%) |
|
| 화학 | ||
| 고혈당증 | 61 | 8 |
| 나트륨 감소 | 35 | 10 |
| 마그네슘 감소 | 24 | 0 |
| 크레아티닌 증가 | 21 | 1.5 |
| 간 | ||
| 알칼리성 인산 가수분해효소 증가 | 51 | 5 |
| AST 증가 | 51 | 4.6 |
| ALT 증가 | 39 | 3 |
| 혈액학 | ||
| 헤모글로빈 감소 | 44 | 9 |
소아 환자의 BRAF V600E 돌연변이 양성 고형 종양
연구 CTMT212X2101 (X2101)
다브라페닙과 함께 투여했을 때 MEKINIST의 안전성은 X2101 연구에서 평가되었으며, 이 연구는 난치성 또는 재발성 고형 종양 활성화가 있는 소아 환자(n = 48)를 대상으로 한 다기관, 공개 라벨, 다코호트 연구입니다. [임상 연구(14.6) 참조]. C 부분(용량 증량) 및 D 부분(코호트 확장)에서 MEKINIST에 대한 노출 기간 중앙값은 각각 20.8개월과 24.4개월이었습니다. C 부분 및 D 부분에서 다브라페닙에 대한 노출 기간 중앙값은 각각 20.8개월과 24.9개월이었습니다. 다브라페닙과 함께 MEKINIST를 투여받은 소아 환자의 중앙값 연령은 9세(범위: 1~17)였습니다.
다브라페닙과 함께 MEKINIST를 투여받은 환자의 46%에서 심각한 이상 반응이 발생했습니다. 5% 이상의 환자에서 발생한 심각한 이상 반응에는 발열(25%) 및 박출 분율 감소(6%)가 포함되었습니다. 이상 반응으로 인해 영구적으로 치료를 중단한 환자는 21%였습니다. 3% 이상의 환자에서 영구적으로 치료를 중단하게 된 이상 반응에는 ALT 증가(6%), AST 증가(4.2%) 및 박출 분율 감소(4.2%)가 포함되었습니다. 이상 반응으로 인해 치료를 중단한 환자는 73%였습니다. 5% 이상의 환자에서 치료 중단을 요구한 이상 반응에는 발열(56%), 구토(19%), 호중구 감소증(13%), 발진(13%), 박출 분율 감소(6%) 및 포도막염(6%)이 포함되었습니다. 이상 반응으로 인해 용량을 감소시킨 환자는 25%였습니다. 5% 이상의 환자에서 용량 감소를 요구한 이상 반응에는 발열(13%)이 포함되었습니다.
실험실 이상을 포함한 가장 흔한(≥ 20%) 이상 반응은 표 16 및 표 17에 나열되어 있습니다.
표 16은 X2101 연구의 이상 반응을 요약한 것입니다.
| aNCI CTCAE 버전 4.0. b피로, 무력증 및 권태감 포함. c발진, 구진성 발진, 홍반성 발진, 구진성 발진, 농포성 발진 및 반점성 발진 포함. d여드름 모양 피부염 및 여드름 포함. e복통 및 상복부 통증 포함. f코피, 혈뇨, 타박상, 혈종, 자반, 직장 출혈 및 적혈구 수 감소 포함. |
||
| 이상 반응 | MEKINIST와 다브라페닙a (N = 48) |
|
| 모든 등급 (%) |
3등급 또는 4등급 (%) |
|
| 일반 | ||
| 발열 | 75 | 17 |
| 피로b | 48 | 0 |
| 피부 및 피하 조직 | ||
| 발진c | 73 | 2.1 |
| 건조한 피부 | 48 | 0 |
| 여드름 모양 피부염d | 40 | 0 |
| 위장 | ||
| 구토 | 52 | 4.2 |
| 설사 | 42 | 2.1 |
| 복통e | 33 | 4.2 |
| 메스꺼움 | 33 | 2.1 |
| 변비 | 23 | 0 |
| 호흡기계 | ||
| 기침 | 44 | 0 |
| 신경계 | ||
| 두통 | 35 | 0 |
| 혈관 | ||
| 출혈f | 33 | 0 |
| 감염 및 기생충 감염 | ||
| 손톱 주위염 | 23 | 0 |
MEKINIST와 다브라페닙 병용 투여를 받은 환자(N=48) 중 20% 미만에서 관찰된 MEKINIST의 임상적으로 관련된 유해 반응은 다음과 같습니다: 심방 세동(2.1%).
표 17은 연구 X2101의 실험실 이상을 요약한 것입니다.
| 약어: ALT, 알라닌 아미노 전이효소; AST, 아스파르트산 아미노 전이효소. a율을 계산하는 데 사용된 분모는 기준선 값과 적어도 하나의 치료 후 값이 있는 환자 수에 따라 39에서 48까지 다양했습니다. |
||
| 실험실 이상 | MEKINIST와 다브라페닙a | |
| 모든 등급 (%) |
3등급 또는 4등급 (%) |
|
| 화학 | ||
| 고혈당증 | 65 | 2.2 |
| 저알부민혈증 | 48 | 2.1 |
| 저칼슘혈증 | 40 | 2.1 |
| 인 감소 | 38 | 0 |
| 마그네슘 감소 | 33 | 2.1 |
| 고나트륨혈증 | 27 | 0 |
| 저칼륨혈증 | 21 | 2.1 |
| 간 | ||
| AST 증가 | 55 | 4.2 |
| ALT 증가 | 40 | 6 |
| 알칼리성 포스파타제 증가 | 28 | 6 |
| 총 빌리루빈 증가 | 21 | 2.1 |
| 혈액학 | ||
| 헤모글로빈 감소 | 60 | 6 |
| 호중구 감소 | 49 | 28 |
소아 환자의 BRAF V600E 돌연변이 양성 저등급 교모세포종
연구 CDRB436G2201 (G2201)
MEKINIST와 다브라페닙 병용 요법의 안전성은 연구 G2201에서 1세 이상 < 18세 소아 환자를 대상으로 평가되었습니다. 첫 번째 전신 치료가 필요한 저등급 교모세포종(LGG) 환자는 MEKINIST와 다브라페닙(n = 73) 또는 카보플라틴과 빈크리스틴(n = 33)으로 무작위 배정(2:1)되었습니다. 카보플라틴과 빈크리스틴 군에서 9명의 환자가 MEKINIST와 다브라페닙 군으로 교차되었습니다. 소아 환자는 질병 진행 또는 불내성 독성이 나타날 때까지 다브라페닙과 병용하여 매일 1회 경구로 체중 기반 MEKINIST를 투여받았습니다. 대조군 환자는 10주 유도 과정에서 각각 175 mg/m2 및 1.5 mg/m2의 용량으로 카보플라틴과 빈크리스틴을 투여받았으며, 이후 8회의 6주 유지 요법을 시행하거나 질병 진행 또는 불내성 독성이 나타날 때까지 투여했습니다. 저등급 교모세포종 환자 중 MEKINIST와 다브라페닙으로 무작위 배정된 환자(n = 73)의 경우 95%가 6개월 이상, 71%가 1년 이상 노출되었습니다.
이러한 환자의 중간 연령은 10세(범위: 1~17세)였으며, 여성이 60%, 백인이 75%, 아시아인이 7%, 흑인 또는 아프리카계 미국인이 2.7%, 기타 인종이 4%, 인종이 알 수 없거나 보고되지 않은 경우가 11%였습니다.
이러한 환자의 40%에서 중대한 유해 반응이 발생했습니다. 환자의 3% 이상에서 발생한 중대한 유해 반응에는 발열(14%)과 구토(4%)가 포함되었습니다.
유해 반응으로 인해 MEKINIST를 영구적으로 중단한 환자는 4%였습니다. MEKINIST의 영구적인 중단으로 이어진 유해 반응에는 오한, 피로, 발열, 체중 증가, 두통이 포함되었습니다.
유해 반응으로 인해 MEKINIST 투여를 중단한 환자는 70%였습니다. 환자의 5% 이상에서 투여 중단을 요구한 유해 반응에는 발열(52%)이 포함되었습니다.
유해 반응으로 인해 MEKINIST 용량을 감소시킨 환자는 12%였습니다. 환자의 2% 이상에서 용량 감소를 요구한 유해 반응에는 체중 증가(2.7%)가 포함되었습니다.
가장 흔한(≥ 15%) 유해 반응은 발열(68%), 발진(51%), 두통(47%), 구토(34%), 근골격계 통증(34%), 피로(33%), 설사(29%), 건조한 피부(26%), 메스꺼움(25%), 출혈(25%), 복통(25%), 여드름 모양 피부염(22%), 현기증(15%), 상기도 감염(15%), 체중 증가(15%)였습니다.
기준선에서 악화된 가장 흔한(≥ 20%) 실험실 이상은 백혈구 감소증(59%), 알칼리성 포스파타제 증가(55%), 빈혈(46%), 호중구 감소증(44%), AST 증가(37%), 마그네슘 감소(34%), 마그네슘 증가(32%), 혈소판 감소증(30%), ALT 증가(29%), 림프구 증가(24%)였습니다.
표 18은 연구 G2201에서 발생한 유해 반응을 요약한 것입니다.
| aNCI CTCAE 버전 4.03. b설사, 대장염, 장염 및 장염 포함. c복통 및 상복부 통증 포함. d구내염, 구순염, 구강 궤양, 아프타성 궤양 및 설염 포함. e발열 및 체온 상승 포함. f피로 및 무력증 포함. g두통 및 편두통(오라 동반) 포함. h현기증 및 어지럼증 포함. i말초 신경병증, 말초 운동 신경병증, 말초 감각 운동 신경병증, 감각 이상, 신경통, 감각 저하 및 말초 감각 신경병증 포함. j코피, 시술 후 출혈, 혈뇨, 상부 위장관 출혈 및 두개내 출혈 포함. k발진, 반점 모양 발진, 반점 구진 모양 발진, 농포성 발진, 구진 모양 발진, 홍반성 발진, 습진, 다형성 홍반, 피부염, 박탈성 피부염, 피부 박리, 손바닥-발바닥 홍반 각화증 증후군 및 수포성 피부염 포함. l여드름 모양 피부염, 여드름 및 농포성 여드름 포함. m요통, 근육통, 사지 통증, 관절통, 뼈 통증, 비심장성 흉통, 목 통증 및 근골격계 경직 포함. |
||||
| 유해 반응 | MEKINIST와 다브라페닙 병용 N = 73 |
카보플라틴과 빈크리스틴 병용 N = 33 |
||
| 모든 등급 (%) |
등급 ≥ 3 (%) |
모든 등급 (%) |
등급 ≥ 3 (%) |
|
| 위장관 | ||||
| 구토 | 34 | 1 | 48 | 3 |
| 설사b | 29 | 0 | 18 | 6 |
| 메스꺼움 | 25 | 0 | 45 | 0 |
| 복통c | 25 | 0 | 24 | 0 |
| 변비 | 12 | 0 | 36 | 0 |
| 구내염d | 10 | 0 | 18 | 0 |
| 일반 | ||||
| 발열e | 68 | 8 | 18 | 3 |
| 피로f | 33 | 0 | 39 | 0 |
| 신경계 | ||||
| 두통g | 47 | 1 | 33 | 3 |
| 현기증h | 15 | 0 | 9 | 3 |
| 말초 신경병증i | 7 | 0 | 45 | 6 |
| 혈관 | ||||
| 출혈j | 25 | 0 | 12 | 0 |
| 피부 및 피하 조직 | ||||
| 발진k | 51 | 2.7 | 18 | 3 |
| 건조한 피부 | 26 | 0 | 3 | 0 |
| 여드름성 피부염l | 22 | 0 | 0 | 0 |
| 탈모 | 3 | 0 | 24 | 0 |
| 근골격계 및 결합 조직 | ||||
| 근골격계 통증m | 34 | 0 | 30 | 0 |
| 턱 통증 | 1.4 | 0 | 18 | 0 |
| 신진대사 및 영양 | ||||
| 식욕 감소 | 5 | 0 | 24 | 0 |
| 호흡기, 흉곽 및 종격 | ||||
| 인후통 | 11 | 0 | 18 | 0 |
| 정신 | ||||
| 불안 | 1.4 | 0 | 15 | 3 |
| 면역 체계 | ||||
| 과민 반응 | 0 | 0 | 15 | 3 |
| 감염 및 기생충 감염 | ||||
| 상기도 감염 | 15 | 0 | 6 | 0 |
| 손상, 중독 및 절차적 합병증 | ||||
| 주입 관련 반응 | 0 | 0 | 15 | 3 |
| 검사 | ||||
| 체중 증가 | 15 | 7 | 0 | 0 |
표 19는 연구 G2201에서의 실험실 이상을 요약합니다.
| 약어: ALT, 알라닌 아미노트랜스퍼라제; AST, 아스파르테이트 아미노트랜스퍼라제. a기준선 값과 적어도 하나의 치료 후 값이 있는 환자 수에 따라 D + T 군에서 70~73, C + V 군에서 9~33으로 달라지는 분모를 사용하여 비율을 계산했습니다. |
||||
| 실험실 이상 | MEKINIST plus Dabrafenib N = 73 |
Carboplatin plus Vincristine N = 33 |
||
| 모든 등급 (%) |
3등급 또는 4등급 (%) |
모든 등급 (%) |
3등급 또는 4등급 (%) |
|
| 간 | ||||
| 알칼리성 포스파타제 증가 | 55 | 0 | 13 | 0 |
| AST 증가 | 37 | 1.4 | 55 | 0 |
| ALT 증가 | 29 | 3 | 61 | 9 |
| 화학 | ||||
| 마그네슘 감소 | 34 | 4.1 | 76 | 6 |
| 마그네슘 증가 | 32 | 0 | 24 | 3 |
| 칼륨 증가 | 15 | 4.2 | 21 | 6 |
| 칼슘 감소 | 14 | 4.1 | 22 | 9 |
| 칼륨 감소 | 8 | 1.4 | 70 | 0 |
| 인산염 감소 | 7 | 2.7 | 33 | 3 |
| 나트륨 감소 | 5 | 1.4 | 27 | 6 |
| 혈청 공복 혈당 증가 | 0 | 0 | 44 | 0 |
| 혈액학 | ||||
| 백혈구 감소 | 59 | 0 | 91 | 18 |
| 헤모글로빈 감소 | 46 | 0 | 94 | 36 |
| 호중구 감소 | 44 | 17 | 84 | 75 |
| 혈소판 감소 | 30 | 0 | 73 | 18 |
| 림프구 증가 | 24 | 0 | 13 | 3.1 |
| 림프구 감소 | 16 | 1.4 | 56 | 6 |
6.2
시판 후 경험
다브라페닙과 병용하여 MEKINIST를 사용한 후 시판 후에 다음과 같은 유해 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되었기 때문에 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립하는 것이 항상 가능한 것은 아닙니다.
심장: 심방 심실 블록 완전 차단. 이러한 유해 반응은 MEKINIST 단독 요법에서도 관찰되었습니다.
면역 체계: 혈구 탐식성 림프조직구증 (HLH) [경고 및 주의 사항 (5.12) 참조]
피부 및 피하 조직: SCAR (DRESS 및 SJS 포함) [경고 및 주의 사항 (5.9) 참조]
7 약물 상호작용
MEKINIST는 다브라페닙과 병용하여 사용하는 것이 적응증입니다. 병용 치료에 적용되는 추가적인 위험 정보는 다브라페닙 처방 정보를 참조하십시오.
8 특정 집단에서의 사용
8.1
임신
위험 요약
작용 기전 [임상 약리학 (12.1) 참조] 및 동물 생식 연구 결과를 바탕으로 MEKINIST는 임산부에게 투여하면 태아에게 해를 끼칠 수 있습니다. MEKINIST에 노출된 임산부에 대한 데이터가 충분하지 않아 위험을 평가할 수 없습니다. 트라메티닙은 토끼에서 권장 성인 임상 용량의 약 0.3배에 해당하는 노출을 초래하는 용량 이상에서 배아 독성 및 유산을 유발했습니다. (데이터 참조). 임산부에게 태아에 대한 잠재적 위험을 알려야 합니다.
미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%에서 4% 및 15%에서 20%입니다.
데이터
동물 데이터
생식 독성 연구에서 트라메티닙을 기관 형성 기간 동안 랫트에 투여한 결과, AUC(곡선 아래 면적) 기준으로 권장 성인 용량의 약 0.3배에 해당하는 노출을 초래하는 용량 이상에서 태아 체중이 감소했습니다. 랫트에서 권장 성인 용량의 약 1.8배에 해당하는 노출을 초래하는 용량에서 모체 독성과 착상 후 손실 증가가 나타났습니다.
임신한 토끼에서 트라메티닙을 기관 형성 기간 동안 투여한 결과, AUC 기준으로 권장 성인 용량의 약 0.08배에 해당하는 용량 이상에서 태아 체중이 감소하고 골화 변화 발생률이 증가했습니다. 트라메티닙을 0.15 mg/kg/day(AUC 기준으로 권장 성인 용량의 약 0.3배에 해당) 투여한 토끼에서 대조군 동물과 비교하여 착상 후 손실(임신 완전 손실 포함)이 증가했습니다.
8.2
수유
위험 요약
모유에서 트라메티닙의 존재 또는 트라메티닙이 모유 수유 아기 또는 모유 생산에 미치는 영향에 대한 데이터가 없습니다. 모유 수유 아기에게 심각한 부작용이 발생할 가능성이 있으므로 MEKINIST 치료 중 및 마지막 투여 후 4개월 동안은 모유 수유를 하지 않도록 여성에게 조언해야 합니다.
8.3
생식 가능 여성 및 남성
임신 검사
MEKINIST 치료를 시작하기 전에 생식 가능 여성의 임신 여부를 확인하십시오.
피임
동물 연구 데이터와 작용 기전을 바탕으로 MEKINIST는 임산부에게 투여하면 태아에게 해를 끼칠 수 있습니다. [특정 인구에 대한 사용 (8.1) 참조].
여성
생식 가능 여성 환자에게 MEKINIST 치료 중 및 마지막 투여 후 4개월 동안 효과적인 피임법을 사용하도록 조언하십시오.
남성
임신한 파트너 및 생식 가능 여성 파트너에게 약물 노출 가능성을 피하기 위해 생식 가능 여성 파트너가 있는 남성 환자(정관 수술을 받은 환자 포함)에게 MEKINIST 치료 중 및 마지막 투여 후 4개월 동안 콘돔을 사용하도록 조언하십시오.
불임
여성
생식 가능 여성 환자에게 MEKINIST가 생식 능력을 손상시킬 수 있다고 조언하십시오. 랫트 암컷에서 권장 성인 용량의 0.3배에 해당하는 노출과 동일한 용량에서 난포낭 증가와 황체 감소가 관찰되었습니다. [비임상 독성학 (13.1) 참조].
8.4
소아 사용
BRAF V600E 돌연변이 양성 절제 불가능 또는 전이성 고형 종양 및 LGG
MEKINIST와 다브라페닙 병용 요법의 안전성 및 유효성은 이전 치료 후 진행되었고 만족스러운 대체 치료 옵션이 없는 BRAF V600E 돌연변이 양성 절제 불가능 또는 전이성 고형 종양이 있는 1세 이상 소아 환자 또는 전신 치료가 필요한 BRAF V600E 돌연변이 양성 LGG가 있는 소아 환자에서 확립되었습니다. 이러한 적응증에 대한 MEKINIST와 다브라페닙 병용 요법의 사용은 BRAF V600 돌연변이 양성 진행성 고형 종양이 있는 171명의 환자(1세에서 18세 미만)를 등록한 X2101 및 G2201 연구에서 얻은 증거에 의해 뒷받침됩니다. 이 중 4명(2.3%)의 환자가 1세에서 2세 미만이었고, 39명(23%)의 환자가 2세에서 6세 미만이었고, 54명(32%)의 환자가 6세에서 12세 미만이었고, 74명(43%)의 환자가 12세에서 18세 미만이었습니다. [부작용 (6.1), 임상 약리학 (12.3), 임상 연구 (14.6, 14.7) 참조].
MEKINIST와 다브라페닙 병용 요법의 안전성 및 유효성은 1세 미만 소아 환자에서 이러한 적응증에 대해 확립되지 않았습니다.
단독 요법으로 사용되는 MEKINIST의 안전성 및 유효성은 소아 환자에서 확립되지 않았습니다.
어린 동물 독성 데이터
어린 랫트에서 반복 투여 독성 연구에서 AUC 기준으로 권장 성인 용량의 0.3배에 해당하는 노출만큼 낮은 용량에서 뼈 길이 감소와 각막 이영양증이 관찰되었습니다. 또한 AUC 기준으로 권장 성인 용량의 1.6배에 해당하는 노출만큼 낮은 용량에서 성적 성숙 지연이 관찰되었습니다.
8.5
노인 사용
METRIC 연구에서 단독 요법으로 MEKINIST를 투여받은 흑색종 환자 214명 중 27%가 65세 이상이었고 4%가 75세 이상이었습니다. [임상 연구 (14.1) 참조]. 흑색종에서 단독 요법으로 MEKINIST를 투여한 이 연구에는 노인 환자가 충분하지 않아 노인 환자가 젊은 성인과 다르게 반응하는지 여부를 확인할 수 없었습니다.
COMBI-d, COMBI-v, 및 COMBI-AD 연구에서 다브라페닙과 함께 MEKINIST를 투여받은 멜라노마 환자 994명 중 21%가 65세 이상이었고 5%가 75세 이상이었습니다. [임상 연구(14.1, 14.2) 참조] 이러한 멜라노마 연구에서 노인 환자는 젊은 성인과 비교하여 MEKINIST와 다브라페닙의 효과에 전반적인 차이가 관찰되지 않았습니다. 이러한 연구에서 노인 환자는 젊은 성인과 비교하여 말초 부종(26% 대 12%) 및 식욕 부진(21% 대 9%)의 발생률이 증가했습니다.
연구 BRF113928에서 MEKINIST를 투여받은 NSCLC 환자 93명 중 65세 이상 노인 환자 수가 충분하지 않아 젊은 성인과 다르게 반응하는지 여부를 확인할 수 없었습니다. [임상 연구(14.4) 참조]
연구 BRF117019에서 MEKINIST를 투여받은 ATC 환자 26명 중 77%가 65세 이상이었고 31%가 75세 이상이었습니다. [임상 연구(14.4) 참조] 이 ATC 연구에는 젊은 성인이 충분하지 않아 노인 환자와 다르게 반응하는지 여부를 확인할 수 없었습니다.
8.6
간 기능 장애
경증(빌리루빈 ≤ 정상 상한(ULN) 및 아스파르테이트 아미노트랜스퍼라제(AST) > ULN 또는 빌리루빈 > ULN의 1배에서 1.5배 및 AST 임의) 간 기능 장애 환자의 경우 용량 조절을 권장하지 않습니다.
중등도(빌리루빈 > ULN의 1.5배에서 3배 및 AST 임의) 또는 중증(빌리루빈 > ULN의 3배에서 10배 및 AST 임의) 간 기능 장애 환자의 경우 MEKINIST의 권장 용량이 확립되지 않았습니다. 중등도 또는 중증 간 기능 장애 환자에게 MEKINIST를 투여할지 여부를 결정하기 전에 MEKINIST의 용량과 관련된 위험-이점 프로파일을 고려하십시오.
중등도 간 기능 장애 환자의 경우 1일 1회 경구로 1.5mg의 시작 용량을 투여받은 환자 3명과 1일 1회 경구로 2mg의 시작 용량을 투여받은 환자 2명은 치료 첫 주기에 용량 제한 독성(DLT)을 경험하지 않았습니다.
중증 간 기능 장애 환자의 경우 1일 1회 경구로 1mg의 시작 용량을 투여받은 환자 3명은 치료 첫 주기에 DLT를 경험하지 않았습니다. 1일 1회 경구로 1.5mg의 시작 용량을 투여받은 환자 1명은 DLT(3등급 여드름형 발진)를 경험했습니다.
정상 간 기능 환자와 비교하여 중등도 또는 중증 간 기능 장애 환자의 경우 트라메티닙의 노출이 증가하지 않았습니다. [임상 약리학(12.3) 참조]
10 과다 복용
임상 시험에서 평가된 MEKINIST의 최고 용량은 1일 1회 경구 투여 4mg과 2일 연속 1일 1회 경구 투여 10mg, 그 후 1일 1회 3mg이었습니다. 이 두 가지 투약 일정 중 하나로 치료받은 7명의 환자 중 2명에게 RPED가 발생하여 발생률은 28%였습니다.
트라메티닙은 혈장 단백질에 고도로 결합되어 있으므로 혈액 투석은 MEKINIST 과량 복용 치료에 효과적이지 않을 가능성이 높습니다.
11 설명
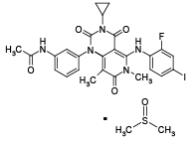
트라메티닙 디메틸 술폭사이드는 키나아제 억제제입니다. 화학명은 아세트아미드, N-[3-[3-시클로프로필-5-[(2-플루오로-4-요오드페닐)아미노]-3,4,6,7-테트라히드로-6,8-디메틸-2,4,7-트리옥소피리도[4,3-d]피리미딘-1(2H)-일]페닐]-, 1,1′-술피닐비스[메탄]과의 화합물(1:1)입니다. 분자식은 C26H23FIN5O4•C2H6OS이며 분자량은 693.53 g/mol입니다. 트라메티닙 디메틸 술폭사이드는 다음과 같은 화학 구조를 가지고 있습니다.
트라메티닙 디메틸 술폭사이드는 백색에서 거의 백색의 분말입니다. 수성 매질에서 pH 2~8 범위에서 실질적으로 불용성입니다.
MEKINIST(트라메티닙) 경구용 정제는 경구 투여를 위한 0.5mg 및 2mg 정제로 제공됩니다. 각 0.5mg 정제는 트라메티닙 비용매화된 모체 0.5mg에 해당하는 트라메티닙 디메틸 술폭사이드 0.5635mg을 함유하고 있습니다. 각 2mg 정제는 트라메티닙 비용매화된 모체 2mg에 해당하는 트라메티닙 디메틸 술폭사이드 2.254mg을 함유하고 있습니다.
MEKINIST 정제의 비활성 성분은 다음과 같습니다. 정제 코어: 콜로이드성 실리카, 크로스카멜로스나트륨, 히프로멜로스, 마그네슘 스테아레이트(식물성), 만니톨, 미결정 셀룰로스, 라우릴황산나트륨. 코팅: 히프로멜로스, 적색 산화철(2mg 정제), 황색 산화철(0.5mg 정제), 폴리에틸렌 글리콜, 폴리소르베이트 80(2mg 정제), 이산화티타늄.
MEKINIST(트라메티닙) 경구용 용액은 백색 또는 거의 백색의 분말로, 물에 재구성하면 투명한 무색 용액이 생성됩니다. 각 병은 트라메티닙 디메틸 술폭사이드 5.3mg에 해당하는 트라메티닙 4.7mg을 함유하고 있습니다. 재구성된 트라메티닙 용액 1mL는 트라메티닙 비용매화된 모체 0.05mg을 함유하고 있습니다. MEKINIST 경구용 용액의 비활성 성분은 베타덱스 술포부틸 에터 나트륨, 구연산 일수화물, 인산이수소나트륨, 메틸파라벤, 소르빈산칼륨, 수크랄로스, 딸기향입니다.
12 임상약리학
12.1
작용 기전
트라메티닙은 미토겐 활성화 세포 외 신호 조절 키나아제 1(MEK1) 및 MEK2 활성화와 MEK1 및 MEK2 키나아제 활성의 가역적 억제제입니다. MEK 단백질은 세포 증식을 촉진하는 세포 외 신호 조절 키나아제(ERK) 경로의 상위 조절자입니다. BRAF V600E 돌연변이는 MEK1 및 MEK2를 포함하는 BRAF 경로의 구성적 활성화를 초래합니다. 트라메티닙은 다양한 BRAF V600 돌연변이 양성 종양의 in vitro 및 in vivo에서 세포 성장을 억제합니다.
트라메티닙과 다브라페닙은 RAS/RAF/MEK/ERK 경로의 두 가지 다른 키나아제를 표적으로 합니다. 트라메티닙과 다브라페닙의 병용은 in vitro에서 BRAF V600 돌연변이 양성 종양 세포주에서 더 큰 성장 억제를 초래했으며, BRAF V600 돌연변이 양성 종양 이종 이식편에서 단독으로 사용한 경우보다 종양 성장 억제를 연장했습니다.
BRAF 돌연변이 대장암의 경우 EGFR 매개 MAPK 경로 재활성화 유도가 BRAF 억제제에 대한 내재적 내성의 메커니즘으로 확인되었습니다 [적응증 및 사용법(1.7) 참조].
12.2
약력학
BRAF V600 돌연변이 양성 흑색종 환자에게 MEKINIST 정제 1mg 및 2mg을 투여한 결과, 인산화된 ERK 억제, Ki67(세포 증식 마커) 억제 및 p27(세포 사멸 마커) 증가를 포함한 종양 생체 지표의 용량 의존적 변화가 나타났습니다.
심장 전기 생리학
트라메티닙의 심박수 보정 QT(QTc) 연장 가능성은 1일에 위약을 투여받고 2-14일에 MEKINIST 정제 2mg을 1일 1회 투여한 후 15일에 MEKINIST 정제 3mg을 투여받은 32명의 환자를 대상으로 한 전용 연구에서 평가되었습니다. 연구에서 평균 QTc 간격(즉, > 20ms)의 큰 변화는 발견되지 않았습니다.
동일한 연구에서 위약에 비해 투여 후 2시간에 HR이 기준선에서 9회/분(90% CI: -11.4~ -6.1) 감소하고 PR이 기준선에서 20ms(90% CI: 13.0~27.4) 증가하는 것으로 나타났습니다.
다브라페닙과 함께 MEKINIST를 투여받은 환자를 대상으로 한 임상 시험에서 QTc 연장 > 500ms가 환자의 0.8%에서 발생했고 QTc가 기준선에서 > 60ms 증가한 경우는 환자의 3.8%였습니다.
12.3
약동학
트라메티닙의 약동학은 고형 종양 및 BRAF V600 돌연변이 양성 전이성 흑색종 환자에서 단일 용량 및 다중 용량 투여 후에 특성화되었습니다. MEKINIST 정제 0.125mg(승인된 권장 성인 용량의 0.0625배)에서 4mg(승인된 권장 성인 용량의 2배)을 매일 투여한 후 Cmax와 AUC 모두 용량에 비례하여 증가합니다. 정상 상태에서 AUC와 Cmax의 개인 간 변동성은 각각 22%와 28%입니다.
흡수
최고 혈장 농도에 도달하는 데 걸리는 중간 시간(Tmax)은 투여 후 1.5시간입니다. MEKINIST 정제의 평균 절대 생체 이용률은 72%이고, 경구 용액용 MEKINIST는 81%입니다.
음식의 영향
MEKINIST 정제 투여 후 고지방, 고칼로리 식사(약 1000칼로리)는 공복 상태에 비해 트라메티닙 AUC를 24%, Cmax를 70% 감소시키고 Tmax를 약 4시간 지연시켰습니다.
분포
트라메티닙은 인간 혈장 단백질에 97.4% 결합합니다. 명백한 분포 용적(Vc/F)은 214L입니다.
배설
추정 배설 반감기는 3.9~4.8일입니다. 명백한 청소율은 4.9L/h입니다.
대사
트라메티닙은 in vitro에서 단독으로 또는 모노-산소화와 함께 또는 글루쿠론화 생체 변환 경로와 함께 탈아세틸화를 통해 주로 대사됩니다. 탈아세틸화는 카르복실 에스터라아제(즉, 카르복실 에스터라아제 1b/c 및 2)에 의해 매개되며, 다른 가수 분해 효소에 의해 매개될 수도 있습니다.
[14C]-트라메티닙을 단일 용량 투여한 후 순환 방사능의 약 50%가 모체 화합물로 나타납니다. 그러나 트라메티닙을 반복 투여한 후 대사체 프로파일링에 따르면 혈장에서 약물 관련 물질의 ≥ 75%가 모체 화합물입니다.
배설
[14C]-트라메티닙을 경구 투여한 후 배설된 방사능의 80% 이상이 대변에서 회수되었고, 배설된 방사능의 20% 미만이 소변에서 회수되었으며, 배설된 용량의 0.1% 미만이 모체로 회수되었습니다.
특정 인구 집단
연령(18~93세), 성별, 체중(36~170kg) 및 신장 장애(eGFR 15~89mL/분/1.73m2)는 트라메티닙 노출에 임상적으로 유의미한 영향을 미치지 않습니다. 인종 또는 민족에 따른 트라메티닙 노출의 잠재적 차이를 평가할 수 있는 데이터가 충분하지 않습니다.
소아 환자: 트라메티닙의 약동학은 단일 용량 또는 다중 용량 투여 후 1~<18세의 뇌종양 및 기타 고형 종양 환자 244명에서 평가되었습니다. 1~<18세 환자의 약동학적 매개변수는 체중 기반으로 동일한 용량을 투여받은 성인에서 이전에 관찰된 값 범위 내에 있습니다. 이 인구 집단에서 트라메티닙 경구 청소율에 체중(6~156kg)이 통계적으로 유의미한 영향을 미치는 것으로 나타났습니다.
간 기능 장애 환자: 간 기능 장애(빌리루빈 및 AST 수치로 정의)는 정상 간 기능을 가진 환자에 비해 트라메티닙 노출 또는 명백한 약물 청소율에 유의미한 영향을 미치지 않았습니다.
약물 상호 작용 연구
다브라페닙의 트라메티닙에 대한 영향: MEKINIST 정제 2mg을 매일 다브라페닙과 함께 투여하면 트라메티닙의 AUC가 변하지 않았습니다.
트라메티닙의 CYP 기질에 대한 영향: MEKINIST 정제 2mg을 1일 1회 민감한 CYP3A4 기질과 함께 투여하면 민감한 CYP3A4 기질의 AUC와 Cmax에 임상적으로 관련된 영향을 미치지 않았습니다.
in vitro 연구에 따르면 트라메티닙은 CYP2C8의 억제제이지만, 임상적으로 관련된 전신 농도에서 CYP1A2, CYP2A6, CYP2B6, CYP2C9, CYP2C19 또는 CYP2D6의 억제제가 아닙니다.
수송체의 트라메티닙에 대한 영향: 트라메티닙은 P-당단백질(P-gp) 및 BSEP의 기질입니다. 트라메티닙은 높은 수동 투과성과 생체 이용률을 나타내므로 P-gp 억제는 트라메티닙 농도를 임상적으로 중요하게 증가시키지 않을 가능성이 높습니다. 트라메티닙은 in vitro에서 BCRP, OATP1B1, OATP1B3, OATP2B1, OCT1, MRP2 또는 MATE1의 기질이 아닙니다.
트라메티닙의 수송체에 대한 영향: in vitro 연구에 따르면 트라메티닙은 임상적으로 관련된 전신 농도에서 P-gp, BCRP, OATP1B1, OATP1B3, OAT1, OAT3, OCT2, BSEP, MRP2 또는 MATE1의 억제제가 아닙니다.
13 비임상 독성학
13.1
발암성, 돌연변이 유발성, 생식능력 저해
트라메티닙으로 발암성 연구는 수행되지 않았습니다. 트라메티닙은 박테리아에서 역돌연변이, 포유류 세포에서 염색체 이상, 랫드 골수에서 미세핵을 평가하는 연구에서 유전독성이 없었습니다.
트라메티닙은 사람의 생식능력을 저해할 수 있습니다. 최대 13주 동안 트라메티닙을 투여받은 암컷 랫드에서 AUC 기준 권장 성인 용량의 약 0.3배에 해당하는 0.016 mg/kg/일 이상의 용량에서 난포낭 증가 및 황체 감소가 관찰되었습니다. 최대 13주 동안 지속된 랫드 및 개 독성 연구에서 수컷 생식 조직에 대한 치료 효과는 관찰되지 않았습니다 [특정 인구 집단에서의 사용(8.3) 참조].
14 임상 연구
14.1
BRAF V600E 또는 V600K 돌연변이 양성 절제 불가능 또는 전이성 흑색종
단독 요법으로서의 MEKINIST
MEKINIST의 안전성 및 유효성은 BRAF V600E 또는 V600K 돌연변이 양성, 절제 불가능 또는 전이성 흑색종 환자 322명을 대상으로 한 국제적, 다기관, 무작위 배정(2:1), 공개, 활성 대조군 시험(METRIC 연구; NCT01245062)에서 평가되었습니다. METRIC 연구에서 환자는 진행성 또는 전이성 질환에 대한 이전 화학 요법 요법이 1개를 초과할 수 없었으며, BRAF 억제제 또는 MEK 억제제를 사전에 투여받은 경우는 허용되지 않았습니다. 환자는 MEKINIST 2mg을 1일 1회 경구 투여(N = 214) 또는 화학 요법(N = 108)을 무작위 배정받았으며, 화학 요법은 3주마다 다카바진 1000mg/m2를 정맥 주사하거나 3주마다 팍리탁셀 175mg/m2를 정맥 주사하는 것으로 구성되었습니다. 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 치료를 계속했습니다. 무작위 배정은 진행성 또는 전이성 질환에 대한 이전 화학 요법 사용(예 vs. 아니오) 및 LDH 수치(정상 vs. ULN 초과)에 따라 계층화되었습니다. 종양 조직은 임상 시험 분석을 사용하여 중앙 검사 기관에서 BRAF 돌연변이에 대해 평가했습니다. 289명의 환자(MEKINIST로 치료받은 환자 196명과 화학 요법으로 치료받은 환자 93명)의 종양 샘플은 FDA 승인 동반 진단 검사인 THxID®-BRAF 분석을 사용하여 회고적으로 검사했습니다. 주요 유효성 결과 측정은 무진행 생존(PFS)이었습니다.
무작위 배정된 환자의 중간 연령은 54세였으며, 54%가 남성이었고, 99% 이상이 백인이었으며, 모든 환자의 기준 ECOG 수행 상태는 0 또는 1이었습니다. 대부분의 환자는 전이성 질환(94%), M1c 질환(64%), LDH 상승(36%), 뇌 전이 병력 없음(97%), 진행성 또는 전이성 질환에 대한 이전 화학 요법을 받지 않음(66%)을 보였습니다. BRAF V600 돌연변이의 분포는 BRAF V600E(87%), V600K(12%) 또는 둘 다(1% 미만)였습니다. 대체 치료 시작 전 추적 관찰의 중간 기간은 MEKINIST로 치료받은 환자의 경우 4.9개월, 화학 요법으로 치료받은 환자의 경우 3.1개월이었습니다. 51명(47%)의 환자가 질병 진행 시 화학 요법 군에서 MEKINIST를 투여받기 위해 교차되었습니다.
METRIC 연구는 MEKINIST로 치료받은 환자에서 PFS가 통계적으로 유의하게 증가했음을 보여주었습니다. 표 20과 그림 1은 PFS 결과를 요약합니다.
| 약어: CI, 신뢰 구간; DoR, 반응 지속 기간; HR, 위험 비율; NR, 도달하지 않음. aPike 추정치. |
||
| 연구자–평가된 종말점 | MEKINIST N = 214 |
화학 요법 N = 108 |
| 무진행–생존 | ||
| 사건 수(%) | 117 (55%) | 77 (71%) |
| 진행성 질환 | 107 (50%) | 70 (65%) |
| 사망 | 10 (5%) | 7 (6%) |
| 중간값, 개월(95% CI) | 4.8 (4.3, 4.9) | 1.5 (1.4, 2.7) |
| HRa (95% CI) | 0.47 (0.34, 0.65) | |
| P 값(로그 순위 검정) | < 0.0001 | |
| 확인된 종양 반응 | ||
| 전반적인 반응률(95% CI) | 22% (17%, 28%) | 8% (4%, 15%) |
| 완전 반응, n (%) | 4 (2%) | 0 |
| 부분 반응, n (%) | 43 (20%) | 9 (8%) |
| 반응 지속 기간 | ||
| 중간 DoR, 개월(95% CI) | 5.5 (4.1, 5.9) | NR (3.5, NR) |
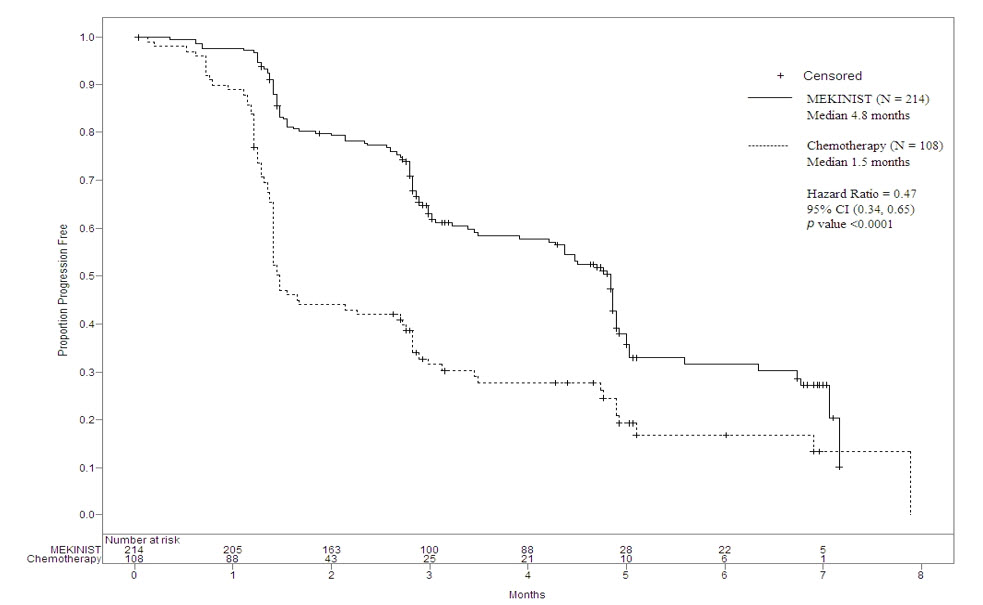
그림 1. METRIC 연구에서 평가자 평가 무진행 생존 (ITT 모집단)의 Kaplan-Meier 곡선
독립적인 방사선학 검토 위원회 (IRRC) 평가를 기반으로 한 지원 분석에서 PFS 결과는 1차 유효성 분석 결과와 일치했습니다.
다브라페닙과 함께 MEKINIST
COMBI-d 연구
다브라페닙과 함께 투여된 MEKINIST의 안전성 및 유효성은 국제적 무작위 배정, 이중맹검, 활성 대조군 시험(COMBI-d 연구; NCT01584648)에서 평가되었습니다. COMBI-d 연구는 절제 불가능(IIIc기) 또는 전이성(IV기) BRAF V600E 또는 V600K 돌연변이 양성 피부 흑색종 환자의 1차 치료제로 다브라페닙과 MEKINIST를 다브라페닙과 위약을 비교했습니다. 환자는 MEKINIST 2mg을 1일 1회와 다브라페닙 150mg을 1일 2회 또는 다브라페닙 150mg을 1일 2회와 일치하는 위약을 받도록 무작위 배정(1:1)되었습니다. 무작위 배정은 LDH 수준(> ULN 대 ≤ ULN)과 BRAF 돌연변이 아형(V600E 대 V600K)으로 계층화되었습니다. 주요 유효성 결과는 RECIST v1.1에 따른 평가자 평가 PFS였으며, 추가 유효성 결과 측정은 전체 생존율(OS)과 확인된 전체 반응률(ORR)이었습니다.
COMBI-d 연구에서 423명의 환자가 MEKINIST와 다브라페닙(n = 211) 또는 위약과 다브라페닙(n = 212)에 무작위 배정되었습니다. 중간 연령은 56세(범위: 22~89세)였으며, 53%가 남성이었고, 99% 이상이 백인이었으며, 72%가 ECOG 수행 상태가 0이었고, 4%가 IIIc기였으며, 66%가 M1c 질환이었고, 65%가 정상 LDH였으며, 2명의 환자가 뇌 전이 병력이 있었습니다. 모든 환자는 FDA 승인 동반 진단 검사로 중앙 집중식 검사를 통해 확인된 BRAF V600E 또는 V600K 돌연변이를 포함하는 종양을 가졌습니다. 85%는 BRAF V600E 돌연변이 양성 흑색종을 가졌고, 15%는 BRAF V600K 돌연변이 양성 흑색종을 가졌습니다.
COMBI-d 연구는 PFS와 OS에서 통계적으로 유의미한 개선을 보였습니다. 표 21과 그림 2는 유효성 결과를 요약합니다.
| 약어: CI, 신뢰 구간; DoR, 반응 지속 기간; HR, 위험 비율; NR, 도달하지 않음; ORR, 전체 반응률. aPFS와 ORR은 평가자에 의해 평가되었습니다. b계층화된 로그 랭크 검정 기반. |
||
| 종점 | MEKINIST 플러스 Dabrafenib N = 211 |
위약 플러스 Dabrafenib N = 212 |
| 무진행 생존a | ||
| 이벤트 수 (%) | 102 (48%) | 109 (51%) |
| 중간값, 개월(95% CI) | 9.3 (7.7, 11.1) | 8.8 (5.9, 10.9) |
| HR (95% CI) | 0.75 (0.57, 0.99) | |
| P 값b | 0.035 | |
| 전체 생존율 | ||
| 사망자 수 (%) | 99 (47%) | 123 (58%) |
| 중간값, 개월(95% CI) | 25.1 (19.2, NR) | 18.7 (15.2, 23.1) |
| HR (95% CI) | 0.71 (0.55, 0.92) | |
| P 값b | 0.01 | |
| 전체 반응률a | ||
| ORR (95% CI) | 66% (60%, 73%) | 51% (44%, 58%) |
| P 값 | < 0.001 | |
| 완전 반응 | 10% | 8% |
| 부분 반응 | 56% | 42% |
| 중간 DoR, 개월(95% CI) | 9.2 (7.4, NR) | 10.2 (7.5, NR) |
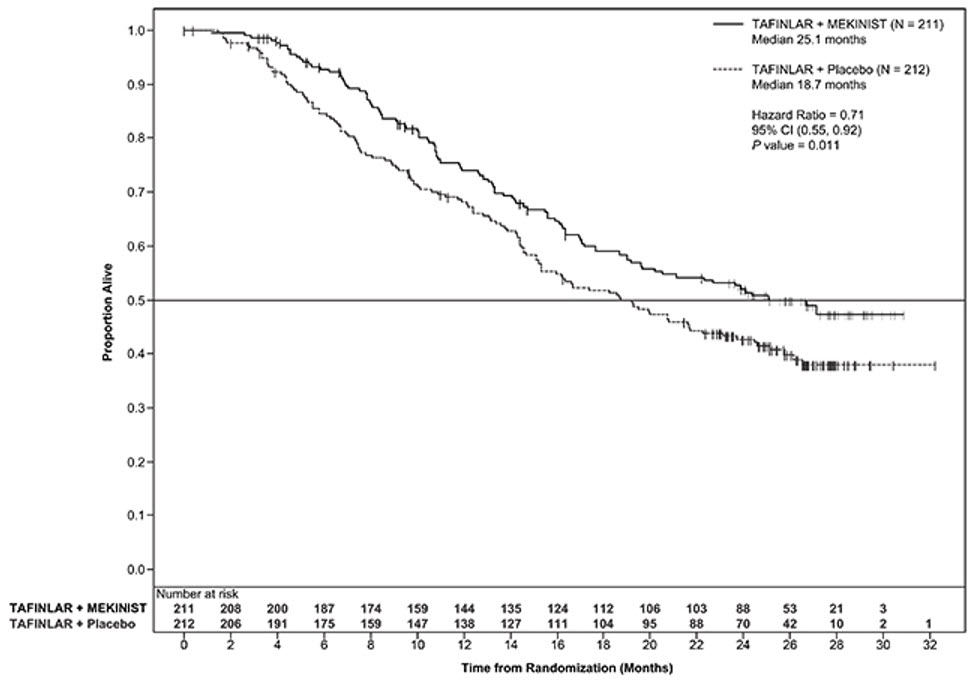
Figure 2. Kaplan-Meier Curves of Overall Survival in the COMBI-d Study
COMBI-MB 연구
MEKINIST와 dabrafenib의 뇌 전이 BRAF V600E 또는 V600K 돌연변이 양성 흑색종 치료 효과는 비무작위 배정, 공개, 다기관, 다군 연구(COMBI-MB 연구; NCT02039947)에서 평가되었습니다. 적격 환자는 측정 가능한 두개내 병변이 1개 이상 있어야 하고, 뇌척수막 질환, 직경 4cm 이상의 실질 뇌 전이, 안구 흑색종 또는 일차 점막 흑색종이 없어야 했습니다. 환자는 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 MEKINIST 2mg을 1일 1회 경구 투여하고 dabrafenib 150mg을 1일 2회 경구 투여 받았습니다. 주요 유효성 결과 측정 항목은 두개내 반응률이었으며, 독립적인 검토에 의해 평가된 RECIST v1.1에 따라 확인된 두개내 반응을 보인 환자의 비율로 정의되었으며, 직경이 5mm 이상인 두개내 표적 병변을 최대 5개까지 허용하도록 수정되었습니다.
COMBI-MB 연구에는 BRAF V600E(85%) 또는 V600K(15%) 돌연변이가 있는 환자 121명이 등록되었습니다. 중앙값 연령은 54세(범위: 23~84세)였으며, 남성이 58%, 백인이 100%, 미국 출신이 8%, 기준선에서 LDH가 정상인 환자가 65%, ECOG 수행 상태가 0 또는 1인 환자가 97%였습니다. 두개내 전이는 환자의 87%에서 무증상이었고 13%에서 증상이 있었으며, 22%는 뇌 전이에 대한 사전 국소 치료를 받았고, 87%는 두개골 외 전이도 있었습니다.
두개내 반응률은 50%(95% CI: 40, 60)였으며, 완전 반응률은 4.1%, 부분 반응률은 46%였습니다. 두개내 반응의 중앙값 지속 기간은 6.4개월(범위: 1~31개월)이었습니다. 두개내 반응을 보인 환자 중 9%는 최상의 전반적인 반응으로 안정적이거나 진행성 질환을 보였습니다.
14.2
BRAF V600E 또는 V600K 돌연변이 양성 흑색종의 보조 치료
MEKINIST와 dabrafenib를 병용 투여한 안전성과 유효성은 THxID®-BRAF 검사로 검출된 BRAF V600E 또는 V600K 돌연변이가 있고, 국소 림프절에 병리학적으로 관여된 3기 흑색종 환자를 등록한 국제적, 다기관, 무작위 배정, 이중맹검, 위약 대조 시험(COMBI-AD; NCT01682083)에서 평가되었습니다. 등록에는 무작위 배정 전 12주 이내에 흑색종을 완전히 절제하고 완전 림프절 절제술을 시행해야 했습니다. 이 시험은 점막 또는 안구 흑색종, 절제 불가능한 이동성 전이, 원격 전이 질환 또는 방사선 치료를 포함한 사전 전신 항암 치료를 받은 환자를 제외했습니다. 환자는 MEKINIST 2mg을 1일 1회 dabrafenib 150mg을 1일 2회 병용 투여하거나 위약 2개를 최대 1년 동안 투여 받도록 무작위 배정(1:1)되었습니다. 무작위 배정은 BRAF 돌연변이 상태(V600E 또는 V600K)와 미국 암 공동 위원회(AJCC; 7th 판) 병기(IIIA, IIIB 또는 IIIC)에 따라 계층화되었습니다. 주요 유효성 결과 측정 항목은 재발 없는 생존 기간(RFS)이었으며, 연구자에 의해 평가된 무작위 배정부터 질병 재발(국소, 국소 또는 원격 전이), 새로운 일차 흑색종 또는 어떤 원인으로 인한 사망까지의 시간으로 정의되었습니다. 환자는 처음 2년 동안 3개월마다, 그 이후에는 6개월마다 종양 재발에 대한 영상 검사를 받았습니다.
COMBI-AD에서 총 870명의 환자가 무작위 배정되었습니다. MEKINIST와 dabrafenib 병용 투여군에는 438명, 위약군에는 432명이었습니다. 중앙값 연령은 51세(범위: 18~89세)였으며, 남성이 55%, 백인이 99%, ECOG 수행 상태가 0인 환자가 91%였습니다. 질병 특징은 AJCC 병기 IIIA(18%), 병기 IIIB(41%), 병기 IIIC(40%), 병기 불명(1%); BRAF V600E 돌연변이(91%), BRAF V600K 돌연변이(9%); 거시적 림프절(65%); 종양 궤양(41%)이었습니다. 추적 관찰의 중앙값 기간(무작위 배정부터 마지막 접촉 또는 사망까지의 시간)은 2.8년이었습니다.
COMBI-AD는 위약군에 무작위 배정된 환자에 비해 MEKINIST와 dabrafenib 병용 투여군에 무작위 배정된 환자에서 RFS가 통계적으로 유의하게 개선됨을 보여주었습니다. 유효성 결과는 표 22와 그림 3에 제시되어 있습니다.
| 약어: HR, 위험 비율; CI, 신뢰 구간; NE, 추정 불가. a계층화된 로그 랭크 검정에서 얻은 파이크 추정치. b질병 병기(IIIA 대 IIIB 대 IIIC)와 BRAF V600 돌연변이 유형(V600E 대 V600K)에 따라 계층화된 로그 랭크 검정. |
||
| 종점 | MEKINIST + Dabrafenib N = 438 |
위약 N = 432 |
| 재발 없는 생존 기간 | ||
| 사건 수(%) | 166 (38) | 248 (57) |
| 중앙값, 개월(95% CI) | NE (44.5, NE) | 16.6 (12.7, 22.1) |
| HR (95% CI)a | 0.47 (0.39, 0.58) | |
| P 값b | < 0.0001 | |
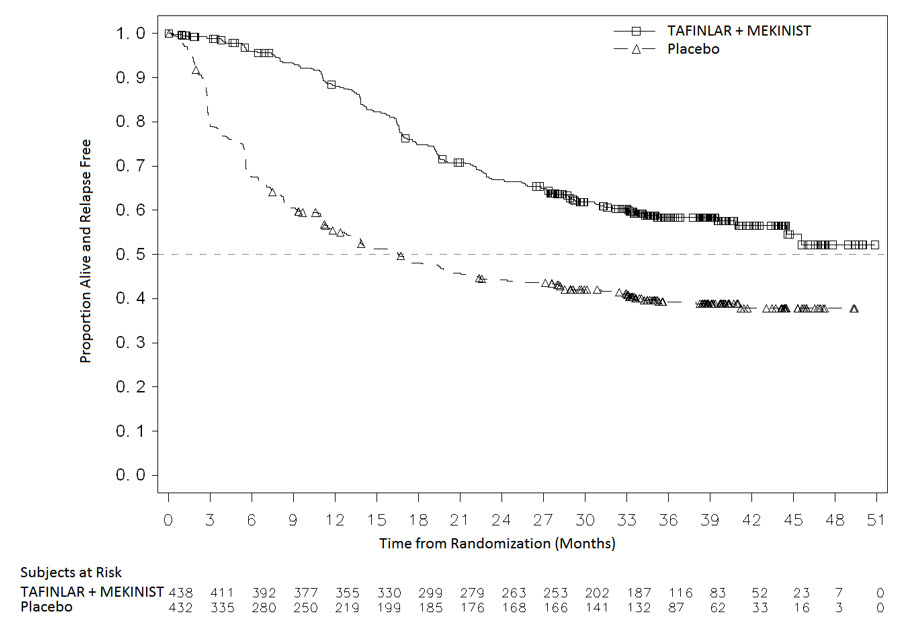
Figure 3. Kaplan-Meier Curves for Relapse-Free Survival in COMBI-AD in the Adjuvant Treatment of Melanoma
14.3
BRAF V600E 돌연변이 양성 전이성 비소세포폐암
다브라페닙 단독 또는 MEKINIST와 병용 투여의 안전성 및 유효성은 다기관, 3개 코호트, 비무작위, 활성 추정, 공개 표지 시험(BRF113928 연구; NCT01336634)에서 평가되었습니다. 주요 적격 기준은 국소적으로 확인된 BRAF V600E 돌연변이 양성 전이성 NSCLC, BRAF 또는 MEK 억제제에 대한 사전 노출 없음, EGFR 돌연변이 또는 ALK 재배열 없음(환자가 이전 티로신 키나아제 억제제 치료에 진행된 경우 제외)이었습니다. 코호트 A 및 B에 등록된 환자는 입증된 질병 진행으로 플라티넘 기반 화학 요법 요법을 최소한 1회 이상 받았지만 이전 전신 요법은 3회 이하였습니다. 코호트 C의 환자는 전이성 질환에 대한 이전 전신 치료를 받을 수 없었습니다. 코호트 A의 환자는 다브라페닙 150mg을 1일 2회 투여 받았습니다. 코호트 B 및 C의 환자는 MEKINIST 2mg을 1일 1회 투여 받고 다브라페닙 150mg을 1일 2회 투여 받았습니다. 주요 유효성 결과는 독립적인 검토 위원회(IRC)가 평가한 RECIST v1.1에 따른 ORR 및 반응 지속 기간이었습니다.
총 171명의 환자가 등록되었으며, 여기에는 코호트 A에 등록된 78명의 환자, 코호트 B에 등록된 57명의 환자, 코호트 C에 등록된 36명의 환자가 포함되었습니다. 인구 특성은 다음과 같습니다. 중간 연령 66세; 남성 48%; 백인 81%, 아시아인 14%, 흑인 3%, 히스패닉 2%; 전 흡연자 60%, 비흡연자 32%, 현 흡연자 8%; ECOG 수행 상태(PS)가 0인 환자 27%, ECOG PS가 1인 환자 63%, ECOG PS가 2인 환자 11%; 99%가 전이성 질환을 앓았으며, 그 중 6%는 기준선에서 뇌 전이를 보였고 14%는 기준선에서 간 전이를 보였습니다. 11%는 보조 설정에서 전신 항암 치료를 받았고, 이전에 치료받은 135명의 환자 중 58%는 전이성 질환에 대한 이전 전신 치료를 1회만 받았습니다. 98%는 비편평 상피 조직학을 보였습니다.
유효성 결과는 표 23에 요약되어 있습니다.
| 약어: CI, 신뢰 구간; DoR, 반응 지속 기간. a주요 분석 응답자 코호트에 대한 최종 분석 결과(2021년 2월 24일 마감일)를 나타냅니다. |
|||
| 치료 | 다브라페닙 | MEKINIST + 다브라페닙 | |
| 인구 | 이전에 치료받은 N = 78 |
이전에 치료받은 N = 57 |
치료 경험 없는 N = 36 |
| 전반적인 반응률a | |||
| ORR (95% CI) | 27% (18%, 38%) | 61% (48%, 74%) | 61% (44%, 77%) |
| 완전 반응 | 1% | 5% | 8% |
| 부분 반응 | 26% | 56% | 53% |
| 반응 지속 기간a | n = 21 | n = 35 | n = 22 |
| 중간 DoR, 개월 (95% CI) | 18.0 (4.2, 40.1) | 9.0 (5.8, 26.2) | 15.2 (7.8, 23.5) |
Oncomine™ Dx Target Test를 통해 후향적으로 중앙에서 확인된 BRAF V600E 돌연변이 양성 NSCLC 환자의 하위 그룹 분석에서 ORR 결과는 표 16에 제시된 결과와 유사했습니다.
14.4
BRAF V600E 돌연변이 양성 국소 진행성 또는 전이성 갑상선암
다브라페닙과 함께 투여된 MEKINIST의 안전성 및 유효성은 BRAF V600E 돌연변이가 있는 희귀 암 환자(국소 진행성, 절제 불가능 또는 전이성 ATC 포함)를 대상으로 한 활성 추정, 9개 코호트, 다기관, 비무작위 배정, 공개 표지 시험(연구 BRF117019; NCT02034110)에서 평가되었습니다. 이 시험에서는 표준 국소 치료 옵션이 없는 환자를 대상으로 했습니다. 시험 BRF117019는 약물을 삼키거나 유지할 수 없는 환자, BRAF 또는 MEK 억제제로 사전 치료를 받은 환자, 증상이 있는 또는 치료되지 않은 CNS 전이가 있는 환자, 기도 폐쇄가 있는 환자는 제외했습니다. 환자는 MEKINIST 2mg을 1일 1회, 다브라페닙 150mg을 1일 2회 투여 받았습니다. 주요 유효성 결과 측정 항목은 독립적인 검토 위원회(IRC)가 평가한 RECIST v1.1에 따른 ORR과 반응 지속 기간(DoR)이었습니다.
ATC 코호트에서 36명의 환자가 등록되었고 반응에 대해 평가할 수 있었습니다. 중앙 연령은 71세(범위: 47~85세)였으며, 44%가 남성, 50%가 백인, 44%가 아시아인이었고, 94%가 ECOG 수행 상태가 0 또는 1이었습니다. 이전 항암 치료에는 수술 및 외부 빔 방사선 요법(각각 83%), 전신 요법(67%)이 포함되었습니다.
유효성 결과는 표 24에 요약되어 있습니다.
| 약어: ATC, 갑상선암; CI, 신뢰 구간; DoR, 반응 지속 기간; ORR, 전체 반응률; NE, 추정 불가. | |
| ATC 코호트 모집단 | N = 36 |
| 전체 반응률 | |
| ORR (95% CI) | 53% (35.5%, 69.6%) |
| 완전 반응 | 6% |
| 부분 반응 | 47% |
| 반응 지속 기간 | n = 19 |
| 중앙 DoR, 개월(95% CI) | 13.6 (3.8, NE) |
| DoR ≥ 6개월인 비율 | 68% |
| DoR ≥ 12개월인 비율 | 53% |
14.5
BRAF 억제제 치료 후 전이성 흑색종에서 임상 활성 부족
MEKINIST의 단독 요법으로서의 임상 활성은 BRAF V600E 또는 V600K 돌연변이 양성, 절제 불가능 또는 전이성 흑색종 환자 40명을 대상으로 한 단일군, 다기관, 국제 임상 시험에서 평가되었다. 이 환자들은 모두 BRAF 억제제로 사전 치료를 받았다. 모든 환자는 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 1일 1회 경구로 MEKINIST 2mg을 투여받았다.
중간 연령은 58세였으며, 63%가 남성이었고, 모두 백인이었으며, 98%가 기준 ECOG PS가 0 또는 1이었으며, BRAF V600 돌연변이의 분포는 V600E(83%), V600K(10%)였으며, 나머지 환자는 다중 V600 돌연변이(5%) 또는 알 수 없는 돌연변이 상태(2%)를 보였다. 임상 연구자에 의해 결정된 바와 같이, 어떤 환자도 확인된 부분 또는 완전 반응을 달성하지 못했다.
14.6
BRAF V600E 돌연변이 양성 절제 불가능 또는 전이성 고형 종양
BRAF V600E 돌연변이 양성 절제 불가능 또는 전이성 고형 종양 치료를 위한 dabrafenib와 병용한 MEKINIST의 안전성 및 유효성은 BRF117019, NCI-MATCH 및 CTMT212X2101 임상 시험에서 평가되었으며, COMBI-d, COMBI-v [임상 연구(14.2) 참조] 및 BRF113928 [임상 연구(14.4) 참조]의 결과로 뒷받침되었다. 성인 연구에서 환자는 1일 1회 MEKINIST 2mg과 1일 2회 dabrafenib 150mg을 투여받았다. 주요 유효성 결과 측정 항목은 RECIST v1.1, RANO [HGG] 또는 수정된 RANO [LGG] 기준에 따른 ORR 및 반응 지속 기간(DoR)이었다.
BRF117019 연구 및 NCI-MATCH 연구
BRF117019 연구(NCT02034110) [임상 연구(14.5) 참조]는 고등급 교모세포종(HGG)(n = 45), 담도암(BTC)(n = 43), 저등급 교모세포종(LGG)(n = 13), 소장 선암(ASI)(n = 3), 위장관 기질 종양(GIST)(n = 1), 및 갑상선암 [임상 연구(14.5) 참조]을 포함하여 BRAF V600E 돌연변이가 있는 선택된 종양이 있는 성인 환자를 대상으로 한 다군, 다기관, 비무작위 배정, 공개 표지 임상 시험이다. 환자는 BRAF V600E 돌연변이 상태에 대한 현지 평가를 기반으로 등록되었으며, 중앙 실험실에서 105명의 환자 중 93명에서 BRAF V600E 돌연변이를 확인했다.
NCI-MATCH 연구(NCT02465060)의 H군(EAY131-H)은 BRAF V600E 돌연변이가 있는 환자를 등록한 단일군, 공개 표지 연구이다. 흑색종, 갑상선암 또는 CRC 환자는 제외되었다. 등록을 위한 BRAF 돌연변이 상태는 중앙 또는 현지 실험실 검사에 의해 결정되었다. 이 연구에는 위장관 종양(n = 14), 폐 종양(n = 7), 부인과 또는 복막 종양(n = 6), CNS 종양(n = 4), 및 하악의 아멜로블라스토마(n = 1)를 포함한 성인 고형 종양 환자가 포함되었다.
BRF117019 및 NCI-MATCH에 등록된 131명의 환자 중 표 21에 표시된 종양 유형을 가진 환자의 경우, 기준 특성은 다음과 같았다. 중간 연령은 51세였으며, 20%가 65세 이상이었으며, 56%가 여성이었으며, 85%가 백인, 9%가 아시아인, 3%가 흑인, 3%가 기타였으며, 37%가 ECOG 0, 56%가 ECOG 1, 6%가 ECOG 2였다. 131명의 환자 중 90%가 이전 전신 치료를 받았다.
고형 종양 환자의 유효성 결과는 표 25에 요약되어 있다.
| 약어: PR, 부분 반응. aNSCLC(n = 6) 및 ATC(n = 36)(이전에 MEKINIST와 dabrafenib 병용 요법에 대해 승인된 종양 유형) 제외. b중간 DoR 9.8개월(95% CI: 5.3, 20.4). c중간 DoR 13.6개월(95% CI: 5.5, 26.7). d오른쪽으로 잘린 DoR를 나타낸다. |
||||
| 종양 유형a | N | 객관적 반응률 | 반응 지속 기간 | |
| % | 95% CI | 범위(개월) | ||
| 담도암b | 48 | 46 | (31, 61) | 1.8d, 40d |
| 고등급 교모세포종c | 48 | 33 | (20, 48) | 3.9, 44 |
| 교모세포종 | 32 | 25 | (12, 43) | 3.9, 27 |
| 아교모세포종 | 6 | 67 | (22, 96) | 6, 43 |
| 아교모세포종 | 5 | 20 | (0.5, 72) | 15 |
| Astroblastoma | 2 | 100 | (16, 100) | 15, 23d |
| Undifferentiated | 1 | PR | (2.5, 100) | 6 |
| Anaplastic ganglioglioma | 1 | 0 | NA | NA |
| Anaplastic oligodendroglioma | 1 | 0 | NA | NA |
| Low grade glioma | 14 | 50 | (23, 77) | 6, 29d |
| Astrocytoma | 4 | 50 | (7, 93) | 7, 23 |
| Ganglioglioma | 4 | 50 | (7, 93) | 6, 13 |
| Pleomorphic xanthoastrocytoma | 2 | 50 | (1.3, 99) | 6 |
| Pilocytic astrocytoma | 2 | 0 | NA | NA |
| Choroid plexus papilloma | 1 | PR | (2.5, 100) | 29d |
| Gangliocytoma/ganglioglioma | 1 | PR | (2.5, 100) | 18d |
| Low grade serous ovarian carcinoma | 5 | 80 | (28, 100) | 12, 42d |
| Adenocarcinoma small intestine | 4 | 50 | (7, 93) | 7, 8 |
| Adenocarcinoma pancreas | 3 | 0 | NA | NA |
| Mixed ductal/adenoneuroendocrine carcinoma | 2 | 0 | NA | NA |
| Neuroendocrine carcinoma of colon | 2 | 0 | NA | NA |
| Ameloblastoma of mandible | 1 | PR | (2.5, 100) | 30 |
| Combined small cell-squamous carcinoma of lung | 1 | PR | (2.5, 100) | 5 |
| Mucinous-papillary serous adenocarcinoma of peritoneum | 1 | PR | (2.5, 100) | 8 |
| Adenocarcinoma of anus | 1 | 0 | NA | NA |
| Gastrointestinal stromal tumor | 1 | 0 | NA | NA |
CTMT212X2101 (X2101) 연구
X2101 연구(NCT02124772)는 난치성 또는 재발성 고형 종양이 있는 소아 환자를 대상으로 다기관, 공개 라벨, 다중 코호트 연구였습니다. C 부분은 BRAF V600E 돌연변이가 있는 환자에서 다브라페닙과 병용한 MEKINIST의 용량 증량이었습니다. D 부분은 BRAF V600E 돌연변이가 있는 LGG 환자에서 다브라페닙과 병용한 MEKINIST의 코호트 확장 단계였습니다. 주요 유효성 결과 측정은 RANO 기준에 따라 독립적인 검토 위원회가 평가한 ORR이었습니다.
다브라페닙과 병용한 MEKINIST의 유효성은 LGG 환자 34명과 HGG 환자 2명을 포함한 소아 환자 48명에서 평가되었습니다.
C 부분과 D 부분에서 BRAF V600E 돌연변이 LGG 및 HGG 환자의 경우 중간 연령은 10세(범위: 1~17세)였습니다. 50%가 남성, 75%가 백인, 8%가 아시아인, 3%가 흑인이었으며 58%가 Karnofsky/Lansky 수행 상태가 100이었습니다. 이전 항암 치료에는 수술(83%), 외부 빔 방사선 요법(2.8%) 및 전신 요법(92%)이 포함되었습니다. ORR은 25%(95% CI: 12%, 42%)였습니다. 반응을 보인 9명의 환자 중 78%의 환자에서 DoR은 ≥ 6개월이었고 44%의 환자에서 ≥ 24개월이었습니다.
CDRB436G2201 (G2201) 연구 – 고등급 신경교종 코호트
G2201 연구(NCT02684058)는 BRAF V600E 돌연변이 저등급 신경교종(LGG)이 있는 화학 요법 경험이 없는 소아 환자와 재발성 또는 진행성 BRAF V600E 돌연변이 HGG 환자를 대상으로 다기관, 무작위 배정, 공개 라벨, 2상 연구였습니다. HGG 환자는 단일 군 코호트에 등록되었습니다. HGG 코호트의 주요 유효성 결과 측정은 RANO 2010 기준에 따라 독립적인 검토 위원회가 평가한 ORR이었습니다.
다브라페닙과 병용한 MEKINIST의 유효성은 재발성 또는 진행성 HGG가 있는 소아 환자 41명에서 평가되었습니다.
HGG 코호트에 등록된 BRAF V600E 돌연변이 HGG 환자의 경우 중간 연령은 13세(범위: 2~17세)였습니다. 56%가 여성, 61%가 백인, 27%가 아시아인, 2.4%가 흑인이었으며 37%가 Karnofsky/Lansky 수행 상태가 100이었습니다. 이전 항암 치료에는 수술(98%), 방사선 요법(90%) 및 화학 요법(81%)이 포함되었습니다. ORR은 56%(95% CI: 40, 72)였습니다. 중간 DoR은 도달하지 못했습니다(95% CI: 9.2, NE). HGG 코호트에서 반응을 보인 23명의 환자 중 78%의 환자에서 DoR은 ≥ 6개월이었고 48%의 환자에서 ≥ 12개월이었으며 22%의 환자에서 ≥ 24개월이었습니다.
14.7
BRAF V600E 돌연변이 양성 저등급 신경교종
CDRB436G2201 (G2201) 연구 – 저등급 신경교종 코호트
1~< 18세 소아 환자에서 BRAF V600E 돌연변이 양성 저등급 신경교종(LGG) 치료를 위한 다브라페닙과 병용한 MEKINIST의 안전성 및 유효성은 다기관, 공개 라벨 시험(CDRB436G2201 연구; NCT02684058)에서 평가되었습니다. 첫 번째 전신 요법이 필요한 LGG(WHO 등급 1 및 2) 환자는 다브라페닙 + 트라메티닙(D + T) 또는 카보플라틴 + 빈크리스틴(C + V)에 2:1 비율로 무작위 배정되었습니다.
BRAF 돌연변이 상태는 국소 평가 또는 중앙 실험실 검사를 통해 전향적으로 확인되었습니다. 또한 중앙 실험실에서 사용 가능한 종양 샘플에 대한 회고적 검사를 수행하여 BRAF V600E 돌연변이 상태를 평가했습니다.
환자는 임상적 이점이 없어질 때까지 또는 허용할 수 없는 독성이 나타날 때까지 MEKINIST와 다브라페닙을 연령 및 체중 기반으로 투여받았습니다. 카보플라틴과 빈크리스틴은 각각 175mg/m2 및 1.5mg/m2(12kg 미만 환자의 경우 0.05mg/kg)의 용량으로 체표면적을 기준으로 투여되었으며, 10주간의 유도 과정 1회 후 6주간의 유지 요법 8주기를 시행했습니다.
주요 유효성 결과 측정은 RANO LGG(2017) 기준에 따라 독립적인 검토를 통해 평가한 전체 반응률(ORR)이었습니다. 추가 유효성 결과 측정은 무진행 생존 기간과 전체 생존 기간이었습니다. 모든 환자가 최소 32주 동안 치료를 완료했을 때 주요 분석이 수행되었습니다.
LGG 코호트에서 110명의 환자가 D + T(n = 73) 또는 C + V(n = 37)에 무작위 배정되었습니다. 중간 연령은 9.5세(범위: 1~17세)였으며 60%가 여성이었습니다. G2201 연구는 C + V에 무작위 배정된 환자에 비해 D + T에 무작위 배정된 LGG 환자에서 ORR과 PFS가 통계적으로 유의미하게 개선되었음을 보여주었습니다. 유효성 결과는 표 26에 나와 있습니다.
| 약어: CI, 신뢰 구간; NE, 추정 불가. aClopper-Pearson 정확 신뢰 구간 기반 bKaplan-Meier 방법 기반 c비례 위험 모델 기반 |
||||
| MEKINIST + 다브라페닙 N = 73 |
카보플라틴 + 빈크리스틴 N = 37 |
|||
| 전체 반응률 | ||||
| ORR%(95% CI)a | 46.6 (34.8, 58.6) | 10.8 (3.0, 25.4) | ||
| P 값 | < 0.001 | |||
| 완전 관해, n (%) | 2 (2.7) | 1 (2.7) | ||
| 부분 관해, n (%) | 32 (44) | 3 (8) | ||
| 반응 지속 기간 | ||||
| 중간값(95% CI)b, 개월 | 23.7 (14.5, NE) | NE (6.6, NE) | ||
| % with observed DoR ≥ 12 months | 56 | 50 | ||
| % with observed DoR ≥ 24 months | 15 | 25 | ||
| Progression-Free Survival | ||||
| Median (95% CI)b, months | 20.1 (12.8, NE) | 7.4 (3.6, 11.8) | ||
| Hazard ratio (95% CI)c | 0.31 (0.17, 0.55) | |||
| P value | < 0.001 | |||
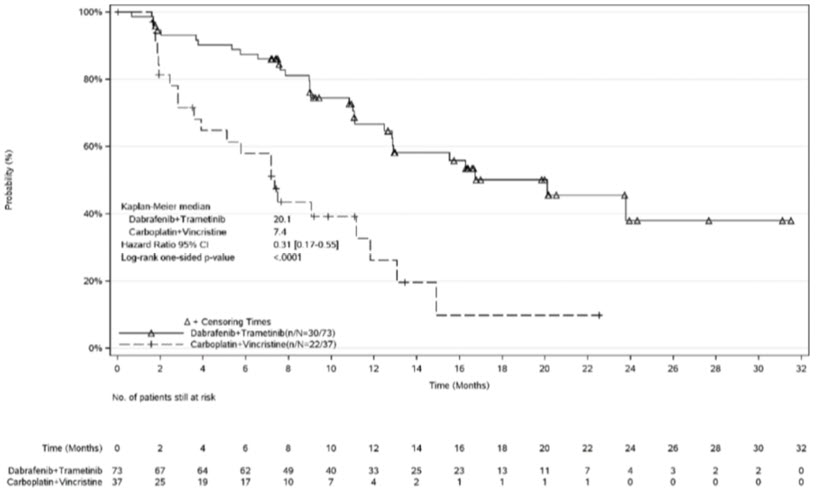
Figure 4. Kaplan-Meier Curves for Progression-Free Survival in Study G2201 (LGG cohort)
At the time of the interim analysis of overall survival (OS), conducted when all patients had completed at least 32 weeks of treatment or had discontinued earlier, there was one death on the C + V arm. The OS results at interim analysis did not reach statistical significance.
16 제공/보관 및 취급 방법
MEKINIST 정제:
0.5 mg 정제: 한쪽 면에 ‘GS’, 반대쪽 면에 ‘TFC’가 새겨져 있는 노란색의 수정된 타원형, 양면 볼록 필름 코팅 정제이며 30정 병(NDC 0078-0666-15)으로 제공됩니다.
0.5 mg 정제: 한쪽 면에 노바티스 로고가, 다른 쪽 면에 ‘TT’가 새겨져 있는 노란색의 타원형, 양면 볼록, 무분할선 필름 코팅 정제이며 모서리가 경사져 있고 30정 병(NDC 0078-1105-15)으로 제공됩니다.
2 mg 정제: 한쪽 면에 ‘GS’, 반대쪽 면에 ‘HMJ’가 새겨져 있는 분홍색의 원형, 양면 볼록 필름 코팅 정제이며 30정 병(NDC 0078-0668-15)으로 제공됩니다.
2 mg 정제: 한쪽 면에 노바티스 로고가, 다른 쪽 면에 ‘LL’이 새겨져 있는 분홍색의 원형, 양면 볼록, 무분할선 필름 코팅 정제이며 모서리가 경사져 있고 30정 병(NDC 0078-1112-15)으로 제공됩니다.
2°C~8°C(36°F~46°F)에서 냉장 보관하십시오. 원래 병에 넣어 제공하십시오. 건조제를 제거하지 마십시오. 습기와 빛으로부터 보호하십시오. 약통에 약을 넣지 마십시오.
MEKINIST 경구용 용액:
눌러 끼우는 병 어댑터 및 경구용 주사기와 함께 포장된 호박색 유리병에 든 흰색 또는 거의 흰색의 분말입니다. 각 병에는 트라메티닙 디메틸 설폭사이드 5.3 mg에 해당하는 트라메티닙 4.7 mg이 들어 있습니다. 재구성된 딸기맛 트라메티닙 용액 1 mL에는 비용매화된 모화합물인 트라메티닙 0.05 mg이 들어 있습니다. (NDC 0078-1161-47).
2°C~8°C(36°F~46°F)에서 냉장 보관하십시오. 빛과 습기로부터 보호하기 위해 원래 상자에 보관하십시오.
재구성한 후에는 원래 병에 넣어 25°C(77°F) 미만에서 보관하고 얼리지 마십시오.
재구성 후 35일 이내에 사용하지 않은 용액은 버리십시오.
17 환자 상담 정보
FDA 승인 환자 라벨(환자 정보 및 사용 지침)을 읽도록 환자에게 알려주십시오.
새로운 일차 피부 및 비피부 악성 종양
다브라페닙과 함께 투여된 MEKINIST는 새로운 일차 피부 및 비피부 악성 종양의 발생을 초래할 수 있음을 환자에게 알려주십시오. 환자에게 피부에 새로운 병변이 발생하거나 기존 병변이 변하거나 악성 종양의 다른 징후 및 증상이 나타나면 즉시 의료 서비스 제공자에게 연락하도록 알려주십시오 [경고 및 주의 사항 (5.1) 참조].
출혈
다브라페닙과 함께 투여된 MEKINIST는 두개 내 및 위장관 출혈의 위험을 증가시킵니다. 환자에게 비정상적인 출혈이나 출혈의 징후 또는 증상이 나타나면 즉시 의료 서비스 제공자에게 연락하여 즉각적인 의료 처치를 받도록 알려주십시오 [경고 및 주의 사항 (5.2) 참조].
대장염 및 위장관 천공
환자에게 MEKINIST는 대장염 및 위장관 천공을 유발할 수 있으며, 대장염 또는 위장관 천공의 징후 또는 증상이 나타나면 의료 서비스 제공자에게 연락하도록 알려주십시오 [경고 및 주의 사항 (5.3) 참조].
정맥혈전색전증
다브라페닙과 함께 투여된 MEKINIST는 PE 및 DVT의 위험을 증가시킵니다. 환자에게 갑자기 호흡 곤란, 다리 통증 또는 부종이 나타나면 즉시 의료 서비스 제공자에게 연락하도록 알려주십시오 [경고 및 주의 사항 (5.4) 참조].
심근병증
환자에게 MEKINIST는 심근병증을 유발할 수 있으며, 심부전의 징후 또는 증상이 나타나면 즉시 의료 서비스 제공자에게 보고하도록 알려주십시오 [경고 및 주의 사항 (5.5) 참조].
안구 독성
환자에게 MEKINIST는 실명으로 이어질 수 있는 심각한 시력 장애를 유발할 수 있으며, 시력에 변화가 나타나면 의료 서비스 제공자에게 연락하도록 알려주십시오 [경고 및 주의 사항 (5.6) 참조].
간질성 폐 질환/폐렴
환자에게 MEKINIST는 ILD(또는 폐렴)를 유발할 수 있습니다. 환자에게 기침이나 호흡 곤란과 같은 징후가 나타나면 가능한 한 빨리 의료 서비스 제공자에게 연락하도록 알려주십시오 [경고 및 주의 사항 (5.7) 참조].
심각한 발열 반응
다브라페닙과 함께 투여된 MEKINIST는 심각한 발열 반응을 유발할 수 있음을 환자에게 알려주십시오. 환자에게 MEKINIST를 다브라페닙과 함께 복용하는 동안 발열이 발생하면 의료 서비스 제공자에게 연락하도록 지시하십시오 [경고 및 주의 사항 (5.8) 참조].
심각한 피부 독성
환자에게 MEKINIST는 입원이 필요할 수 있는 심각한 피부 독성을 유발할 수 있으며, 진행성 또는 참을 수 없는 발진이 나타나면 의료 서비스 제공자에게 연락하도록 알려주십시오. 환자에게 심각한 피부 반응의 징후 및 증상이 나타나면 즉시 의료 서비스 제공자에게 연락하도록 알려주십시오 [경고 및 주의 사항 (5.9) 참조].
고혈압
환자에게 MEKINIST는 고혈압을 유발할 수 있으며, 혈압 모니터링을 받아야 하며, 심한 두통, 흐릿한 시력 또는 현기증과 같은 고혈압 증상이 나타나면 의료 서비스 제공자에게 연락해야 함을 알려주십시오 [유해 반응 (6.1) 참조].
설사
환자에게 MEKINIST는 종종 설사를 유발하며, 경우에 따라 심각할 수 있음을 알려주십시오. 환자에게 치료 중 심한 설사가 발생하면 의료 서비스 제공자에게 연락해야 함을 알려주십시오 [유해 반응 (6.1) 참조].
태아 독성
- 임산부 및 생식 능력이 있는 남성에게 태아에 대한 잠재적 위험을 알려주십시오 [경고 및 주의 사항 (5.13), 특정 인구 집단에서의 사용 (8.1, 8.3) 참조].
- 임신 사실을 알고 있거나 의심되는 여성에게 의료 서비스 제공자에게 연락하도록 알려주십시오.
- 생식 능력이 있는 여성에게 MEKINIST 치료 중 및 마지막 투여 후 4개월 동안 효과적인 피임법을 사용하도록 알려주십시오.
- 생식 능력이 있는 여성 파트너가 있는 남성 환자에게 MEKINIST 치료 중 및 마지막 투여 후 4개월 동안 콘돔을 사용하도록 알려주십시오.
수유
MEKINIST 치료 중 및 마지막 투여 후 4개월 동안 여성이 모유 수유를 하지 않도록 알려주십시오 [특정 인구 집단에서의 사용 (8.2) 참조].
불임
생식 능력이 있는 여성에게 불임이 악화될 수 있는 잠재적 위험을 알려주십시오 [특정 인구 집단에서의 사용 (8.3) 참조].
투여
환자에게 식사 1시간 전 또는 식사 2시간 후에 MEKINIST를 복용하도록 지시하십시오 [투여량 및 투여 방법 (2.3) 참조].
THxID® BRAF 검사는 bioMérieux의 상표입니다.
Oncomine™ Dx Target Test는 Thermo Fisher Scientific Inc.의 일부인 Life Technologies Corporation의 상표입니다.
배포처:
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936
© Novartis
T2024-54
환자 안내문
| 본 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2024년 7월 |
| 환자 정보 | |
| MEKINIST® (MEK-in-ist) (trametinib) 정제 |
MEKINIST® (MEK-in-ist) (trametinib) 경구용 용액 |
| 중요 정보: 의료진이 MEKINIST를 다브라페닙과 함께 복용하도록 처방한 경우, 다브라페닙에 함께 제공되는 약물 안내서도 읽어보십시오. | |
| MEKINIST에 대해 알아야 할 가장 중요한 정보는 무엇입니까? MEKINIST는 다음을 포함한 심각한 부작용을 유발할 수 있습니다. 새로운 피부암 발생 위험. MEKINIST는 다브라페닙과 함께 사용할 경우, 피부 편평 세포 암종, 각화 낭종, 기저 세포 암종 또는 흑색종이라고 불리는 피부암을 유발할 수 있습니다. 이러한 암에 대한 위험성에 대해 의료진과 상담하십시오. 피부를 확인하고 다음과 같은 피부 변화가 나타나면 즉시 의료진에게 알리십시오.
의료진은 MEKINIST와 다브라페닙으로 치료를 시작하기 전에, MEKINIST와 다브라페닙으로 치료하는 동안 2개월마다, 그리고 MEKINIST와 다브라페닙 복용을 중단한 후 최대 6개월 동안 피부를 검사하여 새로운 피부암이 있는지 확인해야 합니다. |
|
| MEKINIST는 무엇입니까? MEKINIST는 다음과 같은 경우에 처방되는 약물입니다.
MEKINIST는 흑색종 치료를 위해 이미 BRAF 억제제를 투여받았지만 효과가 없거나 더 이상 효과가 없는 사람에게는 사용해서는 안 됩니다.
MEKINIST는 대장암 치료에는 사용하지 않습니다. |
|
MEKINIST를 복용하거나 투여하기 전에, 다음과 같은 경우를 포함하여 모든 의학적 상태를 의료 서비스 제공자에게 알리십시오.
처방약과 일반 의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약물을 의료 서비스 제공자에게 알리십시오. |
|
MEKINIST를 어떻게 복용하거나 투여해야 합니까?
MEKINIST 정제:
경구용 MEKINIST:
|
|
| MEKINIST의 가능한 부작용은 무엇입니까? MEKINIST는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
|
|
|
○ 피부 물집 또는 박리 |
○ 입술, 입 주변 또는 눈 주변에 물집 |
MEKINIST를 단독으로 복용할 때 가장 흔한 부작용은 다음과 같습니다.
|
|
| 다른 신체 부위로 전이되었거나 수술로 제거할 수 없는 흑색종이 있는 사람에게 MEKINIST를 다브라페닙과 함께 복용할 때 가장 흔한 부작용은 다음과 같습니다. | |
| • 발열 | • 설사 |
| • 발진 | • 구토 |
| • 메스꺼움 | • 고혈압(고혈압) |
| • 오한 | • 얼굴, 팔 또는 다리 부종 |
| 수술로 암을 제거한 후 흑색종이 재발하는 것을 예방하기 위해 MEKINIST를 다브라페닙과 함께 복용할 때 가장 흔한 부작용은 다음과 같습니다. | |
| • 발열 | • 오한 |
| • 피로 | • 설사 |
| • 메스꺼움 | • 구토 |
| • 두통 | • 관절통 |
| • 발진 | • 근육통 |
| 다브라페닙과 함께 MEKINIST를 복용하는 NSCLC 환자에서 가장 흔한 부작용은 다음과 같습니다. | |
| • 발열 | • 발진 |
| • 피로감 | • 얼굴, 팔, 다리 부종 |
| • 메스꺼움 | • 오한 |
| • 구토 | • 출혈 |
| • 설사 | • 기침 |
| • 건조한 피부 | • 호흡 곤란 |
| • 식욕 감소 | |
| 다브라페닙과 함께 MEKINIST를 복용하는 수술로 제거할 수 없거나 다른 신체 부위로 전이된 고형 종양이 있는 성인에서 가장 흔한 부작용은 다음과 같습니다. | |
| • 발열 | • 출혈 |
| • 피로감 | • 기침 |
| • 메스꺼움 | • 구토 |
| • 발진 | • 변비 |
| • 오한 | • 설사 |
| • 두통 | • 근육 및 관절 통증 |
| • 팔과 다리 부종 | |
| 다브라페닙과 함께 MEKINIST를 투여받는 수술로 제거할 수 없거나 다른 신체 부위로 전이된 고형 종양이 있는 1세 이상의 소아에서 가장 흔한 부작용은 다음과 같습니다. | |
| • 발열 | • 여드름 |
| • 발진 | • 두통 |
| • 구토 | • 복통 |
| • 피로감 | • 메스꺼움 |
| • 건조한 피부 | • 출혈 |
| • 기침 | • 변비 |
| • 설사 | • 손톱이나 발톱 주변의 피부 감염 |
| 다브라페닙과 함께 MEKINIST를 투여받는 1세 이상의 저등급 교모세포종이 있는 소아에서 가장 흔한 부작용은 다음과 같습니다. | |
| • 발열 | • 건조한 피부 |
| • 발진 | • 설사 |
| • 두통 | • 메스꺼움 |
| • 구토 | • 출혈 |
| • 근육 및 뼈 통증 | • 복통 |
| • 피로감 | • 여드름 |
| MEKINIST는 새로운 고혈압(고혈압)을 유발하거나 악화시킬 수 있습니다. 의료진은 MEKINIST 치료 중에 혈압을 확인해야 합니다. 고혈압이 발생하거나 악화되거나 심한 두통, 현기증, 시력 흐림 또는 어지러움이 발생하면 즉시 의료진에게 연락하십시오. MEKINIST는 여성의 생식 능력에 문제를 일으킬 수 있습니다. 이는 임신 가능성에 영향을 미칠 수 있습니다. 이것이 우려되는 사항이라면 의료진과 상담하십시오. 이것들은 MEKINIST의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의료진에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088. Novartis Pharmaceuticals Corporation에 부작용을 보고할 수도 있습니다. 1-888-669-6682. |
|
| MEKINIST는 어떻게 보관해야 합니까? MEKINIST 정제:
MEKINIST 경구용 용액:
MEKINIST 및 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|
| MEKINIST의 안전하고 효과적인 사용에 대한 일반 정보 의약품은 때때로 환자 정보 팜플렛에 나열된 목적 이외의 목적으로 처방됩니다. MEKINIST는 처방받지 않은 질환에 사용하지 마십시오. MEKINIST를 다른 사람에게 주지 마십시오. 같은 증상이 있어도 해로울 수 있습니다. 의료진 또는 약사에게 의료 전문가를 위해 작성된 MEKINIST에 대한 정보를 문의할 수 있습니다. |
|
| MEKINIST의 성분은 무엇입니까? MEKINIST 정제: 활성 성분: trametinib 비활성 성분: 정제 코어: 이산화규소 콜로이드, 크로스카멜로스나트륨, 히프로멜로스, 스테아린산 마그네슘(식물성), 만니톨, 미결정 셀룰로스, 라우릴황산나트륨. 정제 코팅: 히프로멜로스, 산화철 적색(2mg 정제), 산화철 황색(0.5mg 정제), 폴리에틸렌글리콜, 폴리소르베이트 80(2mg 정제), 이산화티타늄. MEKINIST 경구용 용액: 활성 성분: trametinib 비활성 성분: 베타덱스 설포부틸 에테르 나트륨, 구연산 일수화물, 인산이수소나트륨, 메틸파라벤, 소르빈산칼륨, 수크랄로스, 딸기향. 판매원: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936 © Novartis 자세한 내용은 www.us.tafinlarmekinist.com을 방문하거나 1-888-669-6682로 전화하십시오. |
|
T2024-55
사용 방법
| This Instructions for Use has been approved by the U.S. Food and Drug Administration. | Revised: July 2024 |
| INSTRUCTIONS FOR USE MEKINIST® (MEK-in-ist) (trametinib) for oral solution |
|
| 이 “사용 설명서”에는 MEKINIST 경구용액의 투여 방법에 대한 정보가 포함되어 있습니다. | |
| MEKINIST 경구용액을 투여하기 전에 알아야 할 중요한 정보 | |
|
|
| MEKINIST 팩에는 다음이 포함되어야 합니다. | |
 |
|
| 재사용 가능한 경구용 주사기 부품: | |
 |
|
| MEKINIST 경구용액 보관 | |
|
 |
| 경구용 주사기 보관 | |
|
 |
| 섹션 A. MEKINIST 경구용액 용량 측정 및 투여 | |
MEKINIST 경구용액을 투여하려면 다음이 필요합니다.
이러한 품목이 하나 이상 없는 경우 의료 서비스 제공자 또는 약사에게 문의하십시오.
|
 |
| 1단계. MEKINIST 경구용액의 용량을 측정하고 투여하기 전에 손을 씻고 말리십시오. | |
| 2단계. 깨끗하고 평평한 작업대에 준비물을 놓으십시오. | |
3단계. 호박색 병에 분말이 들어 있는지 용액이 들어 있는지 확인합니다.
|
 |
4단계. 호박색 병 라벨에 손으로 쓰거나 인쇄된 MEKINIST 경구 용액의 만료일 또는 “폐기일”을 확인합니다.
|
 |
5단계. 호박색 병을 30초 동안 부드럽게 흔들어 MEKINIST 경구 용액을 섞습니다.
|
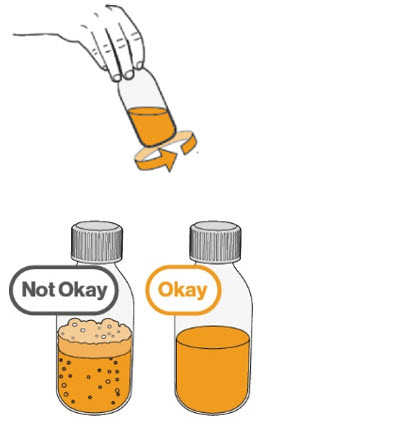 |
| 6단계. 호박색 병 안의 거품이 사라지면 그림과 같이 뚜껑을 아래로 누르고 화살표 방향(시계 반대 방향)으로 돌려 어린이 보호 뚜껑을 엽니다. 그런 다음 호박색 병을 평평한 작업 표면에 다시 놓습니다. | 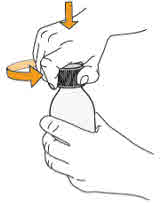 |
| 7단계. 병 입구에 병 어댑터가 이미 삽입되어 있는지 확인합니다. 병 어댑터를 제거하지 마십시오. 삽입되어 있지 않으면 병 어댑터를 경구용 주사기에서 분리하여 삽입합니다. 확실하지 않거나 병 어댑터가 없는 경우 담당 의료 전문가에게 문의하십시오. |
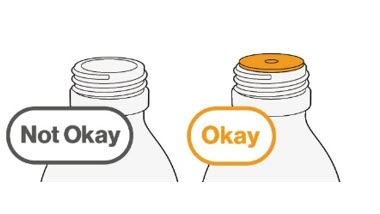 |
| 8단계. 다음으로 경구용 주사기를 집습니다. 플런저를 경구용 주사기 안으로 끝까지 밀어 넣어 내부의 공기를 모두 제거합니다. |
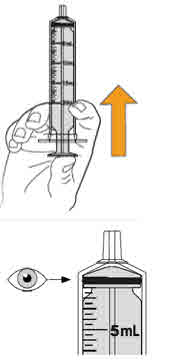 |
| 9단계. 한 손으로 조제된 MEKINIST 경구 용액이 들어 있는 호박색 병을 잡고 고정합니다. 다른 손으로 경구용 주사기 끝을 병 어댑터의 입구에 삽입합니다. 경구용 주사기가 단단히 부착되었는지 확인합니다. 중요: 기압으로 인해 10단계에서 용량을 측정하는 동안 플런저가 저절로 움직일 수 있습니다. 플런저 끝을 잡고 움직이지 않도록 합니다. |
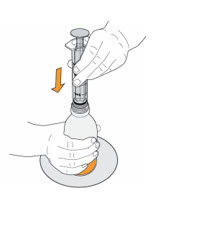 |
| 10단계. 호박색 병을 조심스럽게 뒤집고 플런저를 아래로 당겨 MEKINIST 경구 용액을 경구용 주사기 안으로 넣습니다. 용량을 측정하려면 경구용 주사기 끝이 위를 향하도록 합니다. 검은색 마개 상단이 경구용 주사기 배럴의 처방 용량(mL)과 일치할 때까지 플런저를 아래로 당깁니다. 경구용 주사기에 큰 기포가 나타나면 MEKINIST 경구 용액을 호박색 병에 다시 넣은 다음 플런저를 다시 아래로 당겨 용량을 넣습니다. |
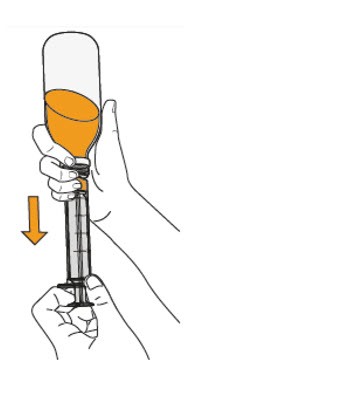 |
| 큰 기포가 더 이상 보이지 않을 때까지 이 과정을 반복합니다. 작은 기포는 괜찮습니다. | 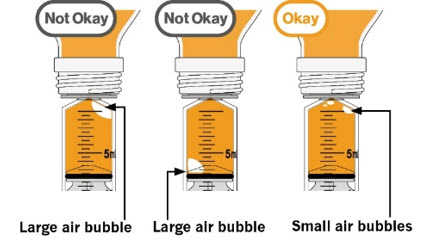 |
| 11단계. 플런저를 계속 잡고 호박색 병을 조심스럽게 똑바로 세웁니다. 호박색 병을 평평한 작업 표면에 다시 놓습니다. 플런저와 배럴을 계속 잡고 똑바로 위로 부드럽게 당겨 병에서 경구용 주사기를 제거합니다. |
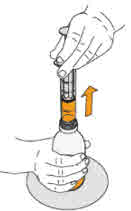 |
| 검은색 마개 상단이 처방 용량에 있는지 다시 한번 확인합니다. 그렇지 않으면 9, 10, 11단계를 다시 반복합니다. 참고: 귀하의 용량은 이 그림에 표시된 용량과 다를 수 있습니다. MEKINIST 경구 용액을 입으로 투여하는 경우 12단계로 이동합니다. MEKINIST 경구 용액을 위관 영양 튜브를 통해 투여하는 경우 B섹션으로 이동합니다. |
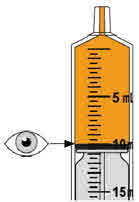 |
| 12단계. 중요: MEKINIST 경구 용액을 어린이에게 투여하는 경우, 어린이가 똑바로 앉아 있는지 확인하십시오. 경구용 주사기의 끝을 입 안에 넣습니다. 주사기 끝이 양쪽 뺨 안쪽에 닿아야 합니다. 플런저를 끝까지 천천히 눌러 MEKINIST 경구 용액을 전량 투여합니다. 경고: MEKINIST 경구 용액을 목구멍에 직접 투여하거나 플런저를 너무 빨리 누르면 질식할 수 있습니다. |
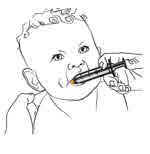 |
| 13단계. 경구용 주사기에 MEKINIST 경구 용액이 남아 있지 않은지 확인합니다. 경구용 주사기에 MEKINIST 경구 용액이 남아 있는 경우, 투여합니다. 참고: mL 단위의 용량이 경구용 주사기 용량보다 많은 경우, 처방된 총 용량을 투여할 때까지 8~14단계를 반복합니다. |
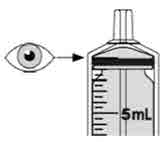 |
| 14단계. 투여를 마치면 호박색 병을 닫습니다. 병 어댑터를 제거하지 마십시오. 뚜껑을 호박색 병에 다시 끼우고 그림과 같이 화살표 방향(시계 방향)으로 돌려 닫습니다. 뚜껑이 호박색 병에 단단히 고정되었는지 확인합니다. |
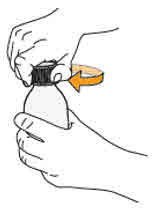 |
| 15단계. 재사용 가능한 경구용 주사기를 세척합니다. C절 “재사용 가능한 경구용 주사기 세척”의 지침을 참조하십시오. |  |
| B절. 위관 영양 튜브를 통해 MEKINIST 경구 용액 투여 | |
| 이 절은 위관 영양 튜브를 통해 MEKINIST 경구 용액을 투여하는 경우에 만 사용합니다. 위관 영양 튜브를 통해 MEKINIST 경구 용액을 투여하기 전에 다음 정보를 주의 깊게 읽은 다음 1단계로 이동하십시오.
|
|
| 1단계. MEKINIST 경구 용액을 투여하기 직전에 제조업체의 지침에 따라 위관 영양 튜브를 세척합니다. | |
| 2단계. A절의 1~11단계를 따른 다음 이 절의 3단계로 이동합니다. | |
| 3단계. MEKINIST 경구 용액이 들어 있는 20mL 경구용 주사기를 위관 영양 튜브에 연결합니다. 경구용 주사기를 위관 영양 튜브에 연결하려면 ENFIT 어댑터가 필요할 수 있습니다. | |
| 4단계. 플런저를 일정한 압력으로 눌러 위관 영양 튜브를 통해 MEKINIST 경구 용액을 투여합니다. | |
| 5단계. 경구용 주사기에 MEKINIST 경구 용액이 남아 있지 않은지 확인합니다. 경구용 주사기에 MEKINIST 경구 용액이 남아 있는 경우 3~5단계를 반복합니다. |
|
| 6단계. 제조업체의 지침에 따라 위관 영양 튜브를 다시 세척합니다. | |
| 7단계. “재사용 가능한 경구용 주사기 세척”에 대한 지침은 C절을 참조하십시오. | |
| C절. 재사용 가능한 경구용 주사기 세척 | |
| 참고: 경구용 주사기는 다른 주방 용품과 분리하여 세척하십시오. | |
| 1단계. 컵에 따뜻한 비눗물을 채웁니다. | 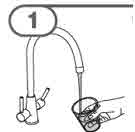 |
| 2단계. 경구용 주사기의 끝을 따뜻한 비눗물이 담긴 컵에 넣습니다. 플런저를 위로 당겼다가 아래로 눌러 비눗물을 경구용 주사기 안팎으로 4~5회 넣었다 뺍니다. |
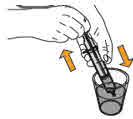 |
| 3단계. 배럴에서 플런저를 제거합니다. | 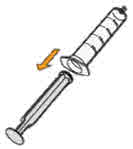 |
| 4단계. 컵, 플런저 및 배럴을 따뜻한 흐르는 물에 헹굽니다. |  |
| 5단계. 깨끗한 종이 타월에 경구용 주사기 플런저와 배럴을 놓고 자연 건조시키십시오. 경구용 주사기가 마르면 MEKINIST 경구 용액의 호박색 병과 함께 보관하십시오. 경구용 주사기는 항상 어린이의 손이 닿지 않는 곳에 보관하십시오. 참고: 새 호박색 병의 MEKINIST 경구 용액을 사용할 때마다 새 경구용 주사기를 사용하십시오. |
 |
| 유효 기간이 만료되었거나 더 이상 필요하지 않은 MEKINIST 경구 용액 또는 오래된 경구용 주사기를 폐기하는 방법 | |
|
|
| MEKINIST 경구 용액을 쏟은 경우 청소 방법 | |
| MEKINIST 경구 용액을 실수로 쏟은 경우 다음과 같이 청소하십시오. 1. 플라스틱 장갑을 착용하십시오. 2. 종이 타월과 같은 흡수재를 사용하여 쏟아진 MEKINIST 경구 용액을 완전히 닦아내십시오. 3. 사용한 흡수재를 음식 보관 백과 같은 밀봉 가능한 비닐봉지에 넣으십시오. 4. 알코올 솜으로 MEKINIST 경구 용액에 노출된 모든 표면을 닦거나 종이 타월에 소독용 알코올을 붓고 종이 타월로 노출된 표면을 닦으십시오. 5. 비닐봉지, 장갑, 사용한 알코올 솜 또는 종이 타월을 다른 비닐봉지에 넣고 밀봉하십시오. 6. 비닐봉지를 쓰레기통에 버리십시오. 7. 비누와 물로 손을 깨끗이 씻으십시오. |
|
| Distributed by: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936 © Novartis |
|
T2024-56
주요 디스플레이 패널
NDC 0078-0666-15
Mekinist® (trametinib) Tablets
0.5 mg*
Rx only
30 Tablets
NOVARTIS

주요 디스플레이 패널
NDC 0078-0668-15
Mekinist® (trametinib) Tablets
2 mg*
Rx only
30 Tablets (정제)
NOVARTIS

주요 디스플레이 패널
NDC 0078-1105-15
Mekinist® (trametinib) Tablets
0.5 mg*
Rx only
30 Tablets
NOVARTIS

주요 디스플레이 패널
NDC 0078-1112-15
Mekinist® (trametinib) Tablets
2 mg*
Rx only
30 Tablets
NOVARTIS

주요 디스플레이 패널
NDC 0078-1161-47
처방전에 의해서만 구입 가능
Mekinist®
(trametinib)
경구용 용액
mL당 0.05 mg*
90 mL (재구성 시)
약사에게: 투약 전 재구성*. 동봉된 환자 정보 및 사용 지침과 함께 제공하십시오.
보호자만 투약 가능합니다.
NOVARTIS


