의약품 제조업체: Dr.Reddys Laboratories Inc (Updated: 2022-03-16)
처방 정보 요약
SUNITINIB MALATE 캡슐, 경구 사용
최초 미국 승인: 2006
경고: 간독성전체 경고 상자에 대한 전체 처방 정보를 참조하십시오.간독성은 심각할 수 있으며 때로는 치명적일 수 있습니다. 권장대로 간 기능을 모니터링하고 sunitinib malate 투여를 중단, 용량을 줄이거나 중단하십시오[경고 및 주의사항(5.1)을 참조하십시오].
최근 주요 변경 사항
적응증 및 사용법
투여 및 투여량
제형 및 강도
캡슐: 12.5mg, 25mg, 37.5mg, 50mg 수니티닙 (3)
금기 사항
없음 (4)
경고 및 주의사항
- 간독성: 치명적인 간부전이 관찰되었습니다. 기저치, 치료주기 중, 임상적 징후가 있을 때 간 기능 검사를 모니터링하십시오. Grade ≤1 또는 기저치로 해결될 때까지 Grade 3 간독성에 대해 sunitinib malate를 중단하고 용량을 감량하여 sunitinib malate를 재개하십시오. 해결되지 않으면 중단하십시오. Grade 4 간독성, 간 기능 검사에서 추후 심각한 변화가 있거나 간부전의 다른 징후 및 증상이 있는 환자에서 sunitinib malate를 중단하십시오. (2.4, 5.1)
- 심혈관계 이상반응: 심근 허혈, 심근 경색, 심부전, 심근병증, 치명적인 사례를 포함한 정상 하한치 미만으로의 좌심실 박출률(LVEF) 감소가 발생했습니다. 울혈성 심부전의 징후 및 증상에 대해 모니터링하고 기저치 및 치료 중 주기적으로 LVEF 모니터링을 고려하십시오. 울혈성 심부전의 임상적 징후에 대해 sunitinib malate를 중단하십시오. LVEF 감소에 대해 일시 중단 및/또는 용량을 감량하십시오. (5.2)
- QT 간격 연장 및 Torsade de Pointes: QT 간격 연장 발생 위험이 더 높은 환자를 모니터링하십시오. 심전도 및 전해질 모니터링을 고려하십시오. (5.3)
- 고혈압: 기저치 및 임상적 징후가 있을 때 혈압을 모니터링하십시오. 적절하게 항고혈압 요법을 시작 및/또는 조절하십시오.
- Grade ≤1 또는 기저치로 해결될 때까지 Grade 3 고혈압에 대해 sunitinib malate를 중단한 후, 용량을 감량하여 sunitinib malate를 재개하십시오. Grade 4 고혈압이 발생한 환자에서 sunitinib malate를 중단하십시오. (5.4)
- 출혈성 이상반응: 치명적인 사례를 포함한 종양 관련 출혈 및 내장 천공이 발생했습니다. 연속적인 전혈구 수 검사 및 신체 검사를 수행하십시오. Grade ≤1 또는 기저치로 해결될 때까지 Grade 3 또는 4 출혈성 이상반응에 대해 sunitinib malate를 중단한 후, 용량을 감량하여 재개하십시오. 해결되지 않으면 중단하십시오. (5.5)
- 종양 용해 증후군(TLS): 주로 RCC 및 GIST 환자에서 일부 치명적인 TLS가 보고되었습니다. 이런 환자들을 모니터링하고 임상적으로 필요에 따라 치료하십시오. (5.6)
- 혈전성 미세혈관병증(TMA): 신부전이나 치명적인 결과로 이어지는 경우도 있는 혈전성 혈소판 감소성 자반병 및 용혈성 요독 증후군을 포함한 TMA가 보고되었습니다. TMA에 대해 sunitinib malate를 중단하십시오. (5.7)
- 단백뇨: 신부전 또는 치명적인 결과가 발생했습니다. 요단백을 모니터링하십시오. 24시간 요단백이 3g 이상인 경우 치료를 중단하십시오. 용량 감량에도 불구하고 24시간 요단백이 3g 이상으로 반복되거나 신증후군이 발생하면 중단하십시오. (5.8)
- 피부독성: 치명적인 사례를 포함한 괴사성 근막염, 다형 홍반, 스티븐스-존슨 증후군(SJS) 및 독성 표피 괴사융해(TEN)가 발생했습니다. 이러한 이상반응에 대해 sunitinib malate를 중단하십시오. (5.9)
- 가역적 후백질 뇌병증 증후군(RPLS): 치명적인 사례를 포함한 RPLS가 보고되었습니다. RPLS의 징후 및 증상을 모니터링하십시오. 해결될 때까지 sunitinib malate 투여를 보류하십시오. (5.10)
- 갑상선 기능 장애: 기저치, 치료 중 주기적으로, 임상적 징후가 있을 때 갑상선 기능을 모니터링하십시오. 갑상선 기능 장애에 대해 적절하게 치료를 시작 및/또는 조절하십시오. (5.11)
- 저혈당: 혈당 수치를 정기적으로 확인하고 당뇨병 약물 용량 조절이 필요한지 평가하십시오. (5.12)
- 턱뼈 괴사(ONJ): 침습적인 치과 시술 최소 3주 전과 ONJ 발생 시 완전히 해결될 때까지 sunitinib malate 투여를 보류하십시오. (5.13)
- 상처 치유 장애: 선택적 수술 최소 3주 전에 sunitinib malate 투여를 보류하십시오. 주요 수술 후 최소 2주 동안 및 상처가 적절히 치유될 때까지 투여하지 마십시오. 상처 치유 합병증이 해결된 후 sunitinib malate 투여 재개의 안전성은 확립되지 않았습니다. (5.14)
- 태아 독성: 태아에게 유해할 수 있습니다. 태아에 대한 잠재적 위험 및 효과적인 피임 사용에 대해 환자에게 조언하십시오. (5.15, 8.1, 8.3)
이상반응
약물 상호작용
특정 집단에서의 사용
환자 상담 정보 및 환자용 안내서는 17을 참조하십시오.
개정일: 2022년 3월
목차
전체 처방 정보: 목차*
BOXED WARNING 섹션
1 적응증 및 용법
1.1 위장관 기질종양
1.2 진행성 신세포암
1.3 신세포암의 수술 후 보조요법
1.4 진행성 췌장 신경내분비종양
2 용법 및 투여
2.1 GIST 및 진행성 RCC에 대한 권장용량
2.2 RCC의 수술 후 보조요법에 대한 권장용량
2.3 pNET에 대한 권장용량
2.4 이상반응에 따른 용량조절
2.5 약물 상호작용에 따른 용량조절
2.6 혈액투석을 받는 말기신부전 환자에서의 용량조절
3 제형 및 함량
4 금기증
5 경고 및 주의사항
5.1 간독성
5.2 심혈관계 이상반응
5.3 QT 간격 연장 및 Torsade de Pointes
5.4 고혈압
5.5 출혈성 사례 및 장기 천공
5.6 종양 용해 증후군(TLS)
5.7 혈전성 미세혈관병증(TMA)
5.8 단백뇨
5.9 피부 독성
5.10 가역성 후두부 백질뇌병증 증후군(RPLS)
5.11 갑상선 기능 이상
5.12 저혈당증
5.13 턱뼈 괴사(ONJ)
5.14 상처 치유 지연
5.15 배아-태아 독성
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 다른 약물이 Sunitinib Malate에 미치는 영향
7.2 QT 간격을 연장시키는 약물
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.3 가임기 여성 및 남성
8.4 소아에서의 사용
8.5 노인에서의 사용
8.6 간장애 환자
8.7 신장애 환자
10 과량투여
11 설명
12 임상약리학
12.1 작용기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 변이원성, 수태능 장애
14 임상시험
14.1 위장관 기질종양
14.2 신세포암
14.3 췌장 신경내분비종양
16 공급/보관 및 취급방법
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 기재하지 않았음.
박스형 경고
박스형 경고 섹션
경고: 간독성간독성은 중증일 수 있으며, 경우에 따라 치명적일 수 있습니다. 간 기능을 모니터링하고 권장대로 sunitinib malate를 중단, 용량 감소 또는 중단하십시오 [Warnings and Precautions (5.1) 참조].
1 적응증 및 사용법
1.1 위장관기질종양
Sunitinib malate 캡슐은 imatinib mesylate에 대한 질병 진행 또는 불내성을 보이는 성인 위장관기질종양(GIST) 환자의 치료에 사용됩니다.
1.4 진행성 췌장 신경내분비종양
Sunitinib malate 캡슐은 수술이 불가능한 국소 진행성 또는 전이성 질환이 있는 성인의 진행성 췌장 신경내분비종양(pNET)의 치료에 사용됩니다.
2 용량 및 투여 방법
2.1 GIST 및 진행성 RCC에 대한 권장 용량
위장관 국소성 신경내분비 종양 (GIST) 및 진행성 신세포암 (RCC)에 대한 수니티닙 말레이트의 권장 용량은 50mg으로, 4주 치료 후 2주 휴식 (4/2 스케줄)으로 매일 한 번 경구 투여하며, 질환 진행이나 불합격한 독성이 나타날 때까지 복용합니다. 수니티닙 말레이트 캡슐은 식사와 관계없이 복용할 수 있습니다.
2.2 신세포암의 보조요법에 대한 권장 용량
신세포암 (RCC)의 보조요법에 대한 수니티닙 말레이트의 권장 용량은 50mg으로, 4주 치료 후 2주 휴식 (4/2 스케줄)으로 매일 한 번 경구 투여하며, 9개의 6주 주기 동안 복용합니다. 수니티닙 말레이트 캡슐은 식사와 관계없이 복용할 수 있습니다.
2.3 pNET에 대한 권장 용량
췌장 신경내분비 종양 (pNET)에 대한 수니티닙 말레이트의 권장 용량은 37.5mg으로, 질환 진행이나 불합격한 독성이 나타날 때까지 매일 한 번 경구 투여합니다. 수니티닙 말레이트 캡슐은 식사와 관계없이 복용할 수 있습니다.
2.4 부작용에 대한 용량 조절
부작용 관리를 위해 권장하는 용량 조절은 표 1에 제공되어 있습니다. 표 2는 부작용에 대한 수니티닙 말레이트 캡슐의 권장 용량 감소를 제공합니다.
표 1. 부작용에 대한 수니티닙 말레이트의 권장 용량 감소
| 표시 | GIST | RCC | pNET | |
| 진행성 RCC | 보조요법 RCC | |||
| 첫 번째 용량 감소 | 37.5mg 매일 한 번 | 37.5mg 매일 한 번 | 37.5mg 매일 한 번 | 25mg 매일 한 번 |
| 두 번째 용량 감소 | 25mg 매일 한 번 | 25mg 매일 한 번 | NA | NA |
표 2. 부작용에 대한 수니티닙 말레이트의 용량 조절
| 부작용 | 심각도 | 수니티닙 말레이트의 용량 조절 |
| 간독성 [주의 및 사용상의 주의사항 참조 (5.1)] | 3급 | • 0~1급 또는 기저치로 회복할 때까지 중단 • 감량된 용량으로 재개 • 3급이 재발하면 영구 중단 |
| 4급 | • 영구 중단 | |
| 심혈관 이벤트[주의 및 사용상의 주의사항 참조 (5.2)] | 증상 없는 심근병증 (기저치보다 20% 이상 50% 이하 또는 기저치가 없는 경우 정상 하한치 이하) | • 0~1급 또는 기저치로 회복할 때까지 중단 • 감량된 용량으로 재개 |
| 임상적으로 나타나는 심부전 | • 영구 중단 | |
| 고혈압 [주의 및 사용상의 주의사항 참조 (5.4)] | 3급 | • 0~1급 또는 기저치로 회복할 때까지 중단 • 감량된 용량으로 재개 |
| 4급 | • 영구 중단 | |
| 출혈 사건 [주의 및 사용상의 주의사항 참조 (5.5)] | 3급 또는 4급 | • 0~1급 또는 기저치로 회복할 때까지 중단 • 중증도와 지속성에 따라 감량된 용량으로 재개하거나 중단 |
| 혈전성 미세혈관병증 [주의 및 사용상의 주의사항 참조 (5.7)] | 모든 급 | • 영구 중단 |
| 단백뇨 또는 신증후군 [주의 및 사용상의 주의사항 참조 (5.8)] | 24시간 동안 3그램 이상의 단백뇨 (신증후군이 없는 경우) | • 0~1급 또는 기저치로 회복할 때까지 중단 • 감량된 용량으로 재개 |
| 신증후군 또는 24시간 동안 3그램 이상의 반복적인 단백뇨 (용량 감량에도 불구하고) | • 영구 중단 | |
| 피부 독성 반응 이상 (EM), 스티븐스-존슨 증후군 (SJS), 중증 표피괴사증 (TEN), 괴사성 근막염 [주의 및 사용상의 주의사항 참조 (5.9)] | 모든 급 | • 영구 중단 |
| 가역성 후두백혈뇌증 [주의 및 사용상의 주의사항 참조 (5.10)] | 모든 급 | • 영구 중단 |
| 악안골관절괴사 [주의 및 사용상의 주의사항 참조 (5.13)] | 모든 급 | • 악안골관절괴사 후 수니티닙 말레이트 재개의 안전성이 입증되지 않았습니다. • 중증도와 지속성에 따라 감량된 용량으로 재개하거나 중단 |
| 상처 치유 장애 [주의 및 사용상의 주의사항 참조 (5.14)] | 모든 급 | • 상처 치유가 회복된 후 수니티닙 말레이트 재개의 안전성이 입증되지 않았습니다. • 중증도와 지속성에 따라 감량된 용량으로 재개하거나 중단 |
2.5 약물 상호작용에 대한 용량 조절
강한 CYP3A4 억제제
효소 억제력이 없거나 최소한인 대체 동시 투여 약물을 선택하십시오. 수니티닙 말레이트와 강한 CYP3A4 억제제의 동시 투여를 피할 수 없는 경우, 수니티닙 말레이트의 용량을 다음과 같이 최소 용량으로 감량하는 것을 고려하십시오 [약물 상호작용 참조 (7.1)]:
- GIST 및 RCC: 37.5mg 경구 투여, 4주 치료 후 2주 휴식 (4/2 스케줄)
- pNET: 25mg 경구 투여
강한 CYP3A4 유도제
효소 유도력이 없거나 최소한인 대체 동시 투여 약물을 선택하십시오. 수니티닙 말레이트와 강한 CYP3A4 유도제의 동시 투여를 피할 수 없는 경우, 수니티닙 말레이트의 용량을 다음과 같이 최대 용량으로 증량하는 것을 고려하십시오:
- GIST 및 RCC: 87.5mg 경구 투여, 4주 치료 후 2주 휴식 (4/2 스케줄)
- pNET: 62.5mg 경구 투여
수니티닙 말레이트의 용량이 증가되면 환자를 주의 깊게 부작용에 대해 모니터링하십시오 [약물 상호작용 참조 (7.1)].
2.6 말단 단계 신부전증 환자의 용량 조절
말단 단계 신부전증 (ESRD) 환자의 경우 시작 용량 조절은 필요하지 않습니다. 그러나 정상 신기능을 가진 환자와 비교하여 노출이 감소하므로, 안전성과 내성에 따라 후속 용량을 점진적으로 최대 2배까지 증량할 수 있습니다 [임상 약리학 참조 (12.3)].
3 제형 및 함량
캡슐제, 경질:
- 12.5 mg sunitinib: 따뜻한 회색 캡과 따뜻한 회색 몸체, 캡에는 흰색 각인 잉크로 “SC”, 몸체에는 “12.5 mg”이 인쇄되어 있음.
- 25 mg sunitinib: 검은색 캡과 검은색 몸체, 캡에는 흰색 각인 잉크로 “SC”, 몸체에는 “25 mg”이 인쇄되어 있음.
- 37.5 mg sunitinib: 검은색 캡과 회색 몸체, 캡에는 흰색 각인 잉크로 “SC”, 몸체에는 “37.5 mg”이 인쇄되어 있음.
- 50 mg sunitinib: 회색 캡과 회색 몸체, 캡에는 흰색 각인 잉크로 “SC”, 몸체에는 “50 mg”이 인쇄되어 있음.
4 사용 금기
없음.
5 경고 및 주의사항
5.1 간독성
Sunitinib malate는 간 기능 부전이나 사망에 이르는 심각한 간독성을 유발할 수 있습니다. 임상시험에서 pooled safety population 중 1% 미만의 환자에서 간 기능 부전이 발생했습니다. 간 기능 부전에는 뇌병증, 응고병증 및/또는 신부전과 함께 황달, transaminase 및/또는 고빌리루빈혈증 상승이 포함됩니다.
기저치, 각 주기 중 및 임상적으로 필요할 때 간 기능 검사(alanine aminotransferase [ALT], aspartate aminotransferase [AST] 및 bilirubin)를 모니터링하십시오. Grade 3 간독성이 Grade ≤1 또는 기저치로 해결될 때까지 sunitinib malate 투여를 중단한 다음 감량하여 sunitinib malate 투여를 재개하십시오.
Grade 4 간독성 환자, Grade 3 간독성이 해결되지 않은 환자, 이후 간 기능 검사에서 심각한 변화가 발생한 환자 및 기타 간 부전의 징후와 증상이 있는 환자에서는 sunitinib malate 투여를 중단하십시오. ALT 또는 AST가 정상 상한치(ULN)의 2.5배 초과이거나 ULN의 5배 초과이며 간 전이가 있는 환자에서의 안전성은 확립되지 않았습니다.
5.2 심혈관계 이상반응
심부전, 심근병증, 심근 허혈 및 심근경색을 포함한 심혈관계 이상반응이 보고되었으며, 이 중 일부는 치명적이었습니다. Pooled safety population에서 3%의 환자가 심부전을 경험했으며, 심부전 환자의 71%는 회복된 것으로 보고되었습니다. 치명적인 심부전은 1% 미만의 환자에서 보고되었습니다.
RCC 술 후 보조요법 연구에서 11명의 환자가 Grade 2의 ejection fraction 감소(좌심실 박출률[LVEF] 40%~50% 및 기저치 대비 10%~19% 감소)를 경험했습니다. 이 중 3명의 환자에서는 마지막 측정 시점까지 박출률이 50% 이상 또는 기저치로 회복되지 않았습니다. Sunitinib malate를 투여받은 환자 중 울혈성 심부전(CHF)으로 진단된 환자는 없었습니다.
심근경색(중증/불안정 협심증 포함), 관상동맥/말초동맥 우회술, 증상이 있는 CHF, 뇌혈관 사고 또는 일과성 허혈 발작, 폐색전증 등 sunitinib malate 투여 12개월 이내에 심장 이상반응이 발생한 환자는 sunitinib malate 임상시험에서 제외되었습니다. 이전에 anthracycline을 사용했거나 심장 방사선 치료를 받은 환자도 일부 연구에서 제외되었습니다. 이러한 동반 질환이 있는 환자에서 좌심실 기능부전 발생 위험이 더 높을 수 있는지는 알려져 있지 않습니다.
기저치 및 임상적으로 필요할 때 LVEF를 모니터링하는 것을 고려하십시오. 울혈성 심부전(CHF)의 임상 징후 및 증상이 있는 환자는 주의 깊게 모니터링하십시오. CHF의 임상적 징후가 나타나는 환자에서는 sunitinib malate 캡슐 투여를 중단하십시오. CHF의 임상적 증거는 없지만 박출률이 기저치 대비 20% 초과 50% 미만으로 감소했거나 기저치 박출률을 얻지 못한 경우 정상 하한치 미만인 환자에서는 sunitinib malate 투여를 중단 및/또는 감량하십시오.
5.3 QT 간격 연장 및 Torsade de Pointes
Sunitinib malate는 용량 의존적으로 QT 간격 연장을 유발할 수 있으며, 이로 인해 Torsade de Pointes를 포함한 심실 부정맥 위험이 증가할 수 있습니다. Torsade de Pointes는 0.1% 미만의 환자에서 관찰되었습니다.
QT 간격 연장, 부정맥 약물을 복용 중인 환자, 관련 심장 질환, 서맥 또는 전해질 이상이 있는 환자 등 QT 간격 연장 발생 위험이 더 높은 환자를 모니터링하십시오. Sunitinib malate 치료 중 심전도 및 전해질(예: 마그네슘, 칼륨)의 정기적인 모니터링을 고려하십시오. Sunitinib malate를 강력한 CYP3A4 억제제 또는 QT 간격 연장을 유발하는 것으로 알려진 약물과 병용 투여할 때는 QT 간격을 더 자주 모니터링하십시오. Sunitinib malate 용량 감량을 고려하십시오[용법용량(2.5) 및 약물 상호작용(7.2) 참조].
5.4 고혈압
Pooled safety population에서 29%의 환자가 고혈압을 경험했습니다. Grade 3 고혈압은 7%의 환자에서 보고되었고, Grade 4 고혈압은 0.2%에서 보고되었습니다.
기저치 및 임상적으로 필요할 때 혈압을 모니터링하십시오. 필요에 따라 항고혈압 치료를 시작 및/또는 조정하십시오. Grade 3 고혈압의 경우 Grade ≤1 또는 기저치로 해결될 때까지 sunitinib malate 투여를 보류한 다음 감량하여 sunitinib malate 투여를 재개하십시오. Grade 4 고혈압이 발생한 환자에서는 sunitinib malate 투여를 중단하십시오.
5.5 출혈 이상반응 및 장기 천공
위장관계, 호흡기계, 종양, 비뇨기계 및 뇌를 포함한 출혈 이상반응이 발생했으며, 이 중 일부는 치명적이었습니다. Pooled safety population에서 30%의 환자가 출혈 이상반응을 경험했으며, 이 중 4.2%의 환자에서 Grade 3 또는 4의 이상반응이 발생했습니다. 비출혈이 가장 흔한 출혈 이상반응이었고 위장관 출혈이 가장 흔한 Grade 3~5 이상반응이었습니다.
Sunitinib malate 치료를 받은 환자에서 종양 관련 출혈이 관찰되었습니다. 이러한 이상반응은 갑자기 발생할 수 있으며, 폐종양의 경우 중증 및 생명을 위협하는 객혈 또는 폐출혈로 나타날 수 있습니다. 전이성 RCC, GIST 및 전이성 폐암 치료를 위해 sunitinib malate를 투여받은 환자에서 폐출혈이 관찰되었으며, 일부는 치명적인 결과를 초래했습니다. Sunitinib malate는 폐암 환자에서의 사용이 승인되지 않았습니다.
위장관 천공을 포함한 심각하고 때로는 치명적인 위장관 합병증이 sunitinib malate로 치료받은 복강내 악성종양 환자에서 보고되었습니다.
출혈 이상반응의 임상 평가 시 일련의 전체 혈구 수(CBC) 및 신체 검사를 포함하십시오. Grade ≤1 또는 기저치로 해결될 때까지 Grade 3 또는 4 출혈 이상반응 발생 시 sunitinib malate 투여를 중단한 다음 감량하여 sunitinib malate 투여를 재개하십시오.
Grade 3 또는 4 출혈 이상반응이 해결되지 않은 환자에서는 sunitinib malate 투여를 중단하십시오.
5.6 종양용해증후군(TLS)
임상시험에서 주로 RCC 또는 GIST 환자에서 종양용해증후군(TLS)이 발생했으며, 이 중 일부는 치명적이었습니다. 시판 후 경험에서도 보고되었습니다. 일반적으로 TLS 위험이 있는 환자는 치료 전 종양 부담이 높은 환자입니다. 이러한 환자에서 TLS를 모니터링하고 적절히 관리하십시오.
5.7 혈전성 미세혈관병증(TMA)
때로 신부전이나 치명적인 결과로 이어지는 혈전성 혈소판감소성 자반증 및 용혈성 요독증후군을 포함한 혈전성 미세혈관병증(TMA)이 sunitinib malate의 단독요법 및 bevacizumab과 병용 투여한 임상시험 및 시판 후 경험에서 발생했습니다. Sunitinib malate는 bevacizumab과 병용하여 사용하도록 승인되지 않았습니다. TMA가 발생한 환자에서는 sunitinib malate 캡슐 투여를 중단하십시오. Sunitinib malate 중단 후 TMA의 효과가 회복된 것이 관찰되었습니다.
5.8 단백뇨
단백뇨와 신증후군이 보고되었습니다. 이러한 일부 사례는 신부전 및 치명적인 결과를 초래했습니다. 단백뇨 발생 또는 악화 여부를 모니터링하십시오. 치료 중 기저치 및 정기 요 검사를 실시하고, 임상적으로 필요할 때 24시간 요단백 후속 측정을 수행하십시오. 24시간 요단백이 3g 이상인 경우 sunitinib malate 투여를 중단하고 감량하십시오. 신증후군 또는 용량 감량에도 불구하고 24시간 요단백이 3g 이상 반복되는 환자의 경우 sunitinib malate 캡슐 투여를 중단하십시오. 중등도 내지 중증 단백뇨 환자에서 sunitinib malate 지속 투여의 안전성은 평가되지 않았습니다.
5.9 피부 독성
치명적인 경우도 있었던 다형홍반(EM), 스티븐스-존슨 증후군(SJS), 독성 표피 괴사융해(TEN)를 포함한 중증 피부 이상반응이 보고되었습니다. 이러한 중증 피부 이상반응에 대해 sunitinib malate 캡슐 투여를 영구 중단하십시오.
회음부 괴사성 근막염 및 누공 형성에 이차적인 치명적인 사례를 포함하여 sunitinib malate 투여 환자에서 보고되었습니다. 괴사성 근막염이 발생한 환자에서는 sunitinib malate 캡슐 투여를 중단하십시오.
5.10 가역성 후백질뇌증 증후군(RPLS)
치명적인 사례도 있었던 가역성 후백질뇌증 증후군(RPLS)이 환자의 1% 미만에서 보고되었습니다. 환자는 고혈압, 두통, 경계 저하, 정신 기능 변화, 피질 실명을 포함한 시력 상실을 나타낼 수 있습니다. 진단을 확인하려면 자기공명영상(MRI)이 필요합니다.
RPLS가 발생한 환자에서는 sunitinib malate 투여를 중단하십시오.
5.11 갑상선 기능 장애
갑상선 기능 항진증이 있었고, 그 중 일부는 sunitinib malate의 임상시험 및 시판 후 경험에서 갑상선 기능 저하증이 뒤따랐습니다. 기저치, 치료 중 정기적으로, 임상적으로 필요할 때 갑상선 기능을 모니터링하십시오. Sunitinib malate 치료 중 갑상선 기능 저하증, 갑상선 기능 항진증, 갑상선염을 포함한 갑상선 기능 장애의 징후와 증상이 나타나는지 환자를 면밀히 모니터링하십시오. 갑상선 기능 장애에 대해 적절하게 치료를 시작 및/또는 조정하십시오.
5.12 저혈당증
Sunitinib malate는 의식 소실을 초래하거나 입원이 필요할 수 있는 증상성 저혈당증을 유발할 수 있습니다. 통합 안전성 집단에서 sunitinib malate로 치료받은 환자의 2%에서 저혈당증이 발생했습니다. 진행성 RCC(연구 3) 및 GIST(연구 1)에 대해 sunitinib malate로 치료받은 환자의 2%(n=577), pNET에 대해 sunitinib malate로 치료받은 환자의 약 10%(연구 6)(n=83)에서 임상시험 중 저혈당증이 발생했습니다. pNET에 대해 sunitinib malate로 치료받은 환자의 경우, 저혈당증을 경험한 모든 환자에서 치료 전 포도당 항상성 이상이 존재하지는 않았습니다. 당뇨병 환자에서 혈당 수치 감소가 더 심할 수 있습니다.
기저치, 치료 중 정기적으로, 임상적으로 필요할 때, sunitinib malate 중단 후 혈당 수치를 확인하십시오. 당뇨병 환자의 경우 저혈당증 위험을 최소화하기 위해 당뇨병 치료제 조정 여부를 평가하십시오.
5.13 악골 골괴사증(ONJ)
Sunitinib malate로 치료받은 환자에서 악골 골괴사증(ONJ)이 발생했습니다. Bisphosphonate 또는 치과 질환/침습적 치과 시술과 같은 다른 위험 인자에 동시 노출되면 ONJ의 위험이 증가할 수 있습니다. Sunitinib malate 치료 시작 전 및 치료 중 정기적으로 구강 검사를 수행하십시오. 양호한 구강 위생 습관에 대해 환자에게 조언하십시오. 가능하다면 예정된 치과 수술 또는 침습적 치과 시술 전 최소 3주 동안 sunitinib malate 투여를 보류하십시오. ONJ 발생 시 완전히 해결될 때까지 sunitinib malate 투여를 보류하십시오. 악골 골괴사증 해결 후 sunitinib malate 재개의 안전성은 확립되지 않았습니다.
5.14 상처 치유 장애
Sunitinib malate를 투여받은 환자에서 상처 치유 장애가 보고되었습니다[이상반응 참조(6.2)].
선택적 수술 전 최소 3주 동안 sunitinib malate 투여를 보류하십시오. 대수술 후 최소 2주 동안 및 적절한 상처 치유가 이루어질 때까지 투여하지 마십시오. 상처 치유 합병증 해결 후 sunitinib malate 재개의 안전성은 확립되지 않았습니다.
5.15 배아-태아 독성
동물 연구 결과 및 작용기전에 근거할 때, sunitinib malate는 임신한 여성에게 투여 시 태아에게 위해를 줄 수 있습니다. 기관형성기 동안 임신한 랫트와 토끼에 sunitinib을 투여한 결과, 권장 일일 용량(RDD) 50mg을 투여받은 환자에서의 복합 전신 노출[sunitinib과 그 활성 대사체의 복합 AUC(area under the curve)]의 각각 약 5.5배 및 0.3배에서 기형발생이 나타났습니다.
태아에 대한 잠재적 위험성을 임신한 여성에게 알리십시오. 가임기 여성에게 sunitinib malate 치료 중 및 최종 투여 후 4주 동안 효과적인 피임법을 사용하도록 조언하십시오[특정 집단에서의 사용 참조(8.1, 8.3)].
6 부작용 반응
다음과 같이 임상적으로 중요한 이상반응은 라벨의 다른 부분에 설명되어 있습니다.
- 간독성 [경고 및 주의사항 (5.1) 참조]
- 심혈관계 이상반응 [경고 및 주의사항 (5.2) 참조]
- QT 간격 연장 및 토르사드 데 포인트 [경고 및 주의사항 (5.3) 참조]
- 고혈압 [경고 및 주의사항 (5.4) 참조]
- 출혈 이상반응 [경고 및 주의사항 (5.5) 참조]
- 종양 용해 증후군 [경고 및 주의사항 (5.6) 참조]
- 혈전성 미세혈관병증 [경고 및 주의사항 (5.7) 참조]
- 단백뇨 [경고 및 주의사항 (5.8) 참조]
- 피부 독성 [경고 및 주의사항 (5.9) 참조]
- 가역성 후부 뇌병증 증후군 [경고 및 주의사항 (5.10) 참조]
- 갑상선 기능 장애 [경고 및 주의사항 (5.11) 참조]
- 저혈당증 [경고 및 주의사항 (5.12) 참조]
- 악골 괴사 [경고 및 주의사항 (5.13) 참조]
- 상처 치유 장애 [경고 및 주의사항 (5.14) 참조]
6.1 임상시험 경험
임상시험은 다양한 조건 하에서 실시되므로 한 약물의 임상시험에서 관찰된 이상반응 발생률을 다른 약물의 임상시험 발생률과 직접 비교할 수 없으며, 실제 발생률을 반영하지 않을 수 있습니다.
경고 및 주의사항 부분에 기술된 통합 안전성 집단은 GIST, RCC(전이성 및 보조요법) 또는 pNET 환자 7527명에게 sunitinib malate를 투여한 결과를 반영합니다. 이 통합 안전성 집단에서 가장 흔한 이상반응(≥25%)은 피로/무력증, 설사, 점막염/구내염, 구역, 식욕 감소/식욕부진, 구토, 복통, 손발증후군, 고혈압, 출혈 이상반응, 미각 변화/이상 미각, 소화불량 및 혈소판 감소증이었습니다.
위장관 기질종양
Sunitinib malate의 안전성은 이전에 GIST 치료를 받은 환자를 sunitinib malate 50 mg을 1일 1회 4주 투여/2주 휴약(n=202) 또는 위약(n=102)으로 무작위 배정한 이중 맹검, 위약 대조 3상 연구(Study 1)에서 평가되었습니다. 맹검 연구 치료 기간의 중앙값은 sunitinib malate 군에서 2주기(평균: 3주기; 범위: 1~9주기), 위약군에서 1주기(평균: 1.8주기; 범위: 1~6주기)였습니다.
이상반응으로 인한 영구 투여 중단은 sunitinib malate 군에서 7%에서 발생했습니다. 용량 감량은 11%, 투여 지연은 29%의 sunitinib malate 투여 환자에서 발생했습니다.
표 3은 Study 1의 이상반응을 요약합니다.
표 3. Study 1에서 이중 맹검 치료군의 GIST 환자 중 sunitinib malate를 투여받은 환자의 10% 이상에서 발생하고 위약군보다 더 흔한 이상반응*
| 이상반응 | GIST | |||
| Sunitinib Malate (N=202) |
위약 (N=102) |
|||
| 전 등급 % | 3-4등급 % | 전 등급 % | 3-4등급 % | |
| 이상반응(모든 등급) | 94 | 56 | 97 | 51 |
| 위장관계 설사 점막염/구내염 변비 |
40 29 20 |
4 1 0 |
27 18 14 |
0 2 2 |
| 대사/영양 식욕부진a 무력증 |
33 22 |
1 5 |
29 11 |
5 3 |
| 피부과 피부 변색 발진 손발증후군 |
30 14 14 |
0 1 4 |
23 9 10 |
0 0 3 |
| 신경과 미각 변화 |
21 | 0 | 12 | 0 |
| 심혈관 고혈압 |
15 | 4 | 11 | 0 |
| 근골격계 근육통/사지통 |
14 | 1 | 9 | 1 |
* 이상반응 공통 용어 기준(CTCAE), 버전 3.
약어: GIST=위장관 기질종양; N=환자 수.
a 식욕 감소 포함. 기타 임상적으로 관련 있는 이상반응으로는 sunitinib malate 투여 환자의 6%에서 구내염 외 구강통, 7%에서 모발 변색, 5%에서 탈모가 있었습니다.
표 4는 Study 1의 실험실 검사치 이상을 요약합니다.
표 4. Study 1에서 이중 맹검 치료군의 GIST 환자 중 10% 이상에서 관찰된 실험실 검사치 이상*
| 검사실 이상 | GIST | |||
| Sunitinib Malate (N=202) | 위약 (N=102) | |||
| 모든 등급*% | 3-4등급*,a% | 모든 등급*% | 3-4등급*,b% | |
| 모든 검사실 이상 | 34 | 22 | ||
| 혈액학 호중구 감소 림프구 감소 혈소판 감소 헤모글로빈 감소 |
53 38 38 26 |
10 0 5 3 |
4 16 4 22 |
0 0 0 2 |
| 위장관계 AST/ALT 증가 Lipase 증가 Alkaline phosphatase 증가 Amylase 증가 총 bilirubin 증가 간접 bilirubin 증가 |
39 25 24 17 16 10 |
2 10 4 5 10 |
23 17 21 12 8 4 |
1 7 4 3 0 0 |
| 신장/대사 Creatinine 증가 Potassium 감소 Sodium 증가 |
12 12 10 |
1 1 0 |
7 4 4 |
0 0 1 |
| 심장 LVEF 감소 |
11 | 1 | 3 | 0 |
*Common Terminology Criteria for Adverse Events (CTCAE), version 3
약어: ALT=alanine aminotransferase; AST=aspartate aminotransferase; GIST=gastrointestinal stromal tumor; LVEF=left ventricular ejection fraction; N=환자 수.
a Sunitinib malate를 투여받은 환자에서 4등급 검사실 이상은 alkaline phosphatase (1%), lipase (2%), creatinine (1%), potassium 감소 (1%), 호중구 (2%), 헤모글로빈 (2%), 혈소판 (1%)을 포함했다.
b 위약을 투여받은 환자에서 4등급 검사실 이상은 amylase (1%), lipase (1%), 헤모글로빈 (2%)을 포함했다.
중간 분석 후 연구는 눈가림이 해제되었고 위약군 환자들에게 open-label sunitinib malate를 투여받을 기회가 주어졌다[임상 연구 (14.1) 참조]. Sunitinib malate군에 무작위 배정된 241명의 환자 중 이중 눈가림 및 open-label 단계 모두에서 sunitinib malate를 투여받은 139명에서 sunitinib malate 치료의 중앙 기간은 6주기(평균: 8.5; 범위: 1–44)였다. 최종적으로 open-label sunitinib malate 치료를 받은 255명의 환자에서 눈가림 해제 시점부터 치료의 중앙 기간은 6주기(평균: 7.8; 범위: 1–37)였다.
Sunitinib malate를 투여받은 환자의 20%에서 이상반응으로 인한 영구 중단이 발생했다. Sunitinib malate를 투여받은 환자의 46%에서 용량 중단이, 28%에서 용량 감량이 발생했다. Open-label 단계에서 sunitinib malate를 투여받은 환자에서 가장 흔한 3등급 또는 4등급 이상반응은 피로(10%), 고혈압(8%), 무력증(5%), 설사(5%), 수족 증후군(5%), 오심(4%), 복통(3%), 식욕부진(3%), 점막염(2%), 구토(2%), 갑상선기능저하증(2%)이었다.
진행성 신세포암
Sunitinib malate의 안전성은 이전에 치료받지 않은 국소 진행성 또는 전이성 RCC 환자가 sunitinib malate 50 mg을 4/2 스케줄로 매일(n=375) 또는 interferon alfa 9 MIU(n=360)를 투여받은 이중 눈가림, 활성 대조 시험인 연구 3에서 평가되었다. 치료의 중앙 기간은 sunitinib malate 치료에서 11.1개월(범위: 0.4~46.1), interferon alfa 치료에서 4.1개월(범위: 0.1~45.6)이었다.
Sunitinib malate군 환자의 20%에서 이상반응으로 인한 영구 중단이 발생했다. Sunitinib malate를 투여받은 환자의 54%에서 용량 중단이, 52%에서 용량 감량이 발생했다.
표 5는 연구 3의 이상반응을 요약한 것이다.
표 5. 연구 3에서 Sunitinib Malate 또는 Interferon Alfa를 투여받은 RCC 환자의 10% 이상에서 보고된 이상반응*
| 부작용 | 치료 경험이 없는 신장암 | |||
| 수니티닙 말레이트 (N=375) |
인터페론 알파 (N=360) |
|||
| 모든 등급% | 3-4등급a% | 모든 등급% | 3-4등급b% | |
| 부작용(전체) | 99 | 77 | 99 | 55 |
| 위장관계 | ||||
| 설사 | 66 | 10 | 21 | <1 |
| 메스꺼움 | 58 | 6 | 41 | 2 |
| 점막염/구내염 | 47 | 3 | 5 | <1 |
| 구토 | 39 | 5 | 17 | 1 |
| 소화불량 | 34 | 2 | 4 | 0 |
| 복통c | 30 | 5 | 12 | 1 |
| 변비 | 23 | 1 | 14 | <1 |
| 구강건조 | 13 | 0 | 7 | <1 |
| 구강통증 | 14 | <1 | 1 | 0 |
| 방귀 | 14 | 0 | 2 | 0 |
| 위식도역류질환/식도염 | 12 | <1 | 1 | 0 |
| 혀통증 | 11 | 0 | 1 | 0 |
| 치핵 | 10 | 0 | 2 | 0 |
| 전신 | ||||
| 피로 | 62 | 15 | 56 | 15 |
| 권태감 | 26 | 11 | 22 | 6 |
| 발열 | 22 | 1 | 37 | <1 |
| 체중감소 | 16 | <1 | 17 | 1 |
| 오한 | 14 | 1 | 31 | 0 |
| 가슴통증 | 13 | 2 | 7 | 1 |
| 유사독감 | 5 | 0 | 15 | <1 |
| 대사/영양 식욕부진d |
48 | 3 | 42 | 2 |
| 신경계 | ||||
| 미각이상e | 47 | <1 | 15 | 0 |
| 두통 | 23 | 1 | 19 | 0 |
| 현기증 | 11 | <1 | 14 | 1 |
| 출혈/출혈 모든 부위 출혈 |
37 | 4f | 10 | 1 |
| 심혈관계 | ||||
| 고혈압 | 34 | 13 | 4 | <1 |
| 말초부종 | 24 | 2 | 5 | 1 |
| 박출계수 감소 | 16 | 3 | 5 | 2 |
| 피부과 | ||||
| 발진 | 29 | 2 | 11 | <1 |
| 손발증후군 | 29 | 8 | 1 | 0 |
| 피부변색/황달 | 25 | <1 | 0 | 0 |
| 피부건조 | 23 | <1 | 7 | 0 |
| 머리카락 색 변화 | 20 | 0 | <1 | 0 |
| 탈모 | 14 | 0 | 9 | 0 |
| 홍반 | 12 | <1 | 1 | 0 |
| 가려움증 | 12 | <1 | 7 | <1 |
| 근골격계 | ||||
| 사지통증/사지불편감 | 40 | 5 | 30 | 2 |
| 관절통 | 30 | 3 | 19 | 1 |
| 요통 | 28 | 5 | 14 | 2 |
| 호흡기계 | ||||
| 기침 | 27 | 1 | 14 | <1 |
| 호흡곤란 | 26 | 6 | 20 | 4 |
| 코인두염 | 14 | 0 | 2 | 0 |
| 인후통증 | 14 | <1 | 2 | 0 |
| 상기도감염 | 11 | <1 | 2 | 0 |
| 내분비계 갑상선기능저하증 |
16 | 2 | 1 | 0 |
| 정신과 불면증 우울증g |
15 11 |
<1 0 |
10 14 |
0 1 |
*부작용 용어 기준(CTCAE), 버전 3.
약어: ARs=부작용; N=환자 수; RCC=신장암.
a 수니티닙 말레이트 투여 환자의 4등급 부작용에는 요통(1%), 관절통(<1%), 호흡곤란(<1%), 권태감(<1%), 피로(<1%), 사지통증(<1%), 발진(<1%) 등이 있다.
b 인터페론 알파 투여 환자의 4등급 부작용에는 호흡곤란(1%), 피로(1%), 복통(<1%), 우울증(<1%) 등이 있다.
c 측면통을 포함한다.
d 식욕감퇴를 포함한다.
e 미각상실, 미각저하, 미각이상을 포함한다.
f 위장관 출혈로 인한 5등급 사례 1건 포함.
g 우울감을 포함한다.
표 6에서는 3상 연구에서 보고된 실험실 검사 이상치를 요약하였다.
표 6. 3상 연구에서 수니티닙 말레이트 또는 인터페론 알파 투여 신장암 환자의 10% 이상에서 보고된 실험실 검사 이상치
| 실험실 이상 | 치료 경험이 없는 신세포암 | |||
| 수니티닙 말산염 (N=375) | 인터페론 알파 (N=360) | |||
| 모든 등급*% | 3-4등급*,a% | 모든 등급*% | 3-4등급*,b% | |
| 혈액학 | ||||
| 헤모글로빈 감소 | 79 | 8 | 69 | 5 |
| 호중구 감소 | 77 | 17 | 49 | 9 |
| 혈소판 감소 | 68 | 9 | 24 | 1 |
| 림프구 감소 | 68 | 18 | 68 | 26 |
| 신장/대사 | ||||
| 크레아티닌 증가 | 70 | <1 | 51 | <1 |
| 크레아틴 키나아제 증가 | 49 | 2 | 11 | 1 |
| 요산 증가 | 46 | 14 | 33 | 8 |
| 칼슘 감소 | 42 | 1 | 40 | 1 |
| 인 감소 | 31 | 6 | 24 | 6 |
| 알부민 감소 | 28 | 1 | 20 | 0 |
| 포도당 증가 | 23 | 6 | 15 | 6 |
| 나트륨 감소 | 20 | 8 | 15 | 4 |
| 포도당 감소 | 17 | 0 | 12 | <1 |
| 칼륨 증가 | 16 | 3 | 17 | 4 |
| 칼슘 증가 | 13 | <1 | 10 | 1 |
| 칼륨 감소 | 13 | 1 | 2 | <1 |
| 나트륨 증가 | 13 | 0 | 10 | 0 |
| 소화기계 | ||||
| AST 증가 | 56 | 2 | 38 | 2 |
| 리파아제 증가 | 56 | 18 | 46 | 8 |
| ALT 증가 | 51 | 3 | 40 | 2 |
| 알칼리성 인산분해 효소 증가 | 46 | 2 | 37 | 2 |
| 아밀라아제 증가 | 35 | 6 | 32 | 3 |
| 총 빌리루빈 증가 | 20 | 1 | 2 | 0 |
| 간접 빌리루빈 증가 | 13 | 1 | 1 | 0 |
*이상 반응 일반 용어 기준(CTCAE), 버전 3.
약어: ALT=아라닌 아미노전이효소; AST=아스파르테이트 아미노전이효소; N=환자 수; RCC=신세포암.
a 수니티닙 말산염에서 4등급 실험실 이상에는 요산(14%), 리파아제(3%), 호중구(2%), 림프구(2%), 헤모글로빈(2%), 혈소판(1%), 아밀라아제(1%), ALT(<1%), 크레아틴 키나아제(<1%), 크레아티닌(<1%), 포도당 증가(<1%), 칼슘 감소(<1%), 인(<1%), 칼륨 증가(<1%), 나트륨 감소(<1%).
b 인터페론 알파에서 4등급 실험실 이상에는 요산(8%), 림프구(2%), 리파아제(1%), 호중구(1%), 아밀라아제(<1%), 칼슘 증가(<1%), 포도당 감소(<1%), 칼륨 증가(<1%), 헤모글로빈(<1%)이 포함되었습니다.
신세포암에서의 장기 안전성
전이성 신세포암 환자에서의 수니티닙 말산염의 장기 안전성은 1차 치료, 베바시주맙 불응성, 사이토카인 불응성 치료 환경에서 수행된 9건의 완료된 임상 시험에 걸쳐 분석되었습니다. 이 분석에는 5739명의 환자가 포함되었고, 그중 807명(14%)은 최소 2년간, 365명(6%)은 최소 3년간 치료를 받았습니다. 수니티닙 말산염의 장기 치료는 새로운 유형의 이상반응과 관련이 없는 것으로 나타났습니다. 후기 시점에서 이상반응의 연간 발생률 증가는 없는 것으로 보였습니다. 갑상선기능저하증은 2년차 치료 기간 동안 증가했으며 새로운 증례는 4년차까지 보고되었습니다.
신세포암의 보조 치료
수니티닙 말산염의 안전성은 S-TRAC에서 평가되었는데, 이는 무작위 배정, 이중 눈가림, 위약 대조 시험으로 신세포암 절제술을 받은 환자에게 수니티닙 말산염 50mg을 1일 1회 4주 투여/2주 휴약(n=306) 또는 위약(n=304)을 투여했습니다. 치료 기간의 중앙값은 수니티닙 말산염에서 12.4개월(범위: 0.13-14.9), 위약에서 12.4개월(범위: 0.03-13.7)이었습니다.
이상반응으로 인한 영구 중단은 수니티닙 말산염 군에서 28%에서 발생했습니다. 2% 이상의 환자에서 영구 중단을 초래한 이상반응에는 수족증후군 및 피로/무력증이 있습니다. 투여 중단은 54%에서, 용량 감소는 46%의 수니티닙 말산염 투여 환자에서 발생했습니다.
표 7은 S-TRAC에서 발생한 이상반응을 요약합니다.
표 7. S-TRAC에서 위약보다 수니티닙 말산염 투여 신세포암 환자에서 10% 이상 더 많이 보고된 이상반응
| 이상반응 | 신장암 보조 요법 | |||
|---|---|---|---|---|
| 수니티닙 말레이트 (N=306) | 위약 (N=304) | |||
| 전체 등급% | 3-4 등급% |
전체 등급% |
3-4 등급% |
|
| 모든 이상반응 | 99 | 60 | 88 | 15 |
| 위장관계 | ||||
| 구강 점막염/구내 염증† | 61 | 6 | 15 | 0 |
| 설사 | 57 | 4 | 22 | <1 |
| 구역 | 34 | 2 | 15 | 0 |
| 소화 불량 | 27 | 1 | 7 | 0 |
| 복통‡ | 25 | 2 | 9 | <1 |
| 구토 | 19 | 2 | 7 | 0 |
| 변비 | 12 | 0 | 11 | 0 |
| 전신 | ||||
| 피로/권태 | 57 | 8 | 34 | 2 |
| 국소 부종§ | 18 | <1 | <1 | 0 |
| 발열 | 12 | <1 | 6 | 0 |
| 피부과 | ||||
| 손발 증후군 | 50 | 16 | 10 | <1 |
| 발진¶ | 24 | 2 | 12 | 0 |
| 모발 변색 | 22 | 0 | 2 | 0 |
| 피부 변색/황달 | 18 | 0 | 1 | 0 |
| 건조한 피부 | 14 | 0 | 6 | 0 |
| 심장 | ||||
| 고혈압# | 39 | 8 | 14 | 1 |
| 부종/말초부종 | 10 | <1 | 7 | 0 |
| 신경계 | ||||
| 미각 변화Þ | 38 | <1 | 6 | 0 |
| 두통 | 19 | <1 | 12 | 0 |
| 내분비계 | ||||
| 갑상선 저하증/TSH 증가 | 24 | <1 | 4 | 0 |
| 출혈 | ||||
| 모든 부위 출혈 이상반응S | 24 | <1 | 5 | <1 |
| 대사/영양 | ||||
| 식욕 감퇴/식욕 감소 | 19 | <1 | 5 | 0 |
| 근골격계 | ||||
| 사지 통증 | 15 | <1 | 7 | 0 |
| 관절통 | 11 | <1 | 10 | 0 |
*CTCAE(Common Terminology Criteria for Adverse Events) 버전 3. 약어: ARs=이상반응, N=환자 수, RCC=신장암.
a 점막 염증, 아프타성 구내염, 구강 궤양, 혀 궤양, 구강인두 통증, 구강 통증을 포함합니다.
b 복통, 하복부 통증, 상복부 통증을 포함합니다.
c 국소 부종, 안면 부종, 안검 부종, 안와 주위 부종, 안면 부종, 안구 부종을 포함합니다.
d 피부염, 건선양 피부염, 벗겨지는 발진, 외음부 발진, 발진, 홍반성 발진, 구진성 발진, 전신 발진, 반점상 발진, 구진반점상 발진, 구진 발진, 소양성 발진을 포함합니다.
e 고혈압, 혈압 상승, 수축기 혈압 상승, 확장기 혈압 상승, 고혈압 위기를 포함합니다.
f 미각 상실, 미각 감퇴, 미각 변화를 포함합니다.
g 비출혈, 치은 출혈, 직장 출혈, 객혈, 항문 출혈, 상부 위장관 출혈, 혈뇨를 포함합니다.
수니티닙 말레이트 투여 환자에서 발생한 4등급 이상반응에는 손발 증후군(1%), 피로(<1%), 복통(<1%), 구내염(<1%), 발열(<1%) 등이 있었습니다.
수니티닙 말레이트 투여 환자 중 2% 이상에서 발생한 3-4등급 검사실 이상치에는 호중구 감소증(13%), 혈소판 감소증(5%), 백혈구 감소증(3%), 림프구 감소증(3%), 알라닌 아미노전이효소 상승(2%), 아스파르트산 아미노전이효소 상승(2%), 고혈당(2%), 고칼륨혈증(2%) 등이 있습니다.
진행성 췌장 신경내분비종양
수니티닙 말레이트의 안전성은 무작위 배정 이중 맹검 위약 대조 연구 6에서 평가되었으며, 여기서 진행성 pNET 환자들은 수니티닙 말레이트 37.5mg을 1일 1회 복용(n=83) 혹은 위약(n=82)을 투여받았습니다. 수니티닙 말레이트군의 중앙 치료 기간은 139일(범위: 13-532일), 위약군의 중앙 치료 기간은 113일(범위: 1-614일)이었습니다. 수니티닙 말레이트군에서 19명(23%), 위약군에서 4명(5%)의 환자가 1년 이상 연구에 참여하였습니다.
이상반응으로 인한 영구 중단은 수니티닙 말레이트군에서 22%에서 발생하였습니다. 투여 중단이 30%, 용량 감소가 31%의 환자에서 일어났습니다.
표 8은 연구 6에서 발생한 이상반응을 요약합니다.
표 8. 연구 6에서 pNET 환자 중 수니티닙 말레이트 투여군에서 10% 이상 발생하고 위약 투여군보다 높은 빈도로 보고된 이상반응*
| 이상반응 | pNET | |||
|---|---|---|---|---|
| Sunitinib Malate (N=83) | 위약 (N=82) | |||
| 전체 등급% | 3-4등급†% | 전체 등급% | 3-4등급% | |
| * 이상 사례의 일반 용어 기준(CTCAE), 버전 3. 약어: N=환자 수; pNET=췌장 신경내분비종양. a Sunitinib malate를 투여한 환자에서 4등급 이상반응에는 피로감(1%)이 포함되었습니다. b 아프타성 구내염, 잇몸 통증, 치은염, 설염, 설통증, 구강 궤양, 구강 불편감, 구강 통증, 혀 궤양, 점막 건조증, 점막 염증 및 구강 건조증이 포함됩니다. c 복부 불편감, 복통 및 상복부 통증이 포함됩니다. d 객혈, 혈변, 혈종, 객혈, 출혈, 흑색변 및 비정상적 자궁 출혈이 포함됩니다. |
||||
| 모든 이상반응 | 99 | 54 | 95 | 50 |
| 위장관 | ||||
| 설사 | 59 | 5 | 39 | 2 |
| 구내염/구강 증후군‡ | 48 | 6 | 18 | 0 |
| 구역질 | 45 | 1 | 29 | 1 |
| 복통§ | 39 | 5 | 34 | 10 |
| 구토 | 34 | 0 | 31 | 2 |
| 소화불량 | 15 | 0 | 6 | 0 |
| 전신 | ||||
| 기력 저하 | 34 | 5 | 27 | 4 |
| 피로감 | 33 | 5 | 27 | 9 |
| 체중 감소 | 16 | 1 | 11 | 0 |
| 피부과 | ||||
| 모발 변색 | 29 | 1 | 1 | 0 |
| 손발 증후군 | 23 | 6 | 2 | 0 |
| 발진 | 18 | 0 | 5 | 0 |
| 피부 건조 | 15 | 0 | 11 | 0 |
| 심장 | ||||
| 고혈압 | 27 | 10 | 5 | 1 |
| 출혈/출혈 | ||||
| 출혈 사건 | 22 | 0 | 10 | 4 |
| 코출혈 | 21 | 1 | 5 | 0 |
| 신경학 | ||||
| 미각 장애 | 21 | 0 | 5 | 0 |
| 두통 | 18 | 0 | 13 | 1 |
| 정신과 | ||||
| 불면증 | 18 | 0 | 12 | 0 |
| 근골격계 | ||||
| 관절통 | 15 | 0 | 6 | 0 |
표 9. 연구 6에서 Sunitinib Malate를 투여받은 pNET 환자의 10% 이상에서 보고된 실험실 이상
| 실험실 이상 | ET | |||
| Sunitinib Malate | 위약 | |||
| 전체 등급* % |
3-4등급*,a % |
전체 등급* % |
3-4등급*,b % |
|
| 위장관 | ||||
| AST 증가 | 72 | 5 | 70 | 3 |
| 알칼라인 인산가수분해효소 증가 | 63 | 10 | 70 | 11 |
| ALT 증가 | 61 | 4 | 55 | 3 |
| 총 빌리루빈 증가 | 37 | 1 | 28 | 4 |
| 아밀라아제 증가 | 20 | 4 | 10 | 1 |
| 리파아제 증가 | 17 | 5 | 11 | 4 |
| 혈액학 | ||||
| 호중구 감소 | 71 | 16 | 16 | 0 |
| 혈색소 감소 | 65 | 0 | 55 | 1 |
| 혈소판 감소 | 60 | 5 | 15 | 0 |
| 림프구 감소 | 56 | 7 | 35 | 4 |
| 신장/대사 | ||||
| 혈당 증가 | 71 | 12 | 78 | 18 |
| 알부민 감소 | 41 | 1 | 37 | 1 |
| 인 감소 | 36 | 7 | 22 | 5 |
| 칼슘 감소 | 34 | 0 | 19 | 0 |
| 나트륨 감소 | 29 | 2 | 34 | 3 |
| 크레아티닌 증가 | 27 | 5 | 28 | 5 |
| 혈당 감소 | 22 | 2 | 15 | 4 |
| 칼륨 감소 | 21 | 4 | 14 | 0 |
| 마그네슘 감소 | 19 | 0 | 10 | 0 |
| 칼륨 증가 | 18 | 1 | 11 | 1 |
* 기준선 값과 적어도 한 번 이상의 치료 후 값이 있는 환자 수에 따라 분모는 Sunitinib malate의 경우 52~82, 위약의 경우 39~80으로 다양했습니다. 이상사례 일반 용어 기준(CTCAE), 버전 3 약어: ALT=알라닌 아미노전이효소; AST=아스파르트산 아미노전이효소; N=환자 수; pNET=췌장 신경내분비종양.
a Sunitinib malate를 투여받은 환자에서 4등급 실험실 이상에는 크레아티닌(4%), 리파아제(4%), 혈당 감소(2%), 혈당 증가(2%), 호중구(2%), ALT(1%), AST(1%), 혈소판(1%), 칼륨 증가(1%), 총 빌리루빈(1%)이 포함되었습니다.
b 위약군 환자에서 4등급 실험실 이상에는 크레아티닌(3%), 알칼라인 인산가수분해효소(1%), 혈당 증가(1%), 리파아제(1%)가 포함되었습니다.
정맥 혈전색전증
통합 안전성 인구 집단에서 3.5%의 환자가 정맥 혈전색전증을 경험했으며, 그중 2.2%는 3-4등급이었습니다.
췌장 기능
췌장염은 pNET 연구에서 1명(1%), 치료 경험이 없는 RCC 연구에서 5명(1%), RCC 보조 치료 연구에서 sunitinib malate를 투여한 환자 1명(<1%)에서 관찰되었다.
6.2 시판 후 경험
다음의 이상반응은 sunitinib malate의 승인 후 사용 중 확인되었다. 이러한 반응은 크기를 알 수 없는 집단에서 자발적으로 보고되므로 빈도를 신뢰성 있게 추정하거나 약물 노출과의 인과 관계를 확립하는 것이 항상 가능하지는 않다.
- 혈액 및 림프계 장애: 혈소판감소증과 관련된 출혈*.
- 위장관계 장애: 식도염.
- 간담도계 장애: 담낭염, 특히 무결석 담낭염.
- 면역계 장애: 혈관부종을 포함한 과민반응.
- 감염 및 기생충 감염: 중대한 감염(호중구감소증 동반 또는 비동반)*. sunitinib malate와 가장 흔히 관찰되는 감염에는 호흡기, 요로, 피부 감염 및 sepsis/septic shock이 포함된다.
- 근골격계 및 결합조직 장애: 종양 괴사 및/또는 퇴행과 때때로 연관된 누공 형성*; 급성 신부전을 동반하거나 동반하지 않는 근병증 및/또는 횡문근융해증*.
- 신장 및 요로계 장애: 신장 손상 및/또는 부전*.
- 호흡기계 장애: 폐색전증*, 흉막 삼출*.
- 피부 및 피하조직 장애: pyoderma gangrenosum, 양성 de-challenge 포함.
- 혈관 장애: 동맥(대동맥 포함) 동맥류, 박리* 및 파열*; 동맥 혈전색전 사례*. 가장 흔한 사례로는 뇌혈관 사고, 일과성 허혈 발작 및 뇌경색이 포함된다.
- 전신 장애 및 투여 부위 상태: 상처 치유 장애.* 일부 치명적인 사례 포함
7 약물 상호 작용
7.1 다른 약물이 Sunitinib Malate에 미치는 영향
강력한 CYP3A4 억제제와 병용 투여 시 sunitinib 혈장 농도가 증가할 수 있습니다 [임상 약리학 (12.3) 참조]. 효소 억제 잠재력이 없거나 최소한인 대체 병용 약물을 선택하십시오. 강력한 CYP3A4 억제제와 병용 투여할 때 sunitinib malate의 용량 감량을 고려하십시오 [용법용량 (2.5) 참조].
강력한 CYP3A4 유도제와 병용 투여 시 sunitinib 혈장 농도가 감소할 수 있습니다 [임상 약리학 (12.3) 참조]. 효소 유도 잠재력이 없거나 최소한인 대체 병용 약물을 선택하십시오. CYP3A4 유도제와 반드시 병용 투여해야 할 때 sunitinib malate의 용량 증량을 고려하십시오 [용법용량 (2.5) 참조].
7.2 QT 간격을 연장시키는 약물
Sunitinib malate는 QTc 간격 연장과 관련이 있습니다 [경고 및 주의사항 (5.3) 참조, 임상 약리학 (12.2) 참조]. QT 간격을 연장시키는 것으로 알려진 병용 약물 치료가 필요한 환자의 경우 ECG로 QT 간격을 더 자주 모니터링하십시오.
8 특정 집단에서의 사용
8.1 임신
위험 요약동물 생식 연구 및 작용 기전에 따르면 sunitinib malate는 임신한 여성에게 투여될 때 태아에게 위험할 수 있습니다 [Clinical Pharmacology (12.1) 참조]]. 임신한 여성에서의 약물 관련 위험을 알려줄 수 있는 이용 가능한 데이터는 없습니다. 동물 발달 및 생식 독성 연구에서, 기관 형성 기간 동안 임신한 랫드와 토끼에게 sunitinib을 경구 투여한 결과, 권장 일일 용량(RDD) 50mg을 투여받은 환자의 combined AUC(sunitinib과 그 활성 대사체의 전신 노출 합계)의 각각 5.5배와 0.3배에서 기형 유발(배자 치사, 두개안면 및 골격 기형)이 나타났습니다(데이터 참조). 가임기 여성에게 태아에 대한 잠재적 위험을 알려줍니다.
표시된 모집단에 대한 주요 선천적 결함 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 결함, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인지된 임신의 주요 선천적 결함 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
데이터
동물 데이터암컷 생식능력 및 초기 배아 발달 연구에서, 암컷 랫드에게 교미 21일 전부터 교미 후 7일까지 경구 sunitinib(0.5, 1.5, 5 mg/kg/day)을 투여했습니다. 5 mg/kg/day(RDD 50mg을 투여받은 환자의 combined AUC의 약 5배)에서 배자 치사가 관찰되었습니다.
배아-태아 발달 독성 연구에서, 기관 형성 기간 동안 임신한 랫드(0.3, 1.5, 3, 5 mg/kg/day) 및 토끼(0.5, 1, 5, 20 mg/kg/day)에게 경구 sunitinib을 투여했습니다. 랫드에서는 5 mg/kg/day(RDD 50mg을 투여받은 환자의 combined AUC의 약 5.5배) 용량에서 배자 치사 및 늑골과 척추의 골격 기형이 관찰되었습니다. 랫드에서는 ≤3 mg/kg/day(RDD 50mg을 투여받은 환자의 combined AUC의 약 2배) 용량에서 태아에 대한 부작용이 관찰되지 않았습니다. 토끼에서는 5 mg/kg/day(RDD 50mg을 투여받은 환자의 combined AUC의 약 3배)에서 배자 치사가 관찰되었고, ≥1 mg/kg/day(RDD 50mg을 투여받은 환자의 combined AUC의 약 0.3배)에서 두개안면 기형(구순구개열)이 관찰되었습니다.
임신한 랫드에서 출생 전후 발달 연구에서 sunitinib(0.3, 1, 3 mg/kg/day)을 평가했습니다. ≥1 mg/kg/day(RDD 50mg을 투여받은 환자의 combined AUC의 약 0.5배) 용량에서 임신 및 수유 기간 동안 모체 체중 증가가 감소했습니다. 3 mg/kg/day(RDD 50mg을 투여받은 환자의 combined AUC의 약 2배)에서는 출생 시 신생아 체중 감소가 관찰되었고, 이는 수유 전 기간 동안 양성 모두에서, 수유 후 기간 동안에는 수컷에서 지속되었습니다. ≤1 mg/kg/day 용량에서는 발달에 대한 부작용이 관찰되지 않았습니다.
8.2 수유
모유에서 sunitinib 및 그 대사체의 존재에 관한 정보는 없습니다. Sunitinib 및 그 대사체는 랫드 모유에서 혈장보다 최대 12배 높은 농도로 배설되었습니다(데이터 참조). 수유 중인 영아에서 심각한 이상반응의 가능성 때문에, sunitinib malate 치료 중 및 마지막 투여 후 최소 4주 동안 모유 수유를 하지 않도록 여성에게 권고합니다.
데이터
동물 데이터
15 mg/kg을 투여한 수유 중인 암컷 랫드에서 sunitinib 및 그 대사체는 혈장보다 최대 12배 높은 농도로 모유에 배설되었습니다.
8.3 가임기 여성 및 남성
Sunitinib malate는 임신한 여성에게 투여될 때 태아에게 위험할 수 있습니다 [특정 집단에서의 사용 (8.1) 참조].
임신 검사
Sunitinib malate 치료를 시작하기 전에 가임기 여성의 임신 상태를 확인하십시오.
피임
여성가임기 여성에게 sunitinib malate 치료 중 및 마지막 투여 후 최소 4주 동안 효과적인 피임법을 사용하도록 권고합니다.
남성
동물 생식 연구 결과에 따라, 가임기 여성 파트너가 있는 남성에게 sunitinib malate 치료 중 및 마지막 투여 후 7주 동안 효과적인 피임법을 사용하도록 권고합니다.
불임
동물에서의 연구 결과에 따르면 sunitinib malate는 남성 및 여성 생식능력을 손상시킬 수 있습니다 [Nonclinical Toxicology (13.1) 참조].
8.4 소아에 대한 사용
소아 환자에서 sunitinib malate의 안전성과 유효성은 확립되지 않았습니다. 불응성 고형암이 있는 2세 이상 17세 미만의 소아 환자(n=29)를 대상으로 한 공개 연구(NCT00387920)에서 sunitinib의 안전성과 약동학을 평가했습니다. 또한 고등급 교종 또는 뇌실막종이 있는 2세 이상 17세 미만의 소아 환자(n=27)를 대상으로 한 다른 공개 연구(NCT01462695)에서 sunitinib의 유효성, 안전성 및 약동학을 평가했습니다. 체표면적(BSA)으로 정규화된 최대 내약 용량(MTD)은 소아 환자에서 성인보다 낮았습니다. Sunitinib은 소아 환자에서 내약성이 좋지 않았습니다. 용량 제한 심장 독성의 발생으로 인해 NCT00387920 연구를 수정하여 이전에 anthracycline 또는 심장 방사선에 노출된 환자를 제외했습니다. 두 시험 중 어느 시험에서도 환자에서 반응이 보고되지 않았습니다.
Sunitinib 및 그 활성 주요 대사체의 BSA 정규화 겉보기 청소율 및 분포 용적은 소아에서 성인에 비해 낮았습니다.
Sunitinib malate를 투여받은 소아 환자의 열린 경골 성장판에 대한 영향은 적절히 연구되지 않았습니다. 아래 연소 동물 독성 데이터를 참조하십시오.
연소 동물 독성 데이터
RDD 50mg을 투여받은 환자의 combined AUC보다 >0.4배인 용량(3개월 투여 2, 6, 12 mg/kg/day, 8주기 투여 0.3, 1.5, 6 mg/kg/day)으로 ≥3개월 동안 sunitinib을 투여받은 성장판이 열린 cynomolgus 원숭이에서 골단 형성부전증이 나타났습니다. 8주기 동안 간헐적으로 치료받은 원숭이에서 무영향 수준(NOEL)은 1.5 mg/kg/day였지만, 3개월 동안 지속적으로 치료받은 원숭이에서는 확인되지 않았습니다. 3개월 동안 지속적으로(1.5, 5, 15 mg/kg) 또는 5주기 동안(0.3, 1.5, 6 mg/kg/day) 치료받은 발달 중인 랫드에서 골 이상은 ≥5 mg/kg(RDD 50mg을 투여받은 환자의 combined AUC의 약 10배) 용량에서 대퇴골 골단 연골의 비후 및 경골 골절 증가로 구성되었습니다. 또한 >5 mg/kg에서 랫드에서 치아 우식증이 나타났습니다. 골단 형성부전증의 발생률과 중증도는 용량 관련적이었고 치료 중단 시 가역적이었습니다. 그러나 치아에서의 발견은 그렇지 않았습니다. 랫드에서 뼈의 NOEL은 ≤2 mg/kg/day였습니다.
8.5 고령 환자
GIST, RCC(전이성 및 보조요법), 또는 pNET로 sunitinib malate를 투여 받은 7,527명의 환자 중 32%는 65세 이상이었고, 7%는 75세 이상이었습니다. 65세 이상 환자에서 3등급 또는 4등급 이상반응의 발생률(67%)이 65세 미만 환자(60%)보다 높았습니다.
GIST 연구에서 sunitinib malate를 투여 받은 환자 중 73명(30%)이 65세 이상이었습니다. mRCC 연구에서 sunitinib malate를 투여 받은 환자 중 152명(41%)이 65세 이상이었습니다. 이러한 환자들과 젊은 환자들 간에 전반적인 안전성이나 유효성 차이는 관찰되지 않았습니다.
pNET 연구에서 sunitinib malate를 투여 받은 환자 중 22명(27%)이 65세 이상이었습니다. sunitinib malate의 임상 연구에는 65세 이상 pNET 환자가 충분히 포함되지 않아 65세 이상 환자와 젊은 환자의 반응 차이를 확인할 수 없었습니다.
8.6 간장애
경증 또는 중등증(Child-Pugh Class A 또는 B) 간장애 환자에서는 용량 조절이 필요하지 않습니다[임상약리학(12.3) 참조]. Sunitinib malate는 중증(Child-Pugh Class C) 간장애 환자에서 연구되지 않았습니다.
8.7 신장애
경증(CLcr 50~80 mL/min), 중등증(CLcr 30~<50 mL/min) 또는 중증(CLcr <30 mL/min) 신장애 환자로 투석하지 않는 경우 용량 조절이 권장되지 않습니다[임상약리학(12.3) 참조]. 혈액투석 중인 말기 신부전(ESRD) 환자에서도 용량 조절이 권장되지 않습니다[임상약리학(12.3) 참조].
10 과량 투여
Sunitinib malate 과량 투여 시 일반적인 지지요법을 시행해야 합니다. Sunitinib malate 과량 투여에 대한 특정 해독제는 없습니다. 필요한 경우, 구토 또는 위세척을 통해 흡수되지 않은 약물을 제거해야 합니다. 우발적 과량 투여 사례가 보고된 바 있으며, 이러한 경우 sunitinib malate의 알려진 안전성 프로파일과 일치하는 이상반응 또는 이상반응이 없는 것과 관련이 있었습니다. 비임상 연구에서 랫드에게 500 mg/kg(3000 mg/m2)을 하루에 5회 투여한 후 사망이 관찰되었습니다. 이 용량에서 근육 조절 장애, 머리 흔들림, 활동 저하, 안구 분비물, 입모, 위장 장애 등의 독성 징후가 나타났습니다. 장기간 투여 시 저용량에서도 사망 및 유사한 독성 징후가 관찰되었습니다.
11 설명
Sunitinib은 malate 염 형태로 sunitinib malate 캡슐에 들어있는 kinase inhibitor입니다.
Sunitinib malate는 화학적으로 (Z)-N-[2-(Diethylamino)ethyl]-5-[(5-fluoro-1,2-dihydro-2-oxo-3H-indol-3-ylidene)methyl]-2,4-dimethyl-1H-pyrrole-3-carboxamide(s)-2-hydroxysuccinate로 기술됩니다. 분자식은 C22H27FN4O2● C4H6O5이고 분자량은 532.6 달톤입니다. Sunitinib malate의 화학 구조는 다음과 같습니다:
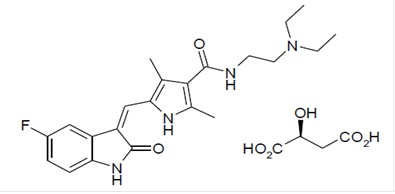
Sunitinib malate는 pKa 8.95를 갖는 노란색에서 주황색의 분말입니다. pH 1.2에서 pH 6.8 범위의 수용액 매질에서 sunitinib malate의 용해도는 25 mg/mL 이상입니다. pH 7에서 분배 계수의 로그값은 5.2입니다.
경구 투여용 Sunitinib malate 캡슐은 각각 16.7 mg, 33.4 mg, 50.1 mg 또는 66.8 mg의 sunitinib malate에 해당하는 12.5 mg, 25 mg, 37.5 mg 또는 50 mg의 sunitinib을 함유하는 인쇄된 경질 캡슐로 공급됩니다. 캡슐에는 다음과 같은 비활성 성분이 포함되어 있습니다: croscarmellose sodium, magnesium stearate, mannitol 및 povidone (K-25). 12.5 mg 캡슐 껍질에는 gelatin, iron oxide black, iron oxide red, iron oxide yellow, sodium lauryl sulfate 및 titanium dioxide가 포함되어 있습니다. 25 mg, 37.5 mg 및 50 mg 캡슐 껍질에는 gelatin, iron oxide black, sodium lauryl sulfate 및 titanium dioxide가 포함되어 있습니다.
흰색 인쇄 잉크에는 dehydrated alcohol, isopropyl alcohol, butyl alcohol, propylene glycol, shellac, strong ammonia solution, potassium hydroxide 및 titanium dioxide가 포함되어 있습니다.
12 임상약리학
12.1 작용기전
Sunitinib은 다중 수용체 tyrosine kinase (RTKs)를 억제하는 소분자로, 그 중 일부는 종양 성장, 병적 혈관신생 및 암의 전이성 진행에 연관되어 있습니다. Sunitinib은 다양한 kinase(80개 이상의 kinase)에 대한 억제 활성을 평가받았으며 platelet-derived growth factor receptors (PDGFRα 및 PDGFRβ), vascular endothelial growth factor receptors (VEGFR1, VEGFR2 및 VEGFR3), stem cell factor receptor (KIT), Fms-like tyrosine kinase-3 (FLT3), colony stimulating factor receptor Type 1 (CSF-1R) 및 glial cell-line derived neurotrophic factor receptor (RET)의 억제제로 확인되었습니다. Sunitinib에 의한 이러한 RTKs 활성 억제는 생화학적 및 세포 분석에서 입증되었으며, 기능 억제는 세포 증식 분석에서 입증되었습니다. 주요 대사체는 생화학적 및 세포 분석에서 sunitinib과 유사한 효능을 나타냅니다.
Sunitinib은 RTK 표적을 발현하는 종양 이종이식편에서 다중 RTKs (PDGFRβ, VEGFR2, KIT)의 인산화를 억제하였으며, 일부 실험적 암 모델에서 종양 성장 억제 또는 종양 퇴행 및/또는 전이 억제를 나타냈습니다. Sunitinib은 in vitro에서 조절 이상 표적 RTKs (PDGFR, RET 또는 KIT)를 발현하는 종양 세포의 성장을 억제하고 in vivo에서 PDGFRβ 및 VEGFR2 의존성 종양 혈관신생을 억제하는 능력을 보여주었습니다.
12.2 약력학
노출-반응 관계
집단 약동학/약력학 분석에 따르면, 시간 경과에 따른 다양한 약력학적 평가변수(예: 안전성 및 유효성 평가변수)의 변화와 sunitinib 혈장 노출 사이에 관계가 있었습니다.
심장 전기생리학
Sunitinib malate는 용량 의존적으로 QT 간격 연장을 유발할 수 있으며, 이는 Torsade de Pointes를 포함한 심실 부정맥의 위험 증가로 이어질 수 있습니다[경고 및 주의사항 (5.3) 참조].
12.3 약동학
Sunitinib 및 sunitinib malate의 약동학은 건강한 대상 및 고형암 환자에서 평가되었습니다.
Sunitinib의 AUC 및 Cmax는 25 mg에서 100 mg의 용량 범위(승인된 RDD 50 mg의 0.5~2배)에서 비례하여 증가합니다. 건강한 대상과 고형암 환자(GIST 및 RCC 환자 포함)에서 약동학은 유사하였습니다. 반복 일일 투여 또는 반복 주기로 sunitinib 또는 주요 활성 대사체의 약동학에 유의한 변화는 관찰되지 않았습니다. 반복 일일 투여 시, sunitinib은 3~4배 축적되는 반면 주요 대사체는 7~10배 축적됩니다. Sunitinib 및 주요 활성 대사체의 정상상태 농도는 10~14일 이내에 도달합니다. 14일째까지 sunitinib 및 활성 대사체의 혈장 농도 합은 63~101 ng/mL 범위였습니다.
흡수
Sunitinib을 경구 투여한 후, 최고 혈장 농도(Tmax)에 도달하는 데 6~12시간이 소요되었습니다.
음식의 영향
건강한 대상에게 고지방, 고칼로리 식사(약 150 단백질 칼로리 및 500~600 지방 칼로리로 구성)와 함께 sunitinib malate 50 mg 단회 용량을 투여하는 것은 sunitinib malate 또는 활성 대사체 노출에 임상적으로 유의한 영향을 미치지 않았습니다.
분포
Sunitinib의 겉보기 분포 용적(Vd/F)은 2230 L입니다. In vitro에서 sunitinib 및 주요 활성 대사체의 사람 혈장 단백질 결합은 각각 95% 및 90%이며, 100~4000 ng/mL 범위에서 농도 의존성이 없습니다.
소실
건강한 대상에게 단회 경구 용량을 투여한 후, sunitinib 및 주요 활성 대사체의 말단 반감기는 각각 약 40~60시간 및 80~110시간입니다. Sunitinib의 총 경구 청소율(CL/F)은 34~62 L/h 범위였으며, 환자 간 변동성은 40%였습니다.
대사
Sunitinib은 주로 CYP3A4에 의해 주요 활성 대사체로 대사되며, 이는 다시 CYP3A4에 의해 대사됩니다. 주요 활성 대사체는 총 노출량의 23~37%를 차지합니다. 방사성 표지 용량 투여 후, sunitinib 및 활성 대사체는 방사능의 92%를 차지하는 혈장에서 확인된 주요 화합물이었습니다.
배설
Sunitinib의 방사성 표지 용량 투여 후, 용량의 약 61%가 대변으로, 16%가 소변으로 회수되었습니다.
Sunitinib 및 주요 활성 대사체는 각각 방사능의 86% 및 74%를 나타내는 소변 및 대변에서 확인된 주요 화합물이었습니다.
특정 집단
연령(18~84세), 체중(34~168 kg), 인종(백인, 흑인 또는 아시아인), 성별, Eastern Cooperative Oncology Group(ECOG) 점수, 경증(Child-Pugh Class A) 또는 중등도(Child-Pugh Class B)의 간장애에 따른 sunitinib 또는 주요 활성 대사체의 약동학에 임상적으로 유의한 차이는 관찰되지 않았습니다.
신장애 환자
경증(CLcr 50~80 mL/min), 중등도(CLcr 30~<50 mL/min) 또는 중증(CLcr <30 mL/min)의 신장애가 있으나 투석을 받지 않는 환자에서 신기능이 정상인 환자(CLcr >80 mL/min)에 비해 sunitinib 또는 활성 대사체의 약동학에 임상적으로 유의한 차이가 예측되거나 관찰되지 않았습니다. Sunitinib은 혈액투석으로 제거되지 않았지만, 말기 신장애(ESRD) 환자에서 혈액투석을 받는 경우 sunitinib의 전신 노출량이 신기능이 정상인 환자에 비해 47% 낮았습니다.
약물 상호작용 연구
임상 연구
강력한 CYP3A4 억제제가 sunitinib에 미치는 영향: 건강한 대상에서 ketoconazole(강력한 CYP3A4 억제제)과 함께 sunitinib malate 단회 용량을 병용 투여하면 sunitinib 및 활성 대사체의 Cmax와 AUC0-inf가 각각 49% 및 51% 증가했습니다.
강력한 CYP3A4 유도제가 sunitinib에 미치는 영향: 건강한 대상에서 rifampin(강력한 CYP3A4 유도제)과 함께 sunitinib malate 단회 용량을 병용 투여하면 sunitinib 및 활성 대사체의 Cmax와 AUC0-inf가 각각 23% 및 46% 감소했습니다.
In Vitro 연구
인간 간세포 및 microsomes에서의 in vitro 연구에 따르면, sunitinib 및 주요 활성 대사체는 임상적으로 관련 있는 농도에서 CYP1A2, CYP2E1 및 CYP3A4/5를 유도하지 않거나, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5 및 CYP4A9/11을 억제하지 않습니다.
13 비임상 독성학
13.1 발암성, 변이원성, 생식능력 장애
Sunitinib의 발암 가능성은 rasH2 형질전환 마우스와 Sprague-Dawley 랫드의 두 종에서 평가되었습니다. 두 종 모두에서 유사한 양성 소견이 관찰되었습니다. rasH2 형질전환 마우스에서는 1개월 또는 6개월 동안의 연구에서 sunitinib을 1일 ≥25 mg/kg/day 용량으로 투여했을 때 위십이지장 암종 및/또는 위점막 과형성과 더불어 배경 혈관육종의 발생률이 증가했습니다. rasH2 형질전환 마우스에서는 8 mg/kg/day 용량에서 증식성 변화가 관찰되지 않았습니다. 유사하게 2년 랫드 발암성 연구에서 28일 주기로 sunitinib을 투여한 후 7일간 투여 중단 기간을 가졌을 때, 1 mg/kg/day의 저용량(50 mg의 RDD를 투여한 환자의 AUC 합계의 약 0.9배)에서도 십이지장 암종 소견이 관찰되었습니다. 3 mg/kg/day의 고용량(50 mg의 RDD를 투여받은 환자의 AUC 합계의 약 8배)에서는 십이지장 종양의 발생률이 증가했고 이는 위점막세포 과형성 및 크롬친화세포종과 부신 과형성의 발생률 증가와 동반되었습니다.
Sunitinib은 in vitro 시험(박테리아 변이원성 시험(Ames 시험), 인체 림프구 염색체 이상 시험)과 in vivo 랫드 골수 소핵 시험에서 유전 손상을 유발하지 않았습니다.
암컷 생식능력 및 초기 배아 발달 연구에서 암컷 랫드에게 교배 전 21일 및 교배 후 7일 동안 경구 sunitinib(0.5, 1.5, 5 mg/kg/day)을 투여했습니다. 5 mg/kg/day(50 mg의 RDD를 투여받은 환자의 AUC 합계의 약 5배)를 투여받은 암컷에서 착상 전 손실이 관찰되었습니다. ≤1.5 mg/kg/day 용량(50 mg의 RDD를 투여받은 환자의 AUC 합계와 거의 동등)에서는 생식능력에 대한 부작용이 관찰되지 않았습니다. 추가로 3개월 경구 반복투여 원숭이 연구(2, 6, 12 mg/kg/day)에서 암컷 생식기계에 대한 영향이 확인되었습니다. 난소 변화(난포 발달 감소)는 12 mg/kg/day(50 mg의 RDD를 투여받은 환자의 AUC 합계의 약 5배)에서 관찰되었고, 자궁 변화(자궁내막 위축)는 ≥2 mg/kg/day(50 mg의 RDD를 투여받은 환자의 AUC 합계의 약 0.4배)에서 관찰되었습니다. 질 위축이 추가로 나타나 9개월 원숭이 연구(28일 동안 0.3, 1.5, 6 mg/kg/day를 매일 투여한 후 14일간 휴약기를 가짐)에서 6 mg/kg/day(50 mg의 RDD를 투여받은 환자의 AUC 합계의 약 0.8배)에서 자궁 및 난소 영향이 재현되었습니다.
수컷 생식능력 연구에서 치료받지 않은 암컷과 교배하기 전 58일 동안 수컷 랫드에 경구 sunitinib 1, 3, 10 mg/kg/day를 투여했을 때 생식 영향이 관찰되지 않았습니다. 생식능력, 교미, 수태율, 정자 평가(형태, 농도, 운동성)는 ≤10 mg/kg/day 용량(50 mg의 RDD를 투여받은 환자의 AUC 합계의 약 ≥26배)에서 sunitinib의 영향을 받지 않았습니다.
14 임상 연구
14.1 위장관 기질종양
연구 1(NCT#00075218)은 이전에 imatinib mesylate(imatinib) 치료 중 질병이 진행되었거나 imatinib을 내약할 수 없었던 위장관 기질종양(GIST) 환자를 대상으로 sunitinib malate에 대한 이중 맹검, 위약 대조, 2군, 국제, 무작위 배정 시험이었습니다. 시험의 목적은 최선의 지지요법과 함께 sunitinib malate를 투여받은 환자와 최선의 지지요법과 함께 위약을 투여받은 환자에서 종양 진행까지의 시간(TTP)을 비교하는 것이었습니다. 기타 평가변수로는 무진행 생존기간(PFS), 객관적 반응률(ORR), 전체 생존기간(OS) 등이 있었습니다. 환자들은 2:1로 무작위 배정되어 질병이 진행되거나 다른 이유로 연구를 중단할 때까지 sunitinib malate 50 mg 또는 위약을 1일 1회 경구 투여하였으며, 투여 일정은 4/2 schedule이었습니다. 질병이 진행된 시점에서 시험의 눈가림을 해제하였습니다. 위약군으로 무작위 배정된 환자에게는 공개 sunitinib malate 투여로 교차할 기회가 제공되었고, sunitinib malate군으로 무작위 배정된 환자는 연구자의 판단에 따라 치료를 계속할 수 있었습니다.
사전에 정해진 중간 분석 시점에서 intention-to-treat(ITT) 모집단은 312명의 환자를 포함했습니다. 207명의 환자가 sunitinib malate군으로, 105명의 환자가 위약군으로 무작위 배정되었습니다. sunitinib malate군과 위약군의 인구통계학적 특성은 연령(sunitinib malate군 69% vs 위약군 72%가 65세 미만), 성별(남성: 64% vs 61%), 인종(백인: 양 군 모두 88%, 아시아인: 양 군 모두 5%, 흑인: 양 군 모두 4%, 나머지는 보고되지 않음), 활동도(ECOG 0: 44% vs 46%, ECOG 1: 55% vs 52%, ECOG 2: 1% vs 2%)에 있어 유사했습니다. 이전 치료로는 수술(94% vs 93%)과 방사선치료(8% vs 15%)가 있었습니다. 이전의 imatinib 치료 결과도 양 군에서 유사했는데, 내약성 부족(4% vs 4%), 치료 시작 후 6개월 이내 질병 진행(17% vs 16%), 6개월 후 질병 진행(78% vs 80%)이 균형을 이루었습니다.
149건의 TTP 사건이 발생한 후 계획된 유효성 및 안전성에 대한 중간 분석이 수행되었습니다. 1차 평가변수인 TTP에서 sunitinib malate가 위약에 비해 통계적으로 유의한 이점이 있었습니다. 유효성 결과는 표 10에 요약되어 있고 TTP에 대한 Kaplan-Meier 곡선은 그림 1에 제시되어 있습니다.
표 10. 연구 1(이중 맹검 치료 단계)에서의 GIST 유효성 결과
| 유효성 평가변수 | Sunitinib Malate (N=207) |
Placebo (N=105) |
p-value (log-rank test) |
HR (95% CI) |
||
| 종양 진행까지의 시간a[median, weeks (95% CI)] | 27.3 (16, 32.1) |
6.4 (4.4, 10) |
<0.0001* | 0.33 (0.23, 0.47) |
||
| 무진행 생존기간b [median, weeks (95% CI)] | 24.1 (11.1, 28.3) |
6 (4.4, 9.9) |
<0.0001 | 0.33(0.24, 0.47) | ||
| 객관적 반응률 (PR) [%, (95% CI)] | 6.8 (3.7, 11.1) |
0 | 0.006c | |||
* p-value가 0.00417 미만인 경우 통계적으로 유의한 차이로 간주됨(O’Brien Fleming stopping boundary). 약어: CI=신뢰구간; GIST=위장관 기질종양; HR=hazard ratio; N=환자 수; PR=부분 반응.
a 무작위 배정일로부터 질병 진행까지의 시간; 진행이 문서화되기 전에 사망한 경우는 마지막 영상 평가 시점에서 중도절단되었음.
b 무작위 배정일로부터 질병 진행 또는 모든 원인에 의한 사망까지의 시간.
c Pearson 카이제곱 검정.
그림 1. 연구 1에서 GIST에 대한 TTP의 Kaplan-Meier 곡선(ITT 모집단)
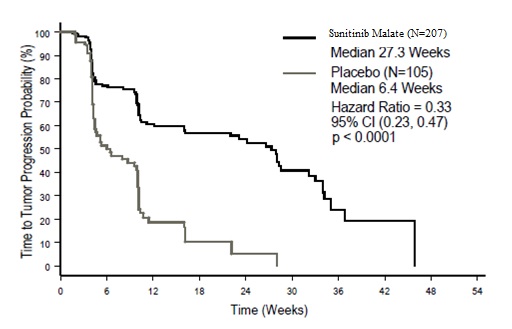
약어: CI=신뢰구간; GIST=위장관 기질종양; N=환자 수; TTP=종양 진행까지의 시간.
본 연구의 이중 맹검 치료 단계에 등록된 최종 ITT 모집단은 sunitinib malate군으로 무작위 배정된 243명의 환자와 위약군으로 무작위 배정된 118명의 환자를 포함했습니다. 중간 분석에서 1차 평가변수가 충족된 후 시험의 눈가림이 해제되었고, 위약군 환자들에게 공개 sunitinib malate 치료가 제공되었습니다. 처음에 위약군으로 무작위 배정되었던 99명의 환자가 공개 치료 단계에서 sunitinib malate를 투여받기 위해 교차하였습니다. 계획서에 명시된 OS의 최종 분석에서 sunitinib malate군의 중앙 OS는 72.7주였고 위약군은 64.9주였습니다[hazard ratio (HR)=0.876, 95% 신뢰구간(CI) (0.679, 1.129)].
연구 2
연구 2는 imatinib 치료 중 질병이 진행되었거나 imatinib을 내약할 수 없었던 GIST 환자를 대상으로 한 공개, 다기관, 단일군, 용량 증량 연구였습니다. 권장 용법(4/2 schedule로 1일 1회 50 mg 투여)이 확인된 후, 이 연구에서 55명의 환자가 4/2 schedule로 sunitinib malate 50 mg을 투여받았습니다. 55명 중 5명의 환자에서 부분 반응(PR)이 관찰되었습니다(9.1% PR rate; 95% CI: 3%, 20%).
14.2 신세포암
치료 경험이 없는 경우
연구 3(NCT#00083889)은 치료 경험이 없는 신세포암 환자를 대상으로 단독요법 sunitinib malate와 interferon alfa를 비교한 다기관, 국제, 무작위 배정 시험이었습니다. 이 연구의 목적은 sunitinib malate를 투여받은 환자와 interferon alfa를 투여받은 환자에서 PFS를 비교하는 것이었습니다. 기타 평가 항목으로는 ORR, OS, 안전성 등이 있었습니다. 750명의 환자가 1:1로 무작위 배정되어 4/2 schedule로 sunitinib malate 50 mg을 1일 1회 투여받거나 interferon alfa를 주 3회 피하 주사로 9 MIU 용량으로 투여받았습니다. 환자들은 질병이 진행되거나 연구에서 탈락할 때까지 치료를 받았습니다.
ITT 인구는 375명이 sunitinib malate로, 375명이 interferon alfa로 무작위 배정된 750명의 환자를 포함했습니다. 인구통계학적 특성은 sunitinib malate와 interferon alfa 그룹 간에 나이(각각 sunitinib malate vs. interferon alfa에 대해 59% vs. 67%가 65세 미만), 성별(남성: 71% vs. 72%), 인종(백인: 94% vs. 91%, 아시아인: 2% vs. 3%, 흑인: 1% vs. 2%, 나머지는 보고되지 않음), 그리고 performance status(ECOG 0: 62% vs. 61%, ECOG 1: 각 군에서 38%, ECOG 2: 0 vs. 1%)에 있어 유사했습니다. 이전 치료에는 신장절제술(91% vs. 89%)과 방사선치료(각 군에서 14%)가 포함되었습니다. 선별검사에서 전이가 있는 가장 흔한 부위는 폐(각각 78% vs. 80%)였고, 그 다음으로 림프절(각각 58% vs. 53%), 뼈(각 군에서 30%)였습니다; 대부분의 환자는 baseline에서 다발성(2개 이상) 전이 부위를 가지고 있었습니다(각각 80% vs. 77%).
PFS의 평가변수에서 interferon alfa에 비해 sunitinib malate가 통계적으로 유의한 이점이 있었습니다(표 11과 그림 2 참조). 미리 지정된 lactate dehydrogenase(LDH) (>1.5 ULN vs. ≤1.5 ULN), ECOG performance status (0 vs. 1), 그리고 이전 신장절제술(예 vs. 아니오)의 층화 인자에서, 위험률은 interferon alfa보다 sunitinib malate에 유리했습니다. ORR은 sunitinib malate 군에서 더 높았습니다(표 11 참조).
표 11. 연구 3의 치료 경험이 없는 RCC 유효성 결과(중간 분석)
| 유효성 매개변수 | Sunitinib Malate (N=375) |
Interferon Alfa (N=375) |
p-value (log-rank test) |
HR (95% CI) |
| 무진행 생존a [median, 주 (95% CI)] |
47.3 (42.6, 50.7) |
22 (16.4, 24) |
<0.000001b | 0.415 (0.320, 0.539) |
| 객관적 반응률a [%, (95% CI)] |
27.5 (23, 32.3) |
5.3 (3.3, 8.1) |
<0.001c | NA |
약어: CI=신뢰구간; HR=위험비; N=환자 수; NA=해당 없음; RCC=신세포암.
a Blinded core radiology laboratory에 의해 평가되었습니다; 분석 시점에 90명의 환자의 스캔이 읽히지 않았습니다.
b p-value가 <0.0042(O’Brien Fleming 중단 경계)이면 통계적으로 유의한 것으로 간주됩니다.
c Pearson chi-square 검정.
그림 2. 치료 경험이 없는 RCC 연구 3의 PFS에 대한 Kaplan-Meier 곡선(Intent-to-Treat Population)
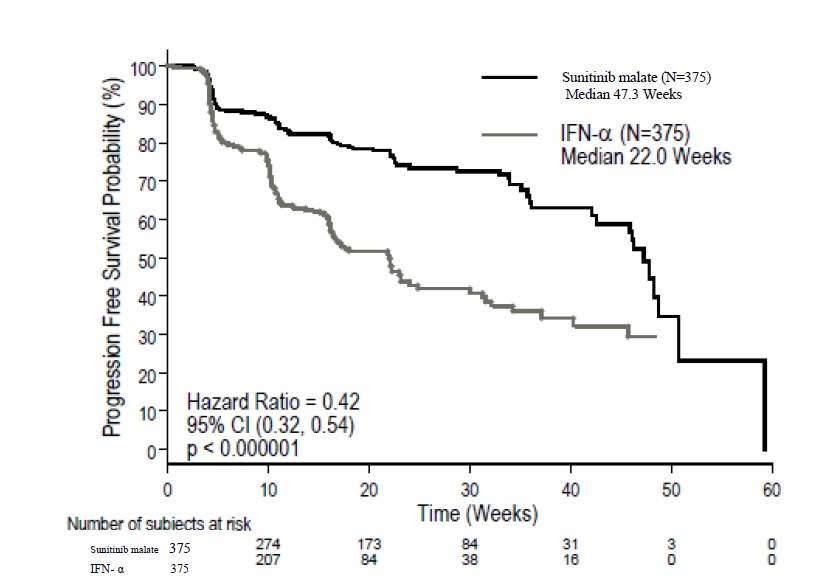
약어: CI=신뢰구간; IFN-α=interferon-alfa; N=환자 수; PFS=무진행 생존; RCC=신세포암.
OS의 프로토콜 지정 최종 분석에서 sunitinib malate 군의 median OS는 114.6주였고 interferon alfa 군은 94.9주였습니다(HR=0.821; 95% CI: 0.673, 1.001). Interferon alfa 군의 median OS에는 질병 진행으로 인해 interferon alfa 치료를 중단하고 sunitinib malate 치료로 교차한 25명의 환자와 연구 후 sunitinib malate로 암 치료를 받은 interferon alfa 군의 121명(32%)의 환자가 포함됩니다.
Cytokine-Refractory
Cytokine-refractory RCC 치료에서 단일제제 sunitinib malate의 사용은 2개의 단일군, 다기관 연구에서 조사되었습니다. 이 연구에 등록된 모든 환자는 이전의 cytokine 기반 치료에 실패했습니다. 연구 4(NCT#00077974)에서 이전 cytokine 치료 실패는 RECIST 또는 WHO 기준에 의해 정의된 질병 진행의 방사선학적 증거 또는 1회 cytokine 치료(interferon alfa, interleukin-2 또는 interferon alfa와 interleukin-2 병용) 완료 후 9개월 이내에 기반했습니다; interferon alfa 단독 치료를 받은 환자는 최소 28일 이상 치료를 받아야 했습니다. 연구 5(NCT#00054886)에서는 이전 cytokine 치료의 실패를 질병 진행 또는 허용할 수 없는 치료 관련 독성으로 정의했습니다. 두 연구의 평가변수는 ORR이었습니다. 반응 지속기간(DR)도 평가되었습니다.
106명의 환자가 연구 4에 등록되었고 63명의 환자가 연구 5에 등록되었습니다. 환자들은 Schedule 4/2로 50mg의 sunitinib malate를 투여 받았습니다. 환자가 중단 기준을 만족하거나 진행성 질환이 있을 때까지 치료가 지속되었습니다. 연구 4와 5 간에 환자의 baseline 나이, 성별, 인종 및 ECOG performance status는 유사했습니다. 2개 연구에서 환자의 약 86%~94%가 백인이었습니다. 통합 모집단의 65%가 남성이었습니다. 중앙값 연령은 57세였고 연구에서 24세에서 87세까지 범위였습니다. 모든 환자는 선별 방문 시 ECOG performance status가 2 미만이었습니다.
연구 4와 5 간에 환자의 baseline 악성 종양 및 이전 치료 병력은 유사했습니다. 2개 연구에 걸쳐 통합 모집단의 95%가 clear-cell 조직학의 일부 요소를 가지고 있었습니다. 연구 4의 모든 환자는 조직학적 clear-cell 요소를 가져야 했습니다. 연구에 등록된 대부분의 환자(통합 모집단의 97%)가 신장절제술을 받았습니다; 연구 4에 등록된 환자의 경우 이전 신장절제술이 필요했습니다. 모든 환자는 이전에 1개의 cytokine 요법을 받았습니다. 연구 참여 시점에 있었던 전이성 질환에는 81%의 환자에서 폐 전이가 포함되었습니다. 간 전이는 연구 4에서 더 흔했고(연구 5에서 27% vs. 16%) 골 전이는 연구 5에서 더 흔했습니다(연구 4에서 51% vs. 25%); 통합 모집단의 52%는 최소 3개의 전이 부위를 가지고 있었습니다. 알려진 뇌 전이 또는 연수막 질환이 있는 환자는 두 연구에서 모두 제외되었습니다. 연구 4와 5의 ORR 및 DR 데이터는 표 10에 제시되어 있습니다. 핵심 방사선과에서 평가한 바에 따르면 연구 4에서는 36건의 PR이 있어 34%의 ORR(95% CI: 25%, 43.8%)이 나왔습니다. 연구자들이 평가한 바에 따르면 연구 5에서는 23건의 PR이 있어 36.5%의 ORR(95% CI: 24.7%, 49.6%)이 나왔습니다. 객관적인 질병 반응의 대부분(>90%)은 처음 4회 cycle 동안 관찰되었습니다; 보고된 가장 늦은 반응은 Cycle 10에서 관찰되었습니다. 데이터 컷오프 시점에 치료에 반응한 36명의 환자 중 9명(25%)만이 질병 진행을 경험했거나 사망했기 때문에 연구 4의 DR 데이터는 아직 확정적이지 않습니다.
표 12. 연구 4와 연구 5의 Cytokine-Refractory RCC 유효성 결과
14 임상 연구
| 유효성 파라미터 | 연구 4 (N=106) |
연구 5 (N=63) |
| 객관적 반응률 [%, (95% CI)] |
34a (25, 43.8) |
36.5b (24.7, 49.6) |
| 반응 기간 [중앙값, 주 (95% CI)] |
NR* (42*) |
54b (34.3, 70.1) |
*상한 신뢰구간을 결정하기에 충분한 데이터가 없습니다.
약어: CI=신뢰구간; N=환자 수; NR=도달하지 않음; RCC=신장세포암.
a 맹검 심사 방사선 검토 기관에 의해 평가됨.b
연구자에 의해 평가됨.
보조 치료
보조 치료 환경에서 수니티닙말레이트는 S-TRAC (NCT#00375674)에서 조사되었습니다. 이는 신장 적출 후 재발 위험이 높은 RCC 환자를 대상으로 한 다기관, 국제, 무작위, 이중 맹검, 위약 대조 시험입니다. 환자들은 투명 세포 조직학 및 ≥T3 및/또는 N+ 종양으로 정의된 높은 재발 위험이 요구되었습니다. 615명의 환자가 1:1로 무작위 배정되어 수니티닙말레이트 50mg을 1일 1회 4/2 스케줄로 투여받거나 위약을 받았습니다. 환자들은 9주기(약 1년) 동안 치료받았거나, 질병이 재발하거나, 허용할 수 없는 독성이 나타나거나, 동의를 철회할 때까지 치료받았습니다.
연령(중앙 연령 58세), 성별(73% 남성), 인종(84% 백인, 12% 아시아인, 4% 기타)에 대해 수니티닙말레이트 및 위약 군 간 인구통계학이 대체로 비슷했습니다. 무작위 배정 시, 대부분의 환자(수니티닙말레이트 74%, 위약 72%)는 ECOG 수행능력 평가 등급 0이었습니다. 나머지 환자들은 1등급이었으며, 수니티닙말레이트 군 1명은 2등급이었습니다.
주요 유효성 평가변수는 맹검 독립적 중앙 검토(BICR)에 의해 평가된 수니티닙말레이트 대 위약의 무병생존기간(DFS)이었습니다. 전체생존기간은 추가 평가변수였습니다. 수니티닙말레이트를 투여받은 환자에서 위약 투여군에 비해 DFS가 통계적으로 유의하게 개선되었습니다(표 13 및 그림 3). 사전 지정된 하위군 분석 결과는 표 14에 제시되어 있습니다. DFS 분석 시점에서 전체생존기간 데이터는 성숙하지 않았으며, 615명 중 141명(23%)이 사망했습니다.
표 13. S-TRAC에서 BICR에 의해 평가된 보조요법 RCC의 무병생존기간 결과(치료의향집단)
| 수니티닙 말레이트 N = 309 |
위약 N = 306 |
p-값a | HRa (95% CI) |
|
| 중앙 DFS [년 (95% CI)] | 6.8 (5.8, NR) | 5.6 (3.8, 6.6) | 0.03 | 0.76 (0.59, 0.98) |
| DFS 이벤트 | 113 (36.6%) | 144 (47.1%) | ||
| 5년 DFS 비율 | 59.3% | 51.3% | ||
a P-값은 UISS 예후 그룹별 층화된 로그랭크 검정에 근거, HR은 UISS 예후 그룹별 층화된 Cox 비례위험모델에 근거
약어: BICR=맹검 독립적 중앙 검토; CI=신뢰구간; DFS=무병생존기간; HR=위험비; N=환자 수; RCC=신장세포암.
표 14. 기저 질병 특성별 무병생존기간
| 이벤트 수/총 환자 수 n/N |
중앙 DFS [년 (95% CI)] |
HRa (95% CI) | |||
| 수니티닙 말레이트 |
위약 | 수니티닙 말레이트 |
위약 | ||
| T3 중간b | 35/115 | 46/112 | NR (5.2, NR) |
6.4 (4.7, NR) |
0.82 (0.53, 1.28) |
| T3 고위험c | 63/165 | 79/166 | 6.8 (5, NR) |
5.3 (2.9, NR) |
0.77 (0.55, 1.07) |
| T4/림프절 양성d | 15/29 | 19/28 | 3.5 (1.2, NR) |
1.7 (0.4, 3) |
0.62 (0.31, 1.23) |
약어: CI=신뢰구간; DFS=무병생존기간; HR=위험비; N=환자 수; n=이벤트 수;
NR=도달하지 않음
a HR은 Cox 비례위험모델에 근거
b T3 중간: T3, N0 또는 NX, M0, 퍼만 등급 모두, ECOG PS 0 또는 T3, N0 또는 NX, M0, 퍼만 등급 1, ECOG PS > 1
c T3 고위험: T3, N0 또는 NX, M0, 퍼만 등급 > 2, ECOG PS > 1
d T4/림프절 양성: T4, N0 또는 NX, M0, 퍼만 등급 모두, ECOG PS 모두 또는 T 모두, N1-2, M0, 퍼만 등급 모두, ECOG PS 모두
그림 3. BICR에 의해 평가된 무병생존기간의 Kaplan-Meier 곡선(치료의향집단)
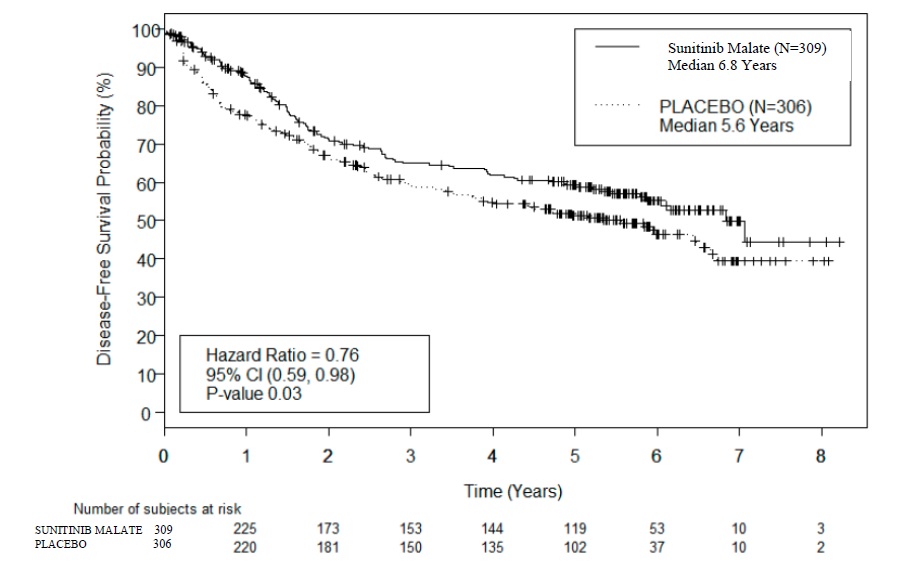
약어: BICR=맹검 독립적 중앙 검토; CI=신뢰구간; N=환자 수.
14.3 췌장 신경내분비종양
연구 6 (NCT#00428597)은 단일요법 수니티닙말레이트의 다기관, 국제, 무작위, 이중 맹검, 위약 대조 연구로, 절제 불가능한 pNET 환자를 대상으로 수행되었습니다. 환자들은 이전 12개월 이내에 RECIST 정의 질병 진행이 있어야 했고, 1:1로 무작위 배정되어 37.5mg 수니티닙말레이트(N=86) 또는 위약(N=85)을 1일 1회 복용하였으며 정기적 휴약기는 없었습니다. 주요 목적은 수니티닙말레이트 투여군 대비 위약군의 PFS를 비교하는 것이었습니다. 다른 평가변수에는 OS, ORR 및 안전성이 포함되었습니다. 연구에서 소마토스타틴 유사체의 사용이 허용되었습니다.
수니티닙말레이트와 위약군 간의 인구통계학적 특성은 유사했습니다. 또한, 수니티닙말레이트 환자의 49%는 비기능성 종양이 있었고 위약군 환자의 52%도 마찬가지였으며, 두 군 모두 92%의 환자에서 간 전이가 있었습니다. 수니티닙말레이트 환자의 66%가 이전에 전신 요법을 받은 반면 위약군 환자의 72%가 받았고, 수니티닙말레이트 환자의 35%가 somatostatin analogs를 받은 반면 위약군 환자의 38%가 받았습니다. 환자들은 질병이 진행되거나 연구에서 탈락할 때까지 치료를 받았습니다. 질병 진행 또는 연구 종료 시, 환자들은 별도의 연장 연구에서 수니티닙말레이트에 대한 접근을 제안받았습니다.
Independent Data Monitoring Committee의 권고에 따라, 사전 지정된 중간 분석 전에 연구가 조기 종료되었습니다. 이로 인해 PFS 효과의 크기가 과대 평가되었을 수 있습니다. 연구자 및 독립적 평가에 의해 수니티닙말레이트가 위약에 비해 PFS에서 임상적으로 유의한 개선을 보였습니다. 평가된 모든 기저 특성 하위그룹에서 수니티닙말레이트가 우수한 hazard ratio가 관찰되었습니다. 분석 시점에서 OS 데이터는 충분하지 않았습니다. 수니티닙말레이트군에서 9명, 위약군에서 21명이 사망했습니다. 수니티닙말레이트가 위약에 비해 ORR에서 통계적으로 유의한 차이를 보였습니다. 유효성 결과는 Table 15에 요약되어 있고 PFS에 대한 Kaplan-Meier 곡선은 Figure 4에 있습니다.
Table 15. Study 6에서의 pNET 유효성 결과
| 유효성 파라미터 | Sunitinib Malate (N=86) |
Placebo (N=85) |
p-value | HR (95% CI) |
| 무진행 생존 기간 [중앙값, 개월 (95% CI)] |
10.2 (7.4, 16.9) |
5.4 (3.4, 6) |
0.000146a | 0.427(0.271, 0.673) |
| 객관적 반응률 [%, (95% CI)] |
9.3 (3.2, 15.4) |
0 | 0.0066b | NA |
약어: CI=신뢰구간; HR=hazard ratio; N=환자 수; NA=해당 없음; pNET=췌장 신경내분비 종양.
a 2-sided unstratified log-rank test.
b Fisher’s Exact test.
Figure 4. pNET Study 6에서의 PFS에 대한 Kaplan-Meier 곡선
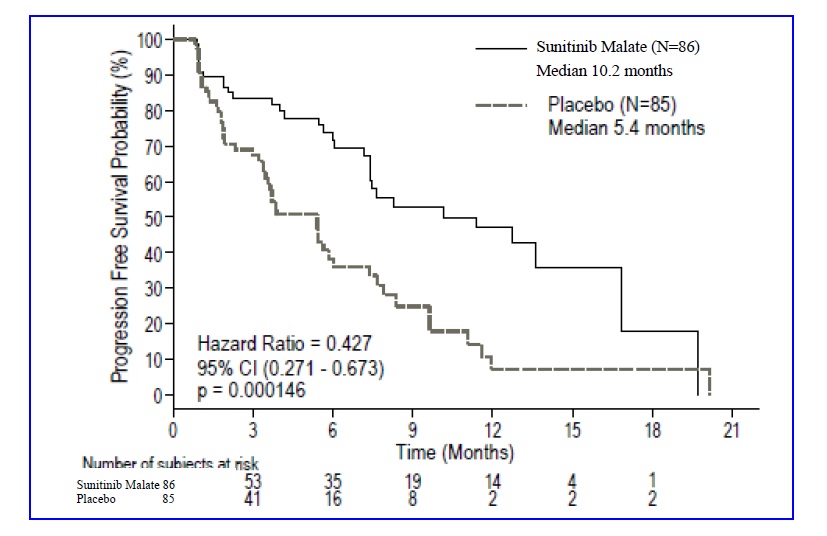
약어: CI=신뢰구간; N=환자 수; PFS=무진행 생존 기간; pNET=췌장 신경내분비 종양.
16 제공/보관 및 취급 방법
Sunitinib malate 12.5 mg 캡슐은 진한 회색 색상의 캡과 진한 회색 색상의 바디로 이루어진 하드 젤라틴 캡슐에 노란색에서 주황색을 띠는 과립이 채워져 있으며, 캡에는 흰색 잉크로 ‘SC’가, 바디에는 ‘12.5’가 인쇄되어 있습니다.
28개들이 병 NDC 43598-045-63
28개들이 단위 용량 블리스터 포장 NDC 43598-045-28
Sunitinib malate 25 mg 캡슐은 검은색 캡과 검은색 바디로 이루어진 하드 젤라틴 캡슐에 노란색에서 주황색을 띠는 과립이 채워져 있으며, 캡에는 흰색 잉크로 ‘SC’가, 바디에는 ’25’가 인쇄되어 있습니다.
28개들이 병 NDC 43598-046-63
28개들이 단위 용량 블리스터 포장 NDC 43598-046-28
Sunitinib malate 37.5 mg 캡슐은 검은색 캡과 회색 바디로 이루어진 하드 젤라틴 캡슐에 노란색에서 주황색을 띠는 과립이 채워져 있으며, 캡에는 흰색 잉크로 ‘SC’가, 바디에는 ‘37.5’가 인쇄되어 있습니다.
28개들이 병 NDC 43598-047-63
28개들이 단위 용량 블리스터 포장 NDC 43598-047-28
Sunitinib malate 50 mg 캡슐은 회색 캡과 회색 바디로 이루어진 하드 젤라틴 캡슐에 노란색에서 주황색을 띠는 과립이 채워져 있으며, 캡에는 흰색 잉크로 ‘SC’가, 바디에는 ’50’이 인쇄되어 있습니다.
28개들이 병 NDC 43598-048-63
28개들이 단위 용량 블리스터 포장 NDC 43598-048-28
20°C ~ 25°C (68°F ~ 77°F)에서 보관하십시오. 15°C ~ 30°C (59°F ~ 86°F)로의 일시적인 온도 변화는 허용됩니다[USP Controlled Room Temperature 참조].
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨(Medication Guide)을 읽도록 권고합니다.
간독성
간독성의 징후와 증상에 대해 환자에게 알립니다. 간독성의 징후나 증상이 나타나면 즉시 의료 서비스 제공자에게 연락하도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.1)].
심혈관계 이벤트
심부전 증상이 나타나면 의료 서비스 제공자에게 연락하도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.2)].
QT 연장 및 Torsade de Pointes
QT 연장의 징후와 증상에 대해 환자에게 알립니다. 실신, 실신 전 증상, 심계항진이 발생하면 즉시 의료 서비스 제공자에게 연락하도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.3)].
고혈압
고혈압의 징후와 증상에 대해 환자에게 알립니다. 정기적인 혈압 모니터링을 받고 혈압이 상승하거나 고혈압의 징후나 증상이 나타나면 의료 서비스 제공자에게 연락하도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.4)].
출혈 이벤트
Sunitinib malate가 심각한 출혈을 유발할 수 있음을 환자에게 알립니다. 출혈이나 출혈 증상이 있는 경우 즉시 의료 서비스 제공자에게 연락하도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.5)].
위장관계 질환
Sunitinib malate 치료 중 설사, 구역, 구토, 변비와 같은 위장관계 질환이 발생할 수 있으며, sunitinib malate를 복용한 환자에서 위장관 천공 및 누공 사례가 보고되었으므로 지속적이거나 심각한 복통이 있는 경우 즉시 의학적 조치를 구하도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.5), 이상반응(6.1)].
피부 영향 및 독성
Sunitinib malate 치료 중 약물 색상(노란색)으로 인해 모발이나 피부 색소 침착이 발생할 수 있음을 환자에게 알립니다. 기타 가능한 피부 영향으로는 손바닥과 발바닥의 피부 건조, 두꺼워짐, 갈라짐, 물집 또는 발진 등이 있습니다. Stevens-Johnson 증후군, 독성 표피 괴사융해증, 다형 홍반, 괴사성 근막염 등의 심각한 피부 독성이 보고되었습니다. 심각한 피부 반응이 발생하면 즉시 의료 서비스 제공자에게 알리도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.9), 이상반응(6.1)].
가역적 후백질뇌병증 증후군
가역적 후백질뇌병증 증후군의 징후와 증상에 대해 환자에게 알립니다. 가역적 후백질뇌병증 증후군의 증상이 나타나면 의료 서비스 제공자에게 연락하도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.10)].
갑상선 기능 장애
Sunitinib malate가 갑상선 기능 장애를 유발할 수 있음을 환자에게 알립니다. 비정상적인 갑상선 기능의 증상이 발생하면 의료 서비스 제공자에게 연락하도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.11)].
저혈당증
Sunitinib malate는 심각한 저혈당증을 유발할 수 있으며 당뇨병 치료제를 복용하는 당뇨병 환자에게 더 심할 수 있음을 환자에게 알립니다. 저혈당증과 관련된 징후, 증상 및 위험에 대해 환자에게 알립니다. 심각한 저혈당증의 징후나 증상이 나타나면 즉시 의료 서비스 제공자에게 알리도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.12)].
턱뼈 골괴사
환자에게 양호한 구강 위생 습관에 대해 알리고 계획된 치과 시술에 대해 의료 서비스 제공자에게 알리도록 합니다. 턱뼈 골괴사와 관련된 징후나 증상이 있는 경우 즉시 의료 서비스 제공자에게 연락하도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.13)].
상처 치유 장애
Sunitinib malate가 상처 치유를 저해함을 환자에게 알립니다. 계획된 수술에 대해 의료 서비스 제공자에게 알리도록 환자에게 권고합니다 [경고 및 주의사항 참조(5.14)].
병용 투여 약물
처방전 없이 구입할 수 있는 약물 및 식이 보충제를 포함하여 모든 병용 투여 약물에 대해 의료 서비스 제공자에게 알리도록 환자에게 권고합니다 [약물 상호작용 참조(7)].
태아 독성
임신부에게 태아에 대한 잠재적 위험에 대해 알립니다. 알려진 또는 의심되는 임신에 대해 의료 서비스 제공자에게 알리도록 가임기 여성에게 권고합니다 [경고 및 주의사항 참조(5.15), 특정 집단에서의 사용(8.1)].
Sunitinib malate 투여 기간 및 마지막 투여 후 4주 동안 효과적인 피임법을 사용하도록 가임기 여성에게 권고합니다 [특정 집단에서의 사용 참조(8.3)].
Sunitinib malate 투여 기간 및 마지막 투여 후 7주 동안 가임기 여성 파트너와 효과적인 피임법을 사용하도록 남성에게 권고합니다 [특정 집단에서의 사용 참조(8.3)].
수유
Sunitinib malate capsules 치료 기간 및 마지막 투여 후 최소 4주 동안 모유 수유를 하지 않도록 여성에게 권고합니다 [특정 집단에서의 사용 참조(8.2)].
불임
Sunitinib malate가 남성 및 여성의 생식 능력을 손상시킬 수 있음을 환자에게 알립니다 [특정 집단에서의 사용 참조(8.3), 비임상 독성 (13.1)].
복용을 잊은 경우
Sunitinib malate capsules 복용을 12시간 미만으로 잊은 경우 바로 잊은 용량을 복용하도록 환자에게 권고합니다. Sunitinib malate capsules 복용을 12시간 이상 잊은 경우 다음 예정된 용량을 정규 시간에 복용하도록 환자에게 권고합니다.
처방전 의약품
유통업체:
Dr. Reddy’s Laboratories Inc.,
Princeton, NJ 08540 USA
Made in India
발행일: 03/2022
SPL MEDICATION GUIDE SECTION
| 투약 안내서 Sunitinib Malate (수니티닙 말레이트) 캡슐 |
| Sunitinib malate 캡슐에 대해 내가 알아야 할 가장 중요한 정보는 무엇입니까? Sunitinib malate 캡슐은 다음을 포함한 심각한 부작용을 일으킬 수 있습니다:
•사망에 이를 수 있는 심각한 간 문제. Sunitinib malate 캡슐로 치료하는 동안 다음과 같은 간 문제의 징후와 증상이 나타나면 즉시 의료 서비스 제공자에게 알리십시오: |
| Sunitinib Malate 캡슐이란 무엇입니까? Sunitinib malate 캡슐은 다음을 치료하는 데 사용되는 처방약입니다: •위장관기질종양(GIST)이라고 불리는 위, 장 또는 식도의 희귀암이 있고 다음과 같은 경우: ∙ imatinib mesylate를 복용했지만 암 성장을 막지 못한 경우, 또는 ∙ imatinib mesylate를 복용할 수 없는 경우. •진행성 신장암(진행성 신세포암종 또는 RCC). •퍼지지 않은(국소화된) 신장암이 있는 성인으로, 신장 수술 후 RCC가 다시 발생할 고위험군인 경우. •진행되어 수술로 치료할 수 없는 췌장신경내분비종양(pNET)이라는 유형의 췌장암. Sunitinib malate 캡슐이 어린이에게 안전하고 효과적인지는 알려져 있지 않습니다. |
| Sunitinib malate 캡슐을 복용하기 전에 다음을 포함한 귀하의 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오: •심장 질환이 있는 경우 •고혈압이 있는 경우 •갑상선 문제가 있는 경우 •저혈당이나 당뇨병의 병력이 있는 경우 •신장 기능 문제가 있는 경우(암 제외) •간 문제가 있는 경우 •출혈 문제가 있는 경우 •수술을 계획 중이거나 최근에 수술을 받은 경우. 계획된 수술 최소 3주 전에 sunitinib malate 캡슐 복용을 중단해야 합니다. “Sunitinib malate 캡슐의 가능한 부작용은 무엇입니까?”를 참조하십시오. •발작이 있는 경우 •입, 치아 또는 턱에 통증이 있거나 있었던 경우, 입 안의 부종이나 궤양, 턱의 마비감이나 묵직함, 또는 치아가 느슨해지는 경우 •임신 중이거나 임신 계획이 있는 경우. Sunitinib malate 캡슐은 태아에게 해를 끼칠 수 있습니다. 임신 가능한 여성: •의료 서비스 제공자는 sunitinib malate 캡슐로 치료를 시작하기 전에 임신 검사를 해야 합니다. •Sunitinib malate 캡슐 치료 중 및 마지막 투여 후 최소 4주 동안 효과적인 피임법(피임)을 사용해야 합니다. •Sunitinib malate 캡슐로 치료하는 동안 임신했거나 임신했다고 생각되면 즉시 의료 서비스 제공자에게 알리십시오. 임신 가능한 여성 파트너가 있는 남성은 치료 중 및 sunitinib malate 캡슐의 마지막 용량 투여 후 7주 동안 효과적인 피임법(피임)을 사용해야 합니다. Sunitinib malate 캡슐은 남성과 여성 모두에게 생식 능력 문제를 일으킬 수 있습니다. 이것이 귀하에게 우려되는 사항이라면 의료 서비스 제공자에게 말씀해 주십시오. •모유 수유 중이거나 모유 수유 계획이 있는 경우. Sunitinib malate 캡슐로 치료하는 동안 및 마지막 투여 후 최소 4주(1개월) 동안 모유 수유를 하지 마십시오. 귀하에게 sunitinib malate 캡슐을 처방한 의료진에게 귀하가 sunitinib malate 캡슐을 복용하고 있다는 것을 말씀해 주십시오. 어떤 수술이나 의료 또는 치과 시술을 받기 전에 그들과 상의해야 합니다. |
| 처방약과 비처방약, 비타민, 허브 보조제를 포함하여 복용하고 있는 모든 약에 대해 의료 서비스 제공자에게 알리십시오. Sunitinib malate 캡슐을 특정 다른 약물과 함께 사용하면 심각한 부작용을 일으킬 수 있습니다. Sunitinib malate 캡슐과 bisphosphonate 약물을 함께 복용하면 심각한 턱뼈 문제(골괴사)의 위험이 증가할 수 있습니다. 특히 골다공증 약물을 복용하고 있거나 복용한 적이 있는 경우 의료 서비스 제공자에게 알리십시오. 자신이 복용하는 약을 잘 알아두십시오. 새로운 약을 받을 때 의료 서비스 제공자와 약사에게 보여줄 수 있도록 목록을 보관하십시오. |
| Sunitinib Malate 캡슐은 어떻게 복용해야 합니까? ∙ 의료 서비스 제공자가 지시한 대로 정확하게 sunitinib malate 캡슐을 복용하십시오. •Sunitinib malate 캡슐을 음식과 함께 또는 음식 없이 하루에 1회 복용하십시오. GIST 또는 RCC에 sunitinib malate 캡슐을 복용하는 경우, 보통 4주(28일) 동안 약을 복용한 다음 2주(14일) 동안 중단합니다. 이것이 1회 치료 주기입니다. 의료 서비스 제공자가 지시하는 한 이 주기를 반복하게 됩니다. •pNET에 sunitinib malate 캡슐을 복용하는 경우, 의료 서비스 제공자가 중단하라고 할 때까지 하루에 1회 복용하십시오. •Sunitinib malate 캡슐로 치료하는 동안 자몽주스를 마시거나 자몽을 먹지 마십시오. 그것들은 체내에 너무 많은 sunitinib malate 캡슐이 있도록 할 수 있습니다. •의료 서비스 제공자는 각 치료 주기 전에 부작용 여부를 확인하기 위해 혈액 검사를 할 수 있습니다. Sunitinib malate 캡슐 복용을 12시간 미만으로 놓친 경우, 놓친 복용량을 바로 복용하십시오. •Sunitinib malate 캡슐 복용을 12시간 이상 놓친 경우, 평소 시간에 다음 복용량을 복용하기만 하면 됩니다. 놓친 복용량을 보충하지 마십시오. 놓친 복용량에 대해 의료 서비스 제공자에게 알리십시오. •Sunitinib malate 캡슐을 너무 많이 복용한 경우, 즉시 의료 서비스 제공자에게 연락하십시오. |
| Sunitinib Malate 캡슐의 가능한 부작용은 무엇입니까? Sunitinib malate 캡슐은 다음을 포함한 심각한 부작용을 일으킬 수 있습니다: •“Sunitinib malate 캡슐에 대해 내가 알아야 할 가장 중요한 정보는 무엇입니까?”를 참조하십시오. •심장 문제. 심장 문제에는 사망에 이를 수 있는 심부전, 심장마비 및 심장 근육 문제(심근병증)가 포함될 수 있습니다. 매우 피곤하거나, 숨이 가쁘거나, 발과 발목이 붓는 경우 의료 서비스 제공자에게 알리십시오. •비정상적인 심장 리듬 변화. QT 연장이라고 하는 심장의 전기적 활동 변화는 생명을 위협할 수 있는 불규칙한 심장 박동을 일으킬 수 있습니다. 의료 서비스 제공자는 sunitinib malate 캡슐로 치료하는 동안 이러한 문제를 감시하기 위해 심전도 및 혈액 검사(전해질)를 수행할 수 있습니다. Sunitinib malate 캡슐로 치료하는 동안 어지럽거나, 기절하거나, 비정상적인 심장 박동이 느껴지면 즉시 의료 서비스 제공자에게 알리십시오: •현기증이나 어지러움을 느끼거나 의식을 잃은 경우 ∙심장 박동이 불규칙하거나 빠르게 느껴지는 경우 ∙어지러움 •고혈압. 고혈압은 sunitinib malate 캡슐에서 흔하며, 때로는 심각할 수 있습니다. 혈압을 정기적으로 확인하는 것에 대한 의료 서비스 제공자의 지침을 따르십시오. 혈압이 너무 높거나 조절이 어려운 경우 의료 서비스 제공자에의료 제공자에게 혈압이 높거나 다음과 같은 고혈압의 증상이나 징후가 있는지 알리십시오: •심한 두통 •어지러움 •현기증 •시력 변화 필요한 경우 의료 제공자가 고혈압 치료를 위한 약을 처방할 수 있습니다. •출혈 문제. Sunitinib malate 캡슐로 인한 출혈은 흔하지만, 사망에 이를 수 있는 심각한 출혈 문제를 일으킬 수도 있습니다. 의료 제공자는 출혈 여부를 모니터링하고 필요한 경우 혈액 검사를 수행할 수 있습니다. Sunitinib malate 캡슐 치료 중 다음과 같은 증상이나 심각한 출혈 문제가 발생하면 즉시 의료 제공자에게 연락하십시오: •복부 통증 및 부기 •혈뇨 •구토 시 피가 섞임 •두통 •정신 상태 변화 •검고 끈적끈적한 대변 •기침 시 피가 섞임 •때로는 사망에 이를 수 있는 심각한 위장 문제. 일부 사람들은 위나 장에 찢어짐(천공)이 생기거나 위와 장 사이에 비정상적인 개구부(누공)가 생겼습니다. Sunitinib malate 캡슐 치료 중 복부 통증이 가시지 않거나 심해지면 즉시 의학적 도움을 받으십시오. •종양 용해 증후군(TLS). TLS는 암세포가 빠르게 붕괴되어 발생하며 사망에 이를 수 있습니다. TLS는 신부전 및 투석 치료 필요, 비정상적인 심장 리듬, 발작을 유발할 수 있으며 때로는 사망에 이릅니다. 의료 제공자는 TLS 여부를 확인하기 위해 혈액 검사를 수행할 수 있습니다. |
| •뇌의 비정상적인 변화(가역적 후두부 백질뇌병증 증후군[RPLS]). RPLS는 두통, 혼란, 시력 상실 등 다양한 증상을 유발할 수 있습니다. Sunitinib malate 캡슐을 복용한 일부 사람들은 사망에 이를 수 있는 RPLS가 발병했습니다. •혈전성 혈소판 감소성 자반증(TTP) 및 용혈성 요독 증후군(HUS)을 포함한 혈전성 미세 혈관병증(TMA). TMA는 sunitinib malate 캡슐 복용 중 발생할 수 있는 가장 작은 혈관 손상 및 혈전과 관련된 질환입니다. TMA는 적혈구 및 응고 관련 세포 감소를 동반합니다. TMA는 뇌와 신장과 같은 신체 장기에 해를 끼칠 수 있으며 때로는 사망에 이를 수 있습니다. •단백뇨. Sunitinib malate 캡슐을 복용한 일부 사람들은 단백뇨가 발생했으며, 경우에 따라 사망에 이를 수 있는 신장 문제가 발생했습니다. 의료 제공자가 이 문제를 확인할 것입니다. •심각한 피부 및 구강 반응. Sunitinib malate 캡슐 치료는 다음을 포함하여 사망에 이를 수 있는 심각한 피부 반응을 유발했습니다:물집이나 피부 박리를 동반한 심한 발진.피부, 입술 또는 구강 내 통증이 있는 궤양.조직 손상(괴사성 근막염).심각한 피부 반응의 증상이나 징후가 있는 경우 sunitinib malate 캡슐 복용을 중단하고 의료 제공자에게 연락하거나 즉시 의학적 도움을 받으십시오. •갑상선 문제. 의료 제공자는 sunitinib malate 캡슐 치료 중 갑상선 기능을 확인하기 위해 검사를 수행할 수 있습니다. Sunitinib malate 캡슐로 치료하는 동안 다음과 같은 증상이 나타나면 의료 제공자에게 알리십시오: o 개선되지 않고 악화되는 피로 o 체중 증가 또는 체중 감소식욕 부진 o 우울증 열 조절 문제 o 불규칙한 월경 또는 무월경 초조함, 떨림 o 두통 구역질 또는 구토 o 탈모 설사 •저혈당(저혈당증). Sunitinib malate 캡슐로 인해 저혈당이 발생할 수 있으며, 의식을 잃거나 입원이 필요할 수 있습니다. 당뇨병이 있고 당뇨병 치료제를 복용하는 사람의 경우 sunitinib malate 캡슐로 인한 저혈당이 더 심할 수 있습니다. 의료 제공자는 sunitinib malate 캡슐 치료 중 정기적으로 혈당 수치를 확인해야 하며 당뇨병 치료제 용량을 조정해야 할 수 있습니다. Sunitinib malate 캡슐 치료 중 다음과 같은 저혈당 증상이 나타나면 즉시 의료 제공자에게 연락하십시오. •두통 • 과민성 •졸음 •허기심장 박동이 빨라짐어지러움 •발한혼란 •초조함 •턱뼈 문제(골괴사). Sunitinib malate 캡슐을 복용하는 일부 사람들에게 심각한 턱뼈 문제가 발생했습니다. Bisphosphonate 약물 복용이나 치과 질환과 같은 특정 위험 요소는 골괴사 발생 위험을 높일 수 있습니다. 의료 제공자는 sunitinib malate 캡슐 복용을 시작하기 전에 치과 의사를 만나보라고 말할 수 있습니다. 특히 bisphosphonate 약물을 정맥 주사로 투여받는 경우 sunitinib malate 캡슐 치료 중 가능하면 치과 시술을 피하라고 말할 수 있습니다. Sunitinib malate 캡슐 치료 전이나 치료 중에 치과 시술을 계획하고 있다면 의료 제공자에게 알리십시오. 계획된 치과 시술 최소 3주 전에 sunitinib malate 캡슐 복용을 중단해야 합니다. 치과 시술 후 sunitinib malate 캡슐 복용을 다시 시작해도 되는 시기를 의료 제공자가 알려줄 것입니다. •상처 치유 문제. Sunitinib malate 캡슐을 복용하는 일부 사람들에게 상처 치유 문제가 발생했습니다. Sunitinib malate 캡슐 치료 전이나 치료 중에 수술을 계획하고 있다면 의료 제공자에게 알리십시오. 계획된 수술 최소 3주 전에 sunitinib malate 캡슐 복용을 중단해야 합니다. 수술 후 sunitinib malate 캡슐 복용을 다시 시작해도 되는 시기를 의료 제공자가 알려줄 것입니다. 심각한 부작용이 발생하면 의료 제공자가 일시적으로 sunitinib malate 복용을 중단하거나 용량을 줄이거나 치료를 영구적으로 중단할 수 있습니다. Sunitinib malate 캡슐의 흔한 부작용은 다음과 같습니다: 피로 o 구토쇠약 o 복부 통증설사 o 손바닥과 발바닥에 물집이나 발진 구강 내 통증, 부기 또는 염증 고혈압구역 o 미각 변화식욕 감소 o 혈소판 감소 o 소화불량 Sunitinib malate 캡슐의 약물은 노란색이며 피부가 노랗게 보일 수 있습니다. 피부와 머리카락이 밝아질 수 있습니다. Sunitinib malate 캡슐은 또한 다음을 포함한 다른 피부 문제를 유발할 수 있습니다: 건조함, 두꺼워짐 또는 피부 갈라짐. 이것들은 sunitinib malate 캡슐의 가능한 모든 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 1-800-FDA-1088로 부작용을 보고할 수 있습니다. |
| Sunitinib Malate 캡슐은 어떻게 보관해야 합니까? Sunitinib malate 캡슐은 68°F~77°F(20°C~25°C)의 실온에서 보관하십시오. Sunitinib malate 캡슐과 모든 약은 어린이의 손이 닿지 않는 곳에 보관하십시오. |
| Sunitinib malate 캡슐의 안전하고 효과적인 사용에 대한 일반 정보.약은 때때로 Medication Guide에 나열된 것 이외의 목적으로 처방됩니다. 처방되지 않은 상태에 sunitinib malate 캡슐을 사용하지 마십시오. 증상이 동일하더라도 다른 사람에게 sunitinib malate 캡슐을 주지 마십시오. 해를 끼칠 수 있습니다. 의료 제공자나 약사에게 건강을 위해 작성된 sunitinib malate 캡슐에 대한 정보를 요청할 수 있습니다.th 전문가들과 상담하십시오. |
| Sunitinib Malate 캡슐의 성분은 무엇입니까? 활성 성분: sunitinib malate 비활성 성분: 크로스카멜로오스나트륨, 마그네슘스테아레이트, 만니톨 및 povidone (K-25). 캡슐 셸: 12.5mg 캡슐 셸은 젤라틴, 산화철 블랙, 산화철 레드, 산화철 황색, 소듐라우릴황산염 및 이산화티타늄을 포함합니다. 25mg, 37.5mg 및 50mg 캡슐 셸은 젤라틴, 산화철 블랙, 소듐라우릴황산염 및 이산화티타늄을 포함합니다. 흰색 프린팅 잉크: 부틸알코올, 무수알코올, 이소프로필알코올, 수산화칼륨 프로필렌글리콜, 셸락, 암모니아수 및 이산화티타늄. 배포업체: Dr. Reddy’s Laboratories Inc., 더 자세한 정보는 Dr. Reddy’s Laboratories Inc.에 1-888-375-3784번으로 문의하십시오. 이 의약품 가이드는 미국 식품의약국(U.S. Food and Drug Administration)의 승인을 받았습니다. 개정: 2022년 3월 |
패키지 라벨 주요 표시 패널 부분

주요 표시 패널

제품 포장 전면부

주요 표시 패널


