의약품 제조업체: Bayer HealthCare Pharmaceuticals Inc. (Updated: 2020-12-09)
처방 정보 요약
STIVARGA® (regorafenib) 정제, 경구 투여용
Initial U.S. Approval: 2012
적응증 및 사용법
STIVARGA는 키나아제 억제제로 다음 환자의 치료에 사용합니다:
제형 및 함량
정제: 40mg (3)
금기사항
없음. (4)
경고 및 주의사항
- •
- 간독성: 간 기능 검사를 모니터링하십시오. 중증도와 지속 기간에 따라 STIVARGA 투여를 보류하고 감량 또는 중단하십시오. (5.1)
- •
- 감염: 감염이 악화되거나 중증인 환자에서 STIVARGA 투여를 보류하십시오. (5.2)
- •
- 출혈: 중증 또는 생명을 위협하는 출혈의 경우 STIVARGA 투여를 영구 중단하십시오. (5.3)
- •
- 위장관 천공 또는 누공: STIVARGA 투여를 중단하십시오. (5.4)
- •
- 피부 독성: 피부 독성의 중증도와 지속 여부에 따라 STIVARGA 투여를 보류하고 감량 또는 중단하십시오. (5.5)
- •
- 고혈압: 중증 또는 조절되지 않는 고혈압의 경우 STIVARGA 투여를 일시적 또는 영구적으로 보류하십시오. (5.6)
- •
- 심장 허혈 및 경색: 새로운 또는 급성 심장 허혈/경색의 경우 STIVARGA 투여를 보류하고 급성 허혈 사건이 해결된 후에만 투여를 재개하십시오. (5.7)
- •
- 가역성 후백질 뇌병증 증후군(RPLS): STIVARGA 투여를 중단하십시오. (5.8)
- •
- 상처 치유 장애 위험: 선택적 수술 전 최소 2주 동안 투여를 보류하십시오. 대수술 후 최소 2주 동안 그리고 상처가 적절히 치유될 때까지 투여하지 마십시오. 상처 치유 합병증이 해결된 후 STIVARGA 투여 재개의 안전성은 확립되지 않았습니다. (5.9)
- •
- 배아-태아 독성: 태아에게 유해할 수 있습니다. 여성에게 태아에 대한 잠재적 위험과 치료 중 및 최종 투여 후 2개월 동안 효과적인 피임을 사용할 것을 알리십시오. 남성에게 최종 투여 후 2개월 동안 효과적인 피임을 사용할 것을 알리십시오. (5.10,8.1, 8.3)
이상반응
가장 흔한 이상반응(≥20%)은 통증(위장관 및 복부 통증 포함), HFSR, 무력증/피로, 설사, 식욕 감소/음식 섭취 감소, 고혈압, 감염, 발성 장애, 고빌리루빈혈증, 발열, 점막염, 체중 감소, 발진, 구역입니다. (6)
의심되는 이상반응을 보고하려면 Bayer HealthCare Pharmaceuticals Inc.에 1-888-842-2937 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호작용
특정 집단에서의 사용
수유부: 환자에 대한 약물의 중요성을 고려하여 약물 투여 또는 수유를 중단하십시오. (8.3)
환자 상담 정보 및 FDA 승인 환자 라벨링은 17번을 참조하십시오.
개정일: 2020년 12월
목차
전체 처방 정보: 내용물*
경고: 간독성
1 적응증 및 사용법
1.1 대장직장암
1.2 위장관기질종양
1.3 간세포암종
2 용법 및 용량
2.1 권장 용량
2.2 용량 조절
3 제형 및 함량
4 금기사항
5 경고 및 주의사항
5.1 간독성
5.2 감염증
5.3 출혈
5.4 위장관 천공 또는 누공
5.5 피부 독성
5.6 고혈압
5.7 심근 허혈 및 경색
5.8 가역성 후방 백질뇌증 증후군
5.9 상처 치유 장애 위험
5.10 배아-태아 독성
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 강력한 CYP3A4 유도제가 Regorafenib에 미치는 영향
7.2 강력한 CYP3A4 저해제가 Regorafenib에 미치는 영향
7.3 Regorafenib이 Breast Cancer Resistance Protein (BCRP) 기질에 미치는 영향
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.3 생식 가능한 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 간장애
8.7 신장애
8.8 인종
10 과량투여
11 제품설명
12 임상약리
12.1 작용기전
12.2 약력학
12.3 약동학
13 비임상 독성
13.1 발암성, 변이원성, 생식능력 장애
13.2 동물 독성학 및/또는 약리학
14 임상 연구
14.1 대장직장암
14.2 위장관기질종양
14.3 간세포암종 (HCC)
16 공급/보관 및 취급 방법
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
블랙박스 경고
경고: 간독성
- •
- 임상 시험에서 중증의 때로는 치명적인 간독성이 발생했습니다 [경고 및 주의사항 참조 (5.1)].
- •
- 치료 전과 치료 중에 간 기능을 모니터링하십시오 [경고 및 주의사항 참조 (5.1)].
- •
- 중증도와 지속성에 따라 간 기능 검사 상승 또는 간세포 괴사로 나타나는 간독성의 경우 STIVARGA를 중단한 후 감량 또는 중단하십시오 [용법용량 참조 (2.2)].
1 적응증 및 사용법
1.1 결장직장암
STIVARGA는 이전에 fluoropyrimidine, oxaliplatin, irinotecan 기반 화학요법, anti-VEGF 요법, 그리고 RAS wild-type인 경우 anti-EGFR 요법으로 치료받은 전이성 결장직장암(CRC) 환자의 치료에 적응증이 있습니다.
1.2 위장관기질종양
STIVARGA는 이전에 imatinib mesylate와 sunitinib malate로 치료받은 국소 진행성, 절제 불가능 또는 전이성 위장관기질종양(GIST) 환자의 치료에 적응증이 있습니다.
2 용법 용량
2.1 권장 용량
권장 용량은 STIVARGA 160 mg (40 mg 정제 4정)을 매 28일 주기의 처음 21일 동안 1일 1회 경구 투여하는 것입니다. 질병이 진행되거나 허용할 수 없는 독성이 나타날 때까지 치료를 지속합니다.
STIVARGA는 매일 같은 시간에 복용하십시오. 600 칼로리 미만, 지방 30% 미만의 저지방 식사 후 물과 함께 정제를 통째로 삼키십시오 [12.3 임상약리학 참조]. 전날 놓친 복용량을 보충하기 위해 같은 날 STIVARGA를 두 번 복용하지 마십시오.
2.2 용량 조절
용량 조절이 필요한 경우, 40 mg (1정)씩 감량하십시오; STIVARGA의 최저 권장 일일 용량은 80 mg입니다.
다음과 같은 경우 STIVARGA 투여를 중단하십시오:
- •
- 용량 감량에도 불구하고 7일 이내에 개선되지 않거나 반복되는 Grade 2 hand-foot skin reaction (HFSR) [palmar-plantar erythrodysesthesia syndrome (PPES)]; Grade 3 HFSR의 경우 최소 7일 동안 투여 중단
- •
- 증상이 있는 Grade 2 고혈압
- •
- Grade 3 또는 4 이상반응
- •
- 악화되는 감염(any grade)
다음과 같은 경우 STIVARGA 용량을 120 mg으로 감량하십시오:
- •
- Grade 2 HFSR이 처음 발생한 경우(지속 기간에 상관없이)
- •
- 감염을 제외한 Grade 3 또는 4 이상반응에서 회복된 후
- •
- Grade 3 aspartate aminotransferase (AST)/alanine aminotransferase (ALT) 상승의 경우, 간독성의 위험보다 잠재적 이점이 더 클 때만 투여 재개
다음과 같은 경우 STIVARGA 용량을 80 mg으로 감량하십시오:
- •
- 120 mg 용량에서 Grade 2 HFSR이 재발한 경우
- •
- 120 mg 용량에서 Grade 3 또는 4 이상반응(간독성 또는 감염 제외)에서 회복된 후
다음과 같은 경우 STIVARGA 투여를 영구 중단하십시오:
- •
- 80 mg 용량을 견디지 못하는 경우
- •
- AST 또는 ALT가 정상 상한치(ULN)의 20배를 초과하는 경우
- •
- AST 또는 ALT가 ULN의 3배를 초과하면서 동시에 bilirubin이 ULN의 2배를 초과하는 경우
- •
- 120 mg으로 용량 감량에도 불구하고 AST 또는 ALT가 ULN의 5배를 초과하여 재발하는 경우
- •
- Grade 4 이상반응이 발생한 경우; 잠재적 이점이 위험을 상회할 때만 투여 재개
3 제형 및 함량
STIVARGA는 한 면에는 ‘BAYER’, 다른 한 면에는 ’40’이 음각되어 있는 40 mg의 연한 분홍색, 타원형, 필름 코팅 정제입니다.
4 금기 사항
없음.
5 경고 및 주의사항
5.1 간독성
임상 시험에서 STIVARGA를 투여받은 환자에게 치명적인 결과를 초래한 중증의 약물 유발성 간 손상이 발생했습니다. 대부분의 경우 간 기능 장애는 치료 시작 후 처음 2개월 이내에 발생했으며 간세포 유형의 손상 특징을 보였습니다.
CORRECT 연구에서 레고라페닙 투여군의 1.6%, 위약군의 0.4%에서 치명적인 간부전이 발생했습니다. GRID 연구에서는 레고라페닙 투여군의 0.8%에서 치명적인 간부전이 발생했습니다. RESORCE 연구에서는 위약과 비교하여 치명적인 간부전 발생률 증가가 없었습니다 [이상 반응 참조 (6.1)].
STIVARGA 투여 시작 전에 간 기능 검사(ALT, AST 및 bilirubin)를 실시하고 치료 첫 2개월 동안 최소 2주에 한 번씩 모니터링합니다. 이후에는 매월 또는 임상적으로 필요한 경우 더 자주 모니터링합니다. 간 기능 검사 수치가 상승한 환자는 ULN의 3배 미만 또는 기저치로 회복될 때까지 매주 간 기능 검사를 모니터링합니다.
간 기능 검사 상승 또는 간세포 괴사로 나타나는 간독성의 중증도 및 지속성에 따라 STIVARGA를 일시적으로 보류한 후 감량하거나 영구 중단합니다 [용량 및 투여 참조 (2.2), 특정 집단에서의 사용 (8.6)].
5.2 감염
STIVARGA는 감염 위험을 높였습니다. 무작위 위약 대조 시험에서 STIVARGA 투여 환자 1142명의 전반적인 감염 발생률(1-5등급)은 대조군에 비해 더 높았습니다(32% vs. 17%). STIVARGA 투여 환자에서 3등급 이상 감염의 발생률은 9%였습니다. 가장 흔한 감염은 요로 감염(5.7%), 비인두염(4.0%), 점막피부 및 전신 진균 감염(3.3%), 폐렴(2.6%)이었습니다. 감염으로 인한 치명적 결과는 위약 투여 환자(0.3%)에 비해 STIVARGA 투여 환자(1.0%)에서 더 자주 발생했습니다. 가장 흔한 치명적 감염은 호흡기 감염이었습니다(STIVARGA 투여 환자의 0.6% vs 위약 투여 환자의 0.2%).
3등급 또는 4등급 감염, 또는 등급에 관계없이 악화되는 감염의 경우 STIVARGA 투여를 보류합니다. 감염이 해결된 후 동일한 용량으로 STIVARGA를 재개합니다 [용량 및 투여 참조 (2.2)].
5.3 출혈
STIVARGA는 출혈 발생률을 높였습니다. 무작위 위약 대조 시험에서 STIVARGA를 투여받은 1142명의 환자에서 전체 발생률(1-5등급)은 18.2%, 위약을 투여받은 환자에서는 9.5%였습니다. STIVARGA 투여 환자에서 3등급 이상 출혈의 발생률은 3.0%였습니다. 치명적 출혈 사례는 0.7%였으며, 중추신경계 또는 호흡기, 위장관, 비뇨생식기 출혈과 관련이 있었습니다.
중증 또는 생명을 위협하는 출혈이 발생한 환자는 STIVARGA 투여를 영구 중단합니다. Warfarin을 투여받는 환자는 INR 수치를 더 자주 모니터링합니다 [임상 약리학 참조 (12.3)].
5.4 위장관 천공 또는 누공
단독요법으로 STIVARGA를 투여받은 모든 임상 시험의 4518명 환자 중 0.6%에서 위장관 천공이 발생했으며, 이 중 8건은 치명적이었습니다.
무작위 위약 대조 시험 전반에서 STIVARGA 투여 환자의 0.8%, 위약군 환자의 0.2%에서 위장관 누공이 발생했습니다. 위장관 천공 또는 누공이 발생한 환자는 STIVARGA 투여를 영구 중단합니다.
5.5 피부 독성
무작위 위약 대조 시험에서 레고라페닙군 환자의 71.9%, 위약군 환자의 25.5%에서 수족 피부 반응(HFSR, hand-foot skin reaction), 즉 수족 홍반 감각 이상 증후군(PPES, palmar-plantar erythrodysesthesia syndrome)과 용량 조절이 필요한 중증 발진을 포함한 피부 이상 반응이 발생했습니다.
무작위 위약 대조 시험에서 HFSR의 전체 발생률은 STIVARGA 투여 환자 1142명(53%)에서 위약 투여 환자(8%)보다 더 높았습니다. STIVARGA 투여 환자의 대부분에서 HFSR은 첫 번째 치료 주기 동안 나타났습니다. 3등급 HFSR(16% vs <1%), 3등급 발진(3% vs <1%), 다형 홍반(<0.1% vs. 0%)과 스티븐스-존슨 증후군(<0.1% vs. 0%)의 중대한 이상 반응 발생률도 STIVARGA 투여 환자에서 더 높았습니다 [이상 반응 (6.1) 참조]. 모든 시험에서 STIVARGA를 투여받은 아시아 환자에서 HFSR 발생률이 더 높게 관찰되었습니다(all grades: 72%; Grade 3: 18%) [특정 집단에서의 사용 (8.8) 참조].
단독요법으로 STIVARGA를 투여받은 모든 임상 시험의 4518명 환자 중 0.02%에서 독성 표피 괴사융해증이 발생했습니다.
피부 독성의 중증도와 지속성에 따라 STIVARGA 투여를 보류하거나 용량을 줄이거나 영구 중단합니다 [용량 및 투여 참조 (2.2)]. 증상 완화를 위한 지지 요법을 시행합니다.
5.6 고혈압
무작위 위약 대조 시험에서 레고라페닙군 환자의 0.2%에서 고혈압 위기가 발생했지만 위약군에서는 발생하지 않았습니다. STIVARGA는 고혈압 발생률을 높였습니다(CORRECT에서 30% vs 8%, GRID에서 59% vs 27%, RESORCE에서 31% vs 6%) [이상 반응 (6.1) 참조]. 고혈압이 발생한 대부분의 환자(무작위 위약 대조 시험의 67%)에서 고혈압은 첫 번째 치료 주기 동안 발생했습니다.
혈압이 적절히 조절되지 않는 한 STIVARGA 투여를 시작하지 마십시오. 치료 시작 후 처음 6주 동안은 매주, 그 후에는 매 주기마다 또는 임상적으로 필요한 경우 더 자주 혈압을 모니터링합니다. 중증 또는 조절되지 않는 고혈압의 경우 STIVARGA 투여를 일시적 또는 영구적으로 중단합니다 [용량 및 투여 참조 (2.2)].
5.7 심장 허혈 및 경색
STIVARGA는 무작위 위약 대조 시험에서 심근 허혈 및 경색의 발생률(0.9% vs 0.2%)을 증가시켰습니다 [이상 반응 참조(6.1)]. 심장 허혈 또는 경색이 새로 발생하거나 급성으로 발생한 환자에서는 STIVARGA 투여를 보류하십시오. 급성 심장 허혈 사건이 해결된 후에만 STIVARGA 투여를 재개하되, 추가적인 심장 허혈의 위험보다 잠재적 이점이 더 클 경우에만 투여하십시오.
5.8 가역적 후뇌병증 증후군
MRI에서 특징적인 소견으로 진단되는 피질하 혈관성 부종 증후군인 가역적 후뇌병증 증후군(RPLS)이 모든 임상 시험에서 STIVARGA 투여 환자 4800명 중 1명에서 발생했습니다. 발작, 심한 두통, 시각 장애, 혼란 또는 정신 기능 변화가 있는 환자에 대해 RPLS 평가를 수행하십시오. RPLS가 발생한 환자에게는 STIVARGA 투여를 중단하십시오.
5.9 상처 치유 장애 위험
VEGF 신호 전달 경로를 억제하는 약물을 투여받는 환자에서는 상처 치유 합병증이 발생할 수 있습니다. 따라서 STIVARGA는 상처 치유에 부정적인 영향을 미칠 가능성이 있습니다.
선택적 수술 전 최소 2주 동안 STIVARGA 투여를 보류하십시오. 대수술 후 최소 2주 동안, 그리고 적절한 상처 치유가 이루어질 때까지 투여하지 마십시오. 상처 치유 합병증이 해결된 후 STIVARGA 투여 재개의 안전성은 확립되지 않았습니다.
5.10 배아-태아 독성
동물 연구 및 작용 기전에 따르면 STIVARGA는 임신한 여성에게 투여할 경우 태아에게 해를 줄 수 있습니다. 임신한 여성에 대한 STIVARGA 사용에 대해 이용 가능한 데이터는 없습니다. Regorafenib은 권장 용량에서의 인체 노출보다 낮은 노출에서 랫드와 토끼에서 배아 치사 및 최기형성을 나타냈으며, 심혈관계, 비뇨생식기계 및 골격 기형의 발생률이 증가했습니다. 임신한 여성에게 태아에 대한 잠재적 위험을 알리십시오.
가임기 여성에게 STIVARGA 치료 중 및 최종 투여 후 2개월 동안 효과적인 피임법을 사용하도록 조언하십시오. 가임기 여성 파트너가 있는 남성에게 STIVARGA 치료 중 및 최종 투여 후 2개월 동안 효과적인 피임법을 사용하도록 조언하십시오 [특정 집단에서의 사용 참조(8.1), (8.3)].
6 ADVERSE REACTIONS
다음과 같은 심각한 이상반응은 라벨의 다른 부분에서 다루고 있습니다:
- •
- 간독성 [경고 및 주의사항(5.1)참조]
- •
- 감염 [경고 및 주의사항(5.2)참조]
- •
- 출혈 [경고 및 주의사항(5.3)참조]
- •
- 위장관 천공 또는 누공 [경고 및 주의사항(5.4)참조]
- •
- 피부 독성 [경고 및 주의사항(5.5)참조]
- •
- 고혈압 [경고 및 주의사항(5.6)참조]
- •
- 심근 허혈 및 심근경색 [경고 및 주의사항(5.7)참조]
- •
- 가역성후두부백질뇌증(RPLS) [경고 및 주의사항(5.8)참조]
6.1 임상시험 경험
임상시험은 다양한 조건에서 수행되므로, 한 약물의 임상시험에서 관찰된 이상반응 발생률을 다른 약물의 임상시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제 관찰된 발생률을 반영하지 못할 수 있습니다.
경고 및 주의사항 섹션에 설명된 데이터는 4개의 무작위 배정 위약대조 임상시험(n=1142), 확대 접근 프로그램(CONSIGN, n=2864) 또는 단일군 임상시험(단독요법 또는 다른 약물과 병용)에 등록된 4800명 이상의 스티바가 투여 환자의 경험을 반영합니다. 4518명의 환자가 스티바가 단독요법을 받았으며, 기저 악성종양의 분포는 80%가 대장직장암, 4%가 위장관기질종양, 10%가 간세포암종, 6%가 다른 고형종양이었습니다. 이 중 74%가 백인, 11%가 아시아인, 15%는 인종이 알려지지 않았습니다. 이 4518명의 환자 중 83%가 최소 21일 동안 스티바가를 투여받았고, 20%는 6개월 이상 스티바가를 투여받았습니다.
무작위 배정 위약대조 임상시험(CORRECT, GRID, RESORCE, CONCUR)에서 스티바가 투여 환자의 20% 이상에서 가장 흔히 관찰된 이상반응은 통증(위장관 및 복통 포함), 손발구진성발진, 권태감/피로, 설사, 식욕감소/식욕부진, 고혈압, 감염, 발성장애, 고빌리루빈혈증, 발열, 점막염, 체중감소, 발진, 구역이었습니다.
대장직장암
아래에 설명된 안전성 데이터는 달리 명시되지 않는 한 무작위 배정(2:1), 이중맹검, 위약대조 임상시험(CORRECT)에서 도출되었습니다. 이 임상시험에서 이전에 치료받은 전이성 대장직장암 환자 500명(중앙연령 61세; 61% 남성)은 스티바가 단독요법으로 4주 주기 중 처음 3주간 1일 160mg을 투여받았고, 253명의 환자(중앙연령 61세; 60% 남성)는 위약을 투여받았습니다. 스티바가 투여 환자의 중앙 투여기간은 1.7개월(범위 2일~10.8개월)이었습니다. 이상반응으로 인해 스티바가 투여 환자의 61%가 투여 중단이 필요했고, 38%의 환자에서 용량이 감소되었습니다. 이상반응으로 치료 중단된 사례는 스티바가 투여 환자군 8.2%, 위약 투여 환자군 1.2%에서 발생했습니다. 손발구진성발진과 발진이 스티바가의 영구 중단 가장 흔한 원인이었습니다.
표 1은 CORRECT 임상에서 10% 이상의 환자에서 발생한 이상반응의 발생률을 나타냅니다.
|
이상반응 |
스티바가 (N=500) |
위약 (N=253) |
||
|---|---|---|---|---|
| 등급 | 등급 | |||
| 전체 % |
≥ 3 % |
전체 % |
≥ 3 % |
|
|
전신 및 투여부위 이상 권태감/피로 통증 발열 |
64 59 28 |
15 9 2 |
46 48 15 |
9 7 0 |
|
대사 및 영양 이상 식욕감소 및 식욕부진 |
47 |
5 |
28 |
4 |
|
피부 및 피하조직 이상 손발구진성발진 발진 b |
45 26 |
17 6 |
7 4 |
0 <1 |
|
위장관 이상 설사 점막염 |
43 33 |
8 4 |
17 5 |
2 0 |
|
검사 수치 이상 체중 감소 |
32 |
<1 |
10 |
0 |
|
감염 및 기생충 질환 감염 c |
31 |
9 |
17 |
6 |
|
혈관 질환 고혈압 출혈 c |
30 21 |
8 2 |
8 8 |
<1 <1 |
|
호흡기, 흉부 및 종격 질환 발성장애 |
30 |
0 |
6 |
0 |
|
신경계 질환 두통 |
10 |
<1 |
7 |
0 |
- a 부작용은 National Cancer Institute Common Toxicity for Adverse Events 버전 3.0(NCI CTCAE v3.0)에 따라 등급화되었습니다.
- b‘발진’은 약물발진, 발진, 홍반성 발진, 전신 발진, 반구진성 발진, 구진성 발진, 소양성 발진 등의 용어를 포함합니다.
c치명적인 결과가 관찰되었습니다.
표 2는 CORRECT 연구에서 관찰된 실험실 검사치 이상을 제공합니다.
| 실험실 검사항목 | 스티바가 (N=500 a) |
위약 (N=253 a) |
||||
|---|---|---|---|---|---|---|
| 등급 b | 등급 b | |||||
| 전체 % |
3등급 % |
4등급 % |
전체 % |
3등급 % |
4등급 % |
|
|
혈액 및 림프계 질환 |
||||||
|
빈혈 |
79 |
5 |
1 |
66 |
3 |
0 |
|
혈소판감소증 |
41 |
2 |
<1 |
17 |
<1 |
0 |
|
호중구감소증 |
3 |
1 |
0 |
0 |
0 |
0 |
|
54 |
9 |
0 |
35 |
4 |
<1 |
|
대사 및 영양 장애 |
||||||
|
저칼슘혈증 |
59 |
1 |
<1 |
18 |
1 |
0 |
|
저칼륨혈증 |
26 |
4 |
0 |
8 |
<1 |
0 |
|
저나트륨혈증 |
30 |
7 |
1 |
22 |
4 |
0 |
|
저인산혈증 |
57 |
31 |
1 |
11 |
4 |
0 |
|
간담도 장애 |
||||||
|
고빌리루빈혈증 |
45 |
10 |
3 |
17 |
5 |
3 |
|
AST 증가 |
65 |
5 |
1 |
46 |
4 |
1 |
|
ALT 증가 |
45 |
5 |
1 |
30 |
3 |
<1 |
|
신장 및 비뇨기계 장애 |
||||||
|
단백뇨c |
84 |
2 |
0 |
61 |
1 |
0 |
|
검사 결과 이상 |
||||||
|
INR 증가d |
24 |
4 |
N/A |
17 |
2 |
N/A |
|
리파제 증가 |
46 |
9 |
2 |
19 |
3 |
2 |
|
아밀라제 증가 |
26 |
2 |
<1 |
17 |
2 |
<1 |
a 기준은 기저치 이후 표본 수로, 500 (레고라페닙) 또는 253 (위약)보다 적을 수 있습니다.
b NCI CTCAE v3.0
c요단백-크레아티닌 비율 데이터를 기반으로 합니다.
d국제 표준화 비율: NCI CTCAE v3.0에 4등급이 없습니다.
위장관기질종양
아래 설명된 안전성 데이터는 이전에 치료받은 GIST 환자 132명 (중위 연령 60세, 64%가 남성)이 레고라페닙을 160mg/일로 4주 주기 중 3주차까지 단독요법으로 투여받은 무작위배정 (2:1), 이중맹검, 위약대조 시험 (GRID)에서 도출되었고, 66명 (중위 연령 61세, 64%가 남성)이 위약을 투여받았습니다. 레고라페닙 투여군의 중위 치료 기간은 5.7개월 (범위 1일~11.7개월)이었습니다. 레고라페닙 투여군의 58%에서 이상반응으로 투여 중단이 필요했고 50%의 환자에서 용량 감량이 있었습니다. 치료 중단으로 이어진 이상반응은 레고라페닙 투여군의 2.3%, 위약군의 1.5%에서 보고되었습니다.
표 3은 GRID 시험에서 레고라페닙 투여군 환자의 이상반응 (≥10%) 발생률을 제시하고 있습니다.
| 이상반응 | 레고라페닙 (N=132) |
위약 (N=66) |
||
|---|---|---|---|---|
| 등급 | 등급 | |||
| 전체 % |
≥ 3 % |
전체 % |
≥ 3 % |
|
|
피부 및 피하조직 장애 수족피부반응/PPE 발진 b 탈모 |
67 30 24 |
22 7 2 |
12 3 2 |
2 0 0 |
|
전신 장애 및 투여 부위 병태 무력증/피로 발열 |
52 21 |
4 0 |
39 11 |
2 2 |
|
혈관 장애 고혈압 출혈 |
59 11 |
28 4 |
27 3 |
5 0 |
|
위장관 장애 통증 설사 점막염 구역 구토 |
60 47 40 20 17 |
8 8 2 2 <1 |
55 9 8 12 8 6 이상반응 |
14 0 2 2 0 |
|
호흡기, 흉부 및 종격 장애 발성장애 |
39 |
0 |
9 |
0 |
|
감염 및 기생충 질환 감염 c |
32 |
5 |
5 |
0 |
|
대사 및 영양 장애 식욕 감퇴 및 섭식 감소 갑상선기능저하증 d |
31 18 |
<1 0 |
21 6 |
3 0 |
|
신경계 장애 두통 |
16 |
0 |
9 |
0 |
|
검사치 이상 체중감소 |
14 |
0 |
8 |
0 |
|
근골격계 및 결합조직 장애 근육경련 |
14 |
0 |
3 |
0 |
a NCI CTCAE v4.0에 따라 등급이 매겨진 이상반응.
- b발진이라는 용어는 발진, 홍반성 발진, 반점구진성 발진, 구진성 발진 및 소양성 발진 등의 이상반응 보고를 포함합니다.
- c치명적 결과가 관찰되었습니다.
d기저치에서 정상 TSH와 갑상선 보충제를 복용하지 않은 환자군에서 평가한 갑상선기능저하증 발생률입니다.
표 4는 GRID에서 관찰된 검사치 이상을 제공합니다.
| 검사치 매개변수 | STIVARGA (N=132a) |
위약 (N=66a) |
||||
|---|---|---|---|---|---|---|
| 등급 b | 등급 b | |||||
| 전체 % |
3 % |
4 % |
전체 % |
3 % |
4 % |
|
|
혈액 및 림프계 장애 혈소판감소증 호중구감소증 림프구감소증 |
13 16 30 |
1 2 8 |
0 1 0 |
2 12 24 |
0 3 3 |
2 0 0 |
|
대사 및 영양 장애 저칼슘혈증 저칼륨혈증 저인산혈증 |
17 21 55 |
2 3 20 |
0 0 2 |
5 3 3 |
0 0 2 |
0 0 0 |
|
간담도계 장애 과빌리루빈혈증 AST 증가 ALT 증가 |
33 58 39 |
3 3 4 |
1 1 1 |
12 47 39 |
2 3 2 |
0 0 0 |
|
신장 및 비뇨기계 장애 단백뇨 c |
59 |
3 |
– d |
53 |
3 |
– d |
|
검사치 이상 리파아제 증가 |
14 |
0 |
1 |
5 |
0 |
0 |
- a 기준은 기저치 이후 검체 수로 132명(레고라페닙) 또는 66명(위약)보다 적을 수 있음.
b NCI CTCAE v4.0.
c 요단백-크레아티닌비 데이터에 기준함.
d NCI CTCAE v4.0에는 4등급이 표기되지 않음.
간세포암
아래에 기술된 안전성 데이터는 2:1 무작위 배정, 이중 맹검, 위약 대조 임상시험 (RESORCE)에서 얻었다. 이전에 치료받은 간세포암 환자가 레고라페닙 160mg (n=374)을 매 4주 치료 주기 중 1-21일까지 경구 투여했거나, 위약 (n=193)을 투여받았다. 중앙 연령은 63세였고, 88%가 남성, 98%가 Child-Pugh A 간경화, 66%가 ECOG 활동능력 0, 34%가 1이었다. 레고라페닙 투여 중앙 기간은 3.5개월(범위 1일~29.4개월)이었다. 레고라페닙 투여군의 33%가 6개월 이상, 14%가 12개월 이상 레고라페닙에 노출되었다. 이상반응 때문에 58.3%에서 레고라페닙 투여 중단이, 48%에서 감량이 필요했다. 가장 흔한 투여 중단/감량 사유는 HFSR/PPES (20.6%), 빌리루빈 증가 (5.9%), 피로 (5.1%), 설사 (5.3%)였다. 이상반응으로 인한 투여 중단은 레고라페닙군에서 10.4%, 위약군에서 3.6%였으며, 레고라페닙 중단 가장 흔한 이상반응은 HFSR/PPES (1.9%), AST 증가 (1.6%)였다.
표 5는 RESORCE 환자의 10% 이상 발생 이상반응을 제시한다.
| 이상반응 | 레고라페닙 (N=374) |
위약 (N=193) |
||
|---|---|---|---|---|
| 등급 | 등급 | |||
| 전체 % |
≥ 3 % |
전체 % |
≥ 3 % |
|
|
피부 및 피하조직 장애 HFSR/PPE |
51 |
12 |
7 |
<1 |
|
전신 및 투여 부위 질환 통증 무력증/피로 발열 |
55 42 20 |
9 10 0 |
44 33 7 |
8 5 0 |
|
혈관 장애 고혈압 출혈 b |
31 18 |
15 5 |
6 16 |
5 8 |
|
위장관 장애 설사 구역 구토 점막염 |
41 17 13 13 |
3 <1 <1 1 |
15 13 7 2 |
0 0 <1 ≤1 |
|
호흡기, 흉곽 및 종격 장애 발음장애 |
18 |
0 |
2 |
0 |
|
감염 및 기생충 질환 감염b |
31 |
8 |
18 |
6 |
|
대사 및 영양 장애 식욕감소 및 섭취량 감소 |
31 |
3 |
15 |
2 |
|
검사치 이상 체중감소 |
13 |
2 |
4 |
0 |
|
근육경련 |
10 |
0 |
2 |
0 |
a NCI CTCAE v4.0에 따라 평가된 부작용.
- b치명적인 결과가 관찰되었습니다.
STIVARGA를 투여받은 환자의 10% 미만에서 관찰된 다른 임상적으로 유의한 부작용은 다음과 같습니다: 탈모증(7%), 갑상선기능저하증(6.4%), 췌장염(1.6%), 박리성피부염(1.3%), 진전(1.3%), 다형홍반(0.8%), 심근허혈(0.8%), 위장관누공(0.3%) 및 심근경색증(0.3%).
표 6은 RESORCE 연구에서 관찰된 검사실 이상치를 제공합니다.
| 검사실 매개변수 | STIVARGA (N=374a) |
위약 (N=193a) |
||||
|---|---|---|---|---|---|---|
| 등급b | 등급b | |||||
| 전체 % |
3 % |
4 % |
전체 % |
3 % |
4 % |
|
|
혈액 및 림프계 장애 혈소판감소증 호중구감소증 림프구감소증 |
63 14 68 |
5 3 16 |
<1 0 2 |
50 15 59 |
0 <1 11 |
0 <1 <1 |
|
대사 및 영양 장애 저칼슘혈증 저칼륨혈증 저인산혈증 |
23 31 70 |
<1 4 32 |
0 <1 2 |
10 9 31 |
0 2 7 |
0 0 0 |
|
간담도계 장애 고빌리루빈혈증 AST 증가 ALT 증가 |
78 93 70 |
13 16 6 | ||||
|
혈액 및 림프계 장애 빈혈 혈소판감소증 백혈구감소증 |
83 34 17 |
3 2 <1 |
55 84 59 |
11 17 5 |
5 3 0 |
|
|
신장 및 요로 장애 단백뇨 c |
51 |
17 |
– d |
37 |
3 |
– d |
|
검사치 이상 INR 증가 리파아제 증가 아밀라아제 증가 |
44 41 23 |
<1 11 3 |
– d 3 <1 |
35 27 19 |
2 8 2 |
– d 1 <1 |
- a 베이스라인 이후 검체 수에 근거한 백분율로 374명(레고라페닙) 또는 193명(위약) 미만일 수 있습니다.
b NCI CTCAE v4.0.
c 요단백 검사 결과에 근거합니다.
d NCI CTCAE v4.0에 4등급은 없습니다.
6.2 시판 후 경험
스티바가의 시판 후 사용에서 다음과 같은 이상반응이 확인되었습니다. 이러한 반응은 불특정 규모의 인구집단에서 자발적으로 보고되었기 때문에 항상 발생률을 신뢰성 있게 추정하거나 약물 노출과의 인과관계를 확립하는 것은 불가능합니다:
- •
- 과민반응
- •
- 신증후군
- •
- 심부전
- •
- 동맥류(대동맥 포함), 박리 및 파열
7 약물 상호작용
7.1 Regorafenib에 대한 강력한 CYP3A4 유도제의 영향
STIVARGA와 강력한 CYP3A4 유도제를 병용 투여하면 regorafenib의 혈장 농도가 감소하고, 활성 대사체 M-5의 혈장 농도는 증가하며, 활성 대사체 M-2의 혈장 농도는 변화가 없었습니다 [임상약리학 참조 (12.3)]. 이는 효능 감소로 이어질 수 있습니다. STIVARGA와 강력한 CYP3A4 유도제(예: rifampin, phenytoin, carbamazepine, phenobarbital, St. John’s Wort)의 병용 사용을 피하십시오.
7.2 Regorafenib에 대한 강력한 CYP3A4 억제제의 영향
STIVARGA와 강력한 CYP3A4 억제제를 병용 투여하면 regorafenib의 혈장 농도가 증가하고 활성 대사체 M-2와 M-5의 혈장 농도는 감소했습니다 [임상약리학 참조 (12.3)]. 이는 독성 증가로 이어질 수 있습니다. STIVARGA와 강력한 CYP3A4 억제제(예: clarithromycin, grapefruit juice, itraconazole, ketoconazole, nefazodone, posaconazole, telithromycin, voriconazole)의 병용 사용을 피하십시오.
7.3 Breast Cancer Resistance Protein (BCRP) 기질에 대한 Regorafenib의 영향
STIVARGA를 BCRP 기질과 병용 투여하면 BCRP 기질의 혈장 농도가 증가했습니다 [임상약리학 참조 (12.3)]. BCRP 기질(예: methotrexate, fluvastatin, atorvastatin)에 대한 노출 관련 독성의 징후 및 증상에 대해 환자를 면밀히 모니터링하십시오. STIVARGA와 함께 그러한 제품을 투여하는 것을 고려할 때 병용 BCRP 기질 제품 정보를 참조하십시오.
8 특정 집단에서의 사용
8.1 임신
위험 요약
동물 연구 및 작용 기전에 근거할 때, STIVARGA는 임신한 여성에게 투여 시 태아에게 위험을 초래할 수 있습니다. 임신한 여성에서 STIVARGA 사용에 대한 데이터는 없습니다. Regorafenib 투여는 권장용량에서의 인체 노출보다 낮은 노출에서 랫트와 토끼에게 배아 치사 및 기형유발을 나타냈으며, 심혈관, 비뇨생식기 및 골격 기형의 발생률이 증가했습니다[데이터 참조]. 임신한 여성에게 태아에 대한 잠재적 위험을 알려 주십시오.
해당 적응증 인구집단에서 주요 선천성 결함 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인지된 임신에서 주요 선천성 결함 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
데이터
동물 데이터
배아-태아 발달 연구에서, 랫트의 경우 1 mg/kg 용량(체표면적 기준 권장 인체 용량의 약 6%), 토끼의 경우 1.6 mg/kg 용량(AUC 기준 임상 권장용량에서의 인체 노출의 약 25%)에서 임신 완전 소실(litter의 100% 흡수)이 관찰되었습니다.
임신한 랫트에서의 단회 투여 분포 연구에서, 태아에서 모체에 비해 regorafenib의 혈액-뇌 장벽 통과가 증가했습니다. 기관형성기 동안 임신한 랫트에게 regorafenib을 매일 투여한 결과, 0.8 mg/kg 용량(체표면적 기준 권장 인체 용량의 약 5%) 이상에서 골화 지연의 태아 소견과 1 mg/kg 용량(AUC 기준 임상 노출의 약 10%) 이상에서 구개열 및 대천문 확장을 포함한 골격 기형의 용량 의존적 증가가 나타났습니다. 1.6 mg/kg 용량(체표면적 기준 권장 인체 용량의 약 11%) 이상에서는 심혈관 기형, 외부 이상, 횡격막 탈장 및 신우 확장의 발생률이 용량 의존적으로 증가했습니다.
기관형성기 동안 regorafenib을 매일 투여받은 임신한 토끼에서, 0.4 mg/kg의 최저 시험 용량(권장용량에서 환자의 AUC의 약 7%)에서 심실중격결손이 명백하게 나타났습니다. 0.8 mg/kg 용량(AUC 기준 권장 인체 용량에서의 인체 노출의 약 15%) 이상에서 regorafenib 투여는 추가적인 심혈관 기형 및 골격 이상의 발생률이 용량 의존적으로 증가했으며, 신장/요관 결여, 작고 변형되고 위치가 잘못된 신장, 수신증을 포함한 요로계에 유의한 부작용을 초래했습니다. 두 건의 토끼 배아-태아 독성 연구에서 용량 증가에 따라 수컷인 생존 태아의 비율이 감소했습니다.
8.2 수유
위험 요약
Regorafenib 또는 그 대사체가 모유에 존재하는지, regorafenib이 수유 중인 영아에 미치는 영향 또는 모유 생성에 미치는 영향에 대한 데이터는 없습니다. 랫트에서 regorafenib 및 그 대사체는 모유로 배설됩니다. STIVARGA로 인해 모유 수유 중인 영아에게 심각한 이상반응이 발생할 가능성이 있으므로 STIVARGA 치료 중 및 최종 투여 후 2주 동안 모유 수유를 하지 마십시오.
8.3 가임기 여성 및 남성
피임
여성
치료 기간 및 치료 종료 후 2개월 동안 효과적인 피임법을 사용하십시오.
남성
가임기 여성 파트너가 있는 남성 환자에게 치료 기간 및 STIVARGA 최종 투여 후 2개월 동안 효과적인 피임법을 사용하도록 권고하십시오[비임상 독성학 (13.1) 참조].
생식력 장애
STIVARGA가 사람의 생식력에 미치는 영향에 대한 데이터는 없습니다. 동물 연구 결과는 regorafenib이 수컷 및 암컷의 생식력을 손상시킬 수 있음을 나타냅니다[비임상 독성학 (13.1) 참조].
8.4 소아 사용
18세 미만 소아 환자에서 STIVARGA의 안전성 및 유효성은 확립되지 않았습니다.
동물 데이터
랫트에서의 28일 반복 투여 연구에서 상아질 변화 및 angiectasis의 용량 의존적 소견이 있었습니다. 이러한 소견은 4 mg/kg의 regorafenib 용량(권장 용량에서 사람의 AUC의 약 25%)에서도 발생했습니다. 개에서의 13주 반복 투여 연구에서 20 mg/kg의 저용량(권장 용량에서 사람의 AUC의 약 43%)에서 유사한 상아질 변화 소견이 나타났습니다. 이러한 동물에서 regorafenib 투여는 또한 대퇴 골단 성장판의 지속적인 성장 및 비후로 이어졌습니다.
8.5 노인에서의 사용
무작위 위약 대조 시험에 등록된 STIVARGA 투여 환자 1142명 중 40%가 65세 이상이었고 10%는 75세 이상이었습니다. 이들 환자와 젊은 환자 사이에 전반적인 유효성 차이는 관찰되지 않았습니다. 위약 대조 시험에서 젊은 환자에 비해 65세 이상 STIVARGA 투여 환자에서 3등급 고혈압(18% 대 9%) 발생률이 증가했습니다. 또한 65세 이상 연령군에서 4등급 고혈압 1건이 보고되었고 젊은 연령군에서는 없었습니다.
8.6 간장애
경증(총 빌리루빈 ≤ULN 및 AST >ULN 또는 총 빌리루빈 >ULN~≤1.5 x ULN) 또는 중등도(총 빌리루빈 >1.5~≤3 x ULN 및 모든 AST 수치) 간장애 환자에서 용량 조절은 필요하지 않습니다[임상 약리학 (12.3) 참조]. 간장애 환자에서 이상반응을 면밀히 모니터링하십시오[경고 및 주의사항 (5.1) 참조].
STIVARGA는 이 집단에서 연구되지 않았으므로 중증 간장애 환자(총 빌리루빈 >3 x ULN)에서의 사용은 권장되지 않습니다.
8.7 신장애
신장애 환자에서 용량 조절은 권장되지 않습니다. 투석을 받는 환자에서 regorafenib의 약동학은 연구되지 않았으며 이 환자 집단에 대한 권장 용량은 없습니다[임상 약리학 (12.3) 참조].
8.8 인종
3건의 위약 대조 시험(CORRECT, GRID 및 CONCUR)의 통합 데이터에 근거할 때, 백인과 비교하여 STIVARGA로 치료받은 아시아인 환자에서 HFSR 및 간기능 검사 이상 발생률이 더 높았습니다[경고 및 주의사항 (5.1, 5.5) 참조]. 인종에 근거한 시작 용량 조절은 필요하지 않습니다.
10 과량투여
STIVARGA의 임상적으로 연구된 최고 용량은 1일 220 mg입니다. 이 용량에서 가장 빈번하게 관찰된 약물 이상반응은 피부 이상, 발성장애, 설사, 점막 염증, 구강 건조, 식욕 감소, 고혈압, 피로였습니다. STIVARGA 과량투여에 대한 알려진 해독제는 없습니다. 과량투여가 의심되는 경우 STIVARGA 투여를 중단하고 지지요법을 실시하며 임상적으로 안정될 때까지 관찰합니다.
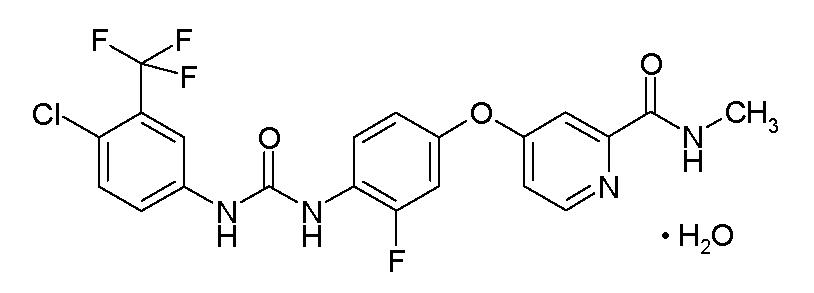
11 제품 설명
STIVARGA (regorafenib)는 화학명 4-[4-({[4-chloro-3-(trifluoromethyl) phenyl] carbamoyl} amino)-3-fluorophenoxy]-N-methylpyridine-2-carboxamide monohydrate인 multikinase inhibitor입니다. Regorafenib는 다음과 같은 구조식을 가지고 있습니다:
Regorafenib는 monohydrate이며 분자식 C21H15ClF4N4O3 • H2O와 분자량 500.83을 가집니다. Regorafenib는 물에 거의 녹지 않고, acetonitrile, methanol, ethanol, ethyl acetate에는 약간 녹으며, acetone에는 부분적으로 녹습니다.
경구 투여용 STIVARGA 정제는 “BAYER”가 한쪽 면에, “40”이 다른 면에 음각된 연한 분홍색의 타원형 정제로 제조됩니다. 각 정제는 무수 상태로 40mg의 regorafenib를 함유하며, 이는 regorafenib monohydrate 41.49mg에 해당합니다. 그리고 다음과 같은 비활성 성분들을 포함합니다: cellulose microcrystalline, croscarmellose sodium, magnesium stearate, povidone, colloidal silicon dioxide. 필름 코팅제는 다음과 같은 비활성 성분들을 포함합니다: ferric oxide red, ferric oxide yellow, lecithin (soy), polyethylene glycol 3350, polyvinyl alcohol, talc, titanium dioxide.
12 임상 약리학
12.1 작용 기전
Regorafenib은 종양 발생, 종양 혈관 신생, 전이 및 종양 면역과 같은 병리적 과정과 정상 세포 기능에 관여하는 다중 막결합 및 세포내 kinase의 저해제이다. In vitro 생화학적 또는 세포 분석에서, regorafenib 또는 그 주요 인체 활성 대사체 M-2 및 M-5는 임상적으로 도달한 농도에서 RET, VEGFR1, VEGFR2, VEGFR3, KIT, PDGFR-alpha, PDGFR-beta, FGFR1, FGFR2, TIE2, DDR2, TrkA, Eph2A, RAF-1, BRAF, BRAF V600E, SAPK2, PTK5, Abl 및 CSF1R의 활성을 억제했다. In vivo 모델에서, regorafenib은 쥐 종양 모델에서 항혈관 신생 활성을 보였고, 일부 인간 결장직장 암종, 위장관 기질종양 및 간세포암종을 포함한 몇몇 인간 이종 이식 모델에서 종양 성장 억제를 나타냈다. Regorafenib은 또한 마우스 이종 이식 모델과 두 개의 인간 결장직장 암종 마우스 orthotopic 모델에서 항전이 활성을 보였다.
12.2 약력학
심장 전기생리학
진행성 고형암 환자 25명을 대상으로 한 open-label, 단일군 연구에서 STIVARGA의 다회 투여(21일 동안 1일 1회 160 mg)가 QTc 간격에 미치는 영향을 평가했다. 이 연구에서 평균 QTc 간격의 큰 변화(즉, > 20 msec)는 감지되지 않았다.
12.3 약동학
흡수
진행성 고형암 환자에서 STIVARGA 160 mg 단회 투여 후, regorafenib은 중앙값 4시간에 기하 평균 최고 혈장 농도(Cmax) 2.5 µg/mL 및 기하 평균 혈장 농도-시간 곡선 하 면적(AUC) 70.4 µg*h/mL에 도달했다. 정상 상태에서 regorafenib의 AUC는 60 mg 초과 용량에서 용량 비례적으로 증가하지 않았다. 정상 상태에서 regorafenib은 기하 평균 Cmax 3.9 µg/mL 및 기하 평균 AUC 58.3 µg*h/mL에 도달했다. AUC 및 Cmax의 변동 계수는 35%와 44% 사이이다.
정제의 경구 용액과 비교한 평균 상대 생체이용률은 69% ~ 83%이다.
식이 영향 연구에서, 건강한 남성 24명이 3회에 걸쳐 STIVARGA 160 mg 단회 용량을 공복 상태, 고지방 식사와 함께, 저지방 식사와 함께 투여받았다. 고지방 식사(945 kcal 및 54.6 g 지방)는 공복 상태와 비교하여 regorafenib의 평균 AUC를 48% 증가시키고 M-2 및 M-5 대사체의 평균 AUC를 각각 20% 및 51% 감소시켰다. 저지방 식사(319 kcal 및 8.2 g 지방)는 공복 조건과 비교하여 regorafenib, M-2 및 M-5의 평균 AUC를 각각 36%, 40% 및 23% 증가시켰다. CORRECT 및 GRID 연구에서 STIVARGA는 저지방 식사와 함께 투여되었다[용법용량 (2.1), 임상 연구 (14) 참조].
분포
Regorafenib은 장간 순환을 거치며 24시간 투여 간격 동안 다중 혈장 농도 피크가 관찰된다. Regorafenib은 인체 혈장 단백질에 99.5% 높게 결합한다.
소실
STIVARGA 160 mg 단회 경구 투여 후, regorafenib 및 M-2 대사체의 혈장 내 기하 평균(최소-최대) 소실 반감기는 각각 28시간(14~58시간) 및 25시간(14~32시간)이었다. M-5는 더 긴 평균(최소-최대) 소실 반감기 51시간(32~70시간)을 나타냈다.
대사
Regorafenib은 CYP3A4 및 UGT1A9에 의해 대사된다. 인체 혈장에서 측정된 주요 순환 대사체는 정상 상태에서 regorafenib과 유사한 in vitro 약리학적 활성 및 정상 상태 농도를 갖는 M-2(N-산화물) 및 M-5(N-산화물 및 N-탈메틸)이다. M-2 및 M-5는 각각 99.8% 및 99.95% 높게 단백질 결합한다.
배설
120 mg 용량의 방사성 표지 경구 용액 투여 후 12일 이내에 방사성 표지 용량의 약 71%가 대변으로 배설되었고(47%는 모약물, 24%는 대사체) 용량의 19%가 소변으로 배설되었다(17%는 글루쿠론산으로).
특정 집단
연령, 성별, 인종 및 체중은 regorafenib의 약동학에 임상적으로 의미 있는 영향을 미치지 않았다.
간장애
집단 약동학 분석에 따르면, 정상 간 기능(총 빌리루빈 및 AST ≤ ULN, n=744), 경증 간장애(총 빌리루빈 ≤ ULN 및 AST >ULN 또는 총 빌리루빈 >ULN ~ ≤1.5x ULN, n=437), 중등도 간장애(총 빌리루빈 >1.5x ~ ≤3x ULN 및 모든 AST, n=36) 환자 간에 regorafenib, M-2 및 M-5의 평균 총 노출에 임상적으로 중요한 차이는 없었다. 통합 분석에는 HCC 환자 391명이 포함되었으며, 이 중 116명, 249명, 26명이 각각 정상 간 기능, 경증 및 중등도 간장애로 분류되었다. 중증 간장애 환자(총 빌리루빈 >3x ULN)에서 regorafenib의 약동학은 평가되지 않았다.
신장애
STIVARGA를 1일 160 mg 용량으로 21일 동안 투여한 후 중증 신장애 환자(CLcr 15-29 mL/min) 6명과 정상/경증 신기능 환자(CLcr ≥60 mL/min) 18명에서 regorafenib, M-2 및 M-5의 약동학을 평가했다. 정상 신기능 환자와 비교하여 중증 신장애 환자에서 regorafenib, M-2 또는 M-5의 평균 정상 상태 노출에 차이가 관찰되지 않았다. 투석 중인 말기 신장 질환 환자에서 regorafenib의 약동학은 연구되지 않았다.
약물 상호작용 연구
Cytochrome P450 기질에 대한 Regorafenib의 영향: In vitro 연구는 regorafenib이 CYP2C8, CYP2C9, CYP2B6, CYP3A4 및 CYP2C19의 억제제이고, M-2는 CYP2C9, CYP2C8, CYP3A4 및 CYP2D6의 억제제이며, M-5는 CYP2C8의 억제제임을 시사했다. In vitro 연구는 regorafenib이 CYP1A2, CYP2B6, CYP2C19 및 CYP3A4 효소 활성의 유도제가 아님을 시사했다.
진행성 고형암 환자는 STIVARGA 160 mg을 1일 1회 투여하기 1주 전과 2주 후에 CYP 기질인 midazolam 2 mg (CYP3A4), omeprazole 40 mg (CYP2C19), warfarin 10 mg (CYP2C9) 또는 rosiglitazone 4 mg (CYP2C8)의 단회 경구 용량을 투여받았다. Rosiglitazone (N=12)의 평균 AUC 또는 투여 6시간 후 측정한 omeprazole (N=11)의 평균 혈장 농도 또는 midazolam (N=15)의 평균 AUC에서 임상적으로 의미 있는 영향은 관찰되지 않았다. Warfarin (N=8)의 평균 AUC는 25% 증가했다[경고 및 주의사항 (5.2) 참조].
CYP3A4 강력한 유도제가 Regorafenib에 미치는 영향: 22명의 건강한 남성이 STIVARGA 160mg 단회 용량을 단독으로 투여받은 후 7일 후에 rifampin 투여를 시작했습니다. 강력한 CYP3A4 유도제인 Rifampin은 9일 동안 하루 600mg 용량으로 투여되었습니다. Regorafenib의 평균 AUC는 50% 감소했고 M-5의 평균 AUC는 264% 증가했습니다. M-2의 평균 AUC에는 변화가 없었습니다 [Drug Interactions (7.1) 참조].
CYP3A4 강력한 억제제가 Regorafenib에 미치는 영향: 18명의 건강한 남성이 STIVARGA 160mg 단회 용량을 단독으로 투여받은 후 5일 후에 ketoconazole 투여를 시작했습니다. 강력한 CYP3A4 억제제인 Ketoconazole은 18일 동안 하루 400mg 용량으로 투여되었습니다. Regorafenib의 평균 AUC는 33% 증가했고 M-2와 M-5의 평균 AUC는 둘 다 93% 감소했습니다 [Drug Interactions (7.2) 참조].
Neomycin이 Regorafenib에 미치는 영향: 27명의 건강한 남성이 STIVARGA 160mg 단회 용량을 투여받은 후 5일 후에 neomycin 투여를 시작했습니다. 비흡수성 항생제인 Neomycin은 5일 동안 하루 3회 1g 용량으로 투여되었습니다. Regorafenib의 평균 AUC에 임상적으로 유의미한 영향은 관찰되지 않았습니다. 그러나 M-2의 평균 AUC는 76% 감소했고 M-5의 평균 AUC는 86% 감소했습니다. M-2와 M-5의 노출 감소는 STIVARGA의 효능 감소로 이어질 수 있습니다. 다른 항생제가 regorafenib과 그 활성 대사체의 노출에 미치는 영향은 연구되지 않았습니다.
Regorafenib이 UGT1A1 기질에 미치는 영향: 시험관 내 연구에서 regorafenib, M-2, M-5가 치료 관련 농도에서 UGT1A9과 UGT1A1을 경쟁적으로 억제하는 것으로 나타났습니다. 11명의 환자가 STIVARGA 160mg을 7일 동안 매일 투여한 후 5일째 되는 날 irinotecan 병용 항암요법을 투여받았습니다. Irinotecan의 평균 AUC는 28% 증가했고 SN-38의 평균 AUC는 44% 증가했습니다.
Regorafenib이 BCRP 기질에 미치는 영향: BCRP 기질인 rosuvastatin 단회 용량(5mg) 투여 전 regorafenib(14일간 160mg)를 투여한 결과, rosuvastatin의 평균 노출(AUC)이 3.8배 증가하고 Cmax가 4.6배 증가했습니다 [Drug Interactions (7.3) 참조].
13 비임상 독성학
13.1 발암성, 변이원성, 생식능력 장애
Regorafenib의 발암 가능성을 조사하는 연구는 수행되지 않았습니다. Regorafenib 자체는 in vitro 또는 in vivo 분석에서 유전독성을 나타내지 않았습니다. 그러나 regorafenib의 주요 인체 활성 대사체인 (M-2)는 Chinese hamster V79 세포에서 염색체 이상을 유발하여 clastogenicity에 양성을 나타냈습니다.
Regorafenib가 생식능력에 미치는 영향을 조사하기 위한 전용 연구는 수행되지 않았습니다. 그러나 AUC를 기준으로 임상 권장 용량에서 사람에서의 용량과 유사한 용량에서 수컷 쥐에서 고환의 tubular atrophy 및 degeneration, 정낭의 위축, 부고환의 cellular debris 및 oligospermia가 조직학적으로 관찰되었습니다. 암컷 쥐에서는 동일한 노출에서 난소의 necrotic corpora lutea 소견이 증가했습니다. AUC를 기준으로 권장 인체 용량의 약 83%의 노출에서 반복 투여 연구에서 수컷과 암컷 개에서 유사한 소견이 있었습니다. 이러한 소견은 regorafenib가 사람의 생식능력에 부정적인 영향을 미칠 수 있음을 시사합니다.
13.2 동물 독성학 및/또는 약리학
쥐에 대한 26주 만성 반복 투여 연구에서 방실판막 비후 소견이 용량 의존적으로 증가했습니다. 권장 용량에서 인체 노출의 약 12%의 노출을 초래한 용량에서 이 소견은 조사된 동물의 절반에서 존재했습니다.
제14장 임상 연구
14.1 대장암
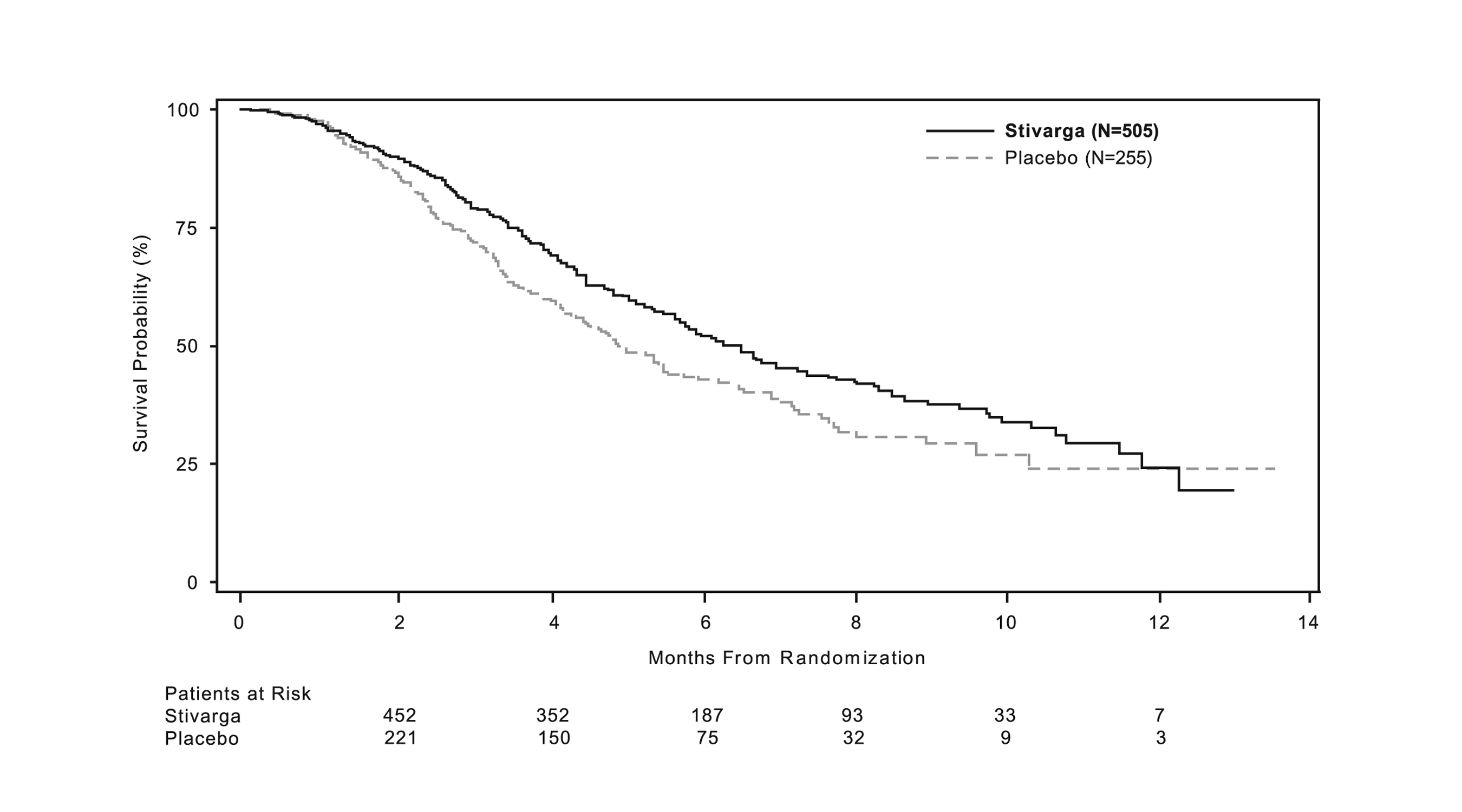
STIVARGA의 임상 유효성 및 안전성은 이전에 치료받은 전이성 대장암 환자 760명을 대상으로 한 국제 다기관 무작위 배정(2:1), 이중 맹검, 위약 대조 시험[“표준 요법 실패 후 REgorafenib 또는 plaCebo로 치료받은 전이성 COloRectal 암 환자”(CORRECT) 연구; NCT 01103323)]에서 평가되었습니다. 주요 유효성 평가변수는 전체 생존기간(OS)이었으며, 추가 유효성 평가변수로는 무진행 생존기간(PFS) 및 전체 종양 반응률이 있었습니다.
환자들은 160mg 레고라페닙 경구 1일 1회 투여(N=505) 및 최선의 보조치료(BSC) 또는 위약(N=255) 및 BSC를 28일 주기 중 첫 21일간 투여하도록 무작위 배정되었습니다. STIVARGA는 30% 미만의 지방을 함유한 저지방 식사와 함께 투여되었습니다[용법 및 용량(2.1) 및 임상 약리학(12.3) 참조]. 치료는 질병 진행 또는 허용할 수 없는 독성이 발생할 때까지 지속되었습니다.
기저 인구통계학적 특성: 중간 연령 61세, 61% 남성, 78% 백인, 모든 환자의 ECOG 활동능력 등급은 0 또는 1이었습니다. 주요 질환 부위는 대장(65%), 직장(29%), 또는 대장 및 직장 모두(6%)였습니다. KRAS 평가 병력은 729명(96%)의 환자에서 보고되었으며, 이들 중 430명(59%)이 KRAS 변이 보유로 보고되었습니다. 전이성 질환에 대한 이전 치료 경로의 중간값은 3회였습니다. 모든 환자는 fluoropyrimidine-, oxaliplatin-, irinotecan-기반 화학요법 및 bevacizumab 전치료를 받았습니다. KRAS 변이 음성 종양을 가진 환자 1명을 제외하고 모든 환자가 panitumumab 또는 cetuximab를 투여받았습니다.
STIVARGA 추가 치료는 BSC에 비해 통계적으로 유의한 생존기간 개선을 나타냈습니다(표 7 및 그림 1 참조).
|
STIVARGA (N=505) |
Placebo (N=255) |
|
|
전체 생존기간 |
||
|
사망 환자수 (%) |
275 (55%) |
157 (62%) |
|
6.4 |
5.0 |
|
(5.8, 7.3) |
(4.4, 5.8) |
|
0.77 (0.64, 0.94) |
|
|
0.0102 |
|
|
무진행 생존기간 |
||
|
사망 또는 진행 환자수 (%) |
417 (83%) |
231 (91%) |
|
2.0 |
1.7 |
|
(1.9, 2.3) |
(1.7, 1.8) |
|
0.49 (0.42, 0.58) |
|
|
<0.0001 |
|
|
전체 반응률 |
||
|
5 (1%) |
1 (0.4%) |
|
0.3%, 2.3% |
0%, 2.2% |
- a CI=신뢰구간.
- b지역 및 전이성 질환 진단 시기를 층화기준으로 함.
- c 2차 중간 분석에서 O’Brien-Fleming 경계값(양측 p-값 < 0.018)을 넘었음.
14.2 위장관 기질 종양
STIVARGA의 효능과 안전성은 이전에 이매티닙 메실레이트와 수니티닙 말레이트를 투여 받은 절제 불가능한 국소 진행성 또는 전이성 위장관 기질 종양(GIST) 환자를 대상으로 한 국제적, 다기관, 무작위 배정(2:1), 이중 눈가림, 위약 대조 시험[“GIST Regorafenib In progressive Disease”(GRID) 연구; NCT 01271712]에서 평가되었습니다. 무작위 배정은 치료 라인(3차 치료 vs. 4차 이상 치료)과 지리적 지역(아시아 vs. 그 외 지역)에 따라 층화되었습니다.
GRID의 주요 유효성 평가 변수는 독립적인 방사선학적 검토에 의해 mRECIST 1.1 기준을 사용하여 평가한 질병 진행 여부에 기반한 무진행 생존기간(PFS)이었습니다. 이때, 림프절과 골 병변은 표적 병변이 아니며 기존 종양 덩어리 내에 새로운 종양 결절이 지속적으로 자라는 경우는 진행으로 간주되었습니다. 주요 이차 평가변수는 전체 생존기간이었습니다.
환자들은 최선의 지지 요법(BSC)과 함께 1일 1회 160mg regorafenib 경구 투여군(N=133) 또는 위약(N=66)군으로 무작위 배정되었습니다. 치료는 질병 진행 또는 수용할 수 없는 독성이 발현될 때까지 매 28일 주기의 첫 21일 동안 지속되었습니다. GRID에서 환자들의 중앙 연령은 60세였으며, 64%가 남성, 68%가 백인, 모든 환자가 기저 ECOG 활동능력 평가 점수 0(55%) 또는 1(45%)이었습니다. 중앙 검토에 의해 질병 진행으로 평가되었을 때, 눈가림이 해제되었고 모든 환자에게 연구자의 재량에 따라 STIVARGA 복용 기회가 제공되었습니다.
STIVARGA 치료군에서 위약군에 비해 통계적으로 유의한 PFS 개선이 입증되었습니다(표 8 및 그림 2 참조).
최종 OS 분석(162개 OS 사례)에서는 전체 생존기간에 있어 통계적으로 유의한 차이가 없었습니다(표 8). 질병 진행 후 위약 치료군의 58명(88%)이 공개 라벨 STIVARGA로 교차되었습니다.
|
STIVARGA (N=133) |
위약 (N=66) |
|
|
무진행 생존기간 |
||
|
사망 또는 진행 건수(%) |
82 (62%) |
63 (96%) |
|
중앙 PFS 개월 (95% CI) |
4.8 (3.9, 5.7) |
0.9 (0.9, 1.1) |
|
위험비 (95% CI) |
0.27 (0.19, 0.39) |
|
|
p-값a |
<0.0001 |
|
|
전체 생존기간 |
||
|
사망 건수(%) |
109 (82%) |
53 (80.3%) |
|
중앙 OS 개월 (95% CI) |
17.4 (14.9, 20.2) |
17.4 (12.3, 21.0) |
|
위험비 (95% CI) |
0.91 (0.65, 1.27) |
|
|
p-값a |
0.5716 |
|
a 치료 라인 및 지리적 지역에 따라 계층화된 로그순위 검정의 양측 p-값
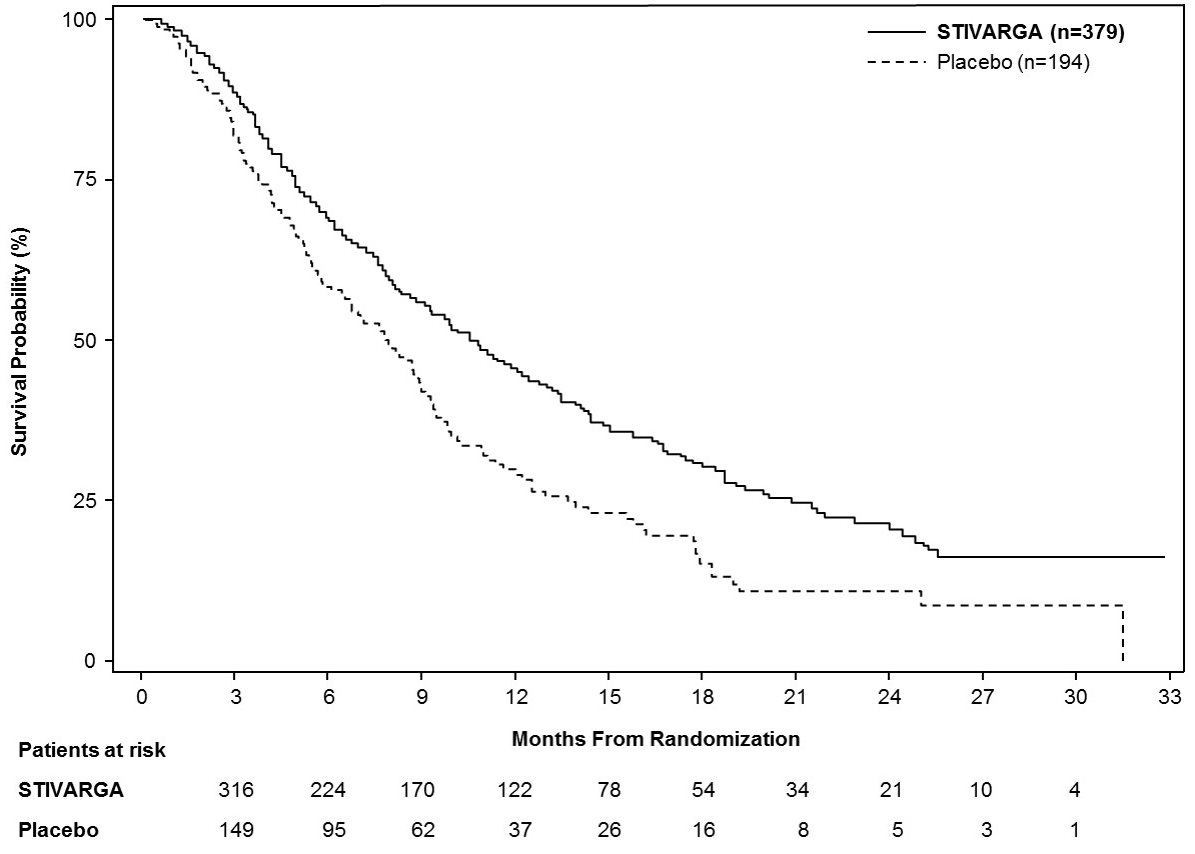
14.3 간세포암종(HCC)
STIVARGA의 임상 효능 및 안전성은 국제적, 다기관, 무작위 배정(2:1), 이중 눈가림, 위약 대조 연구[“REgorafenib after SORafenib in patients with hepatoCEllular carcinoma”(RESORCE) 연구; NCT 01774344]에서 평가되었습니다. 이 연구는 sorafenib 치료 후 질병 진행이 확인된 Child-Pugh A와 Barcelona Clinic Liver Cancer Stage Category B 또는 C의 간세포암종 성인 환자를 대상으로 하였습니다. 이전 sorafenib 치료 기간의 중앙값은 7.8개월이었으며, 독성으로 인해 sorafenib를 영구적으로 중단하거나 400mg 1일 1회 용량을 투여할 수 없었던 환자는 제외되었습니다.
환자들은 1일 1회 160mg regorafenib 경구 투여군 또는 위약 투여군으로 무작위 배정되었고, 양 군 모두 최선의 지지 요법(BSC)이 병용되었습니다. 치료는 질병 진행 또는 수용할 수 없는 독성이 발현될 때까지 매 28일 주기의 첫 21일 동안 지속되었습니다. 무작위 배정은 지리적 지역(아시아 vs. 그 외 지역), ECOG 활동능력 평가 점수(0 vs. 1), 알파태아단백 수치(<400 ng/mL vs. ≥400 ng/mL), 간외 병변 여부(존재 vs. 없음), 그리고 대혈관 침범 여부(존재 vs. 없음)에 따라 계층화되었습니다. 주요 유효성 평가변수는 전체 생존기간(OS)이었습니다. 추가적인 평가변수로는 연구자가 RECIST 1.1 및 HCC용 mRECIST를 사용하여 평가한 무진행 생존기간(PFS), 전체 종양 반응률(ORR) 및 반응 지속기간이 있었습니다. 환자들은 임상적 또는 방사선학적으로 질병 진행이 확인되거나 수용할 수 없는 독성이 발현될 때까지 STIVARGA 치료를 지속하였습니다.
연구 대상 환자군의 특징은 다음과 같았습니다: 중앙 연령 63세(범위 19-85세), 88%가 남성, 41%가 아시아인, 36%가 백인, 21%는 보고되지 않음, 66%가 ECOG 활동능력 0등급, 34%가 ECOG 활동능력 1등급, 98%가 Child-Pugh 등급 A, 2%가 Child-Pugh 등급 B였습니다. 기저 간경화의 위험요인으로는 B형 간염 바이러스 감염(38%), 알코올 섭취(25%), C형 간염 바이러스 감염(21%), 비알코올성 지방간염(7%) 등이 있었습니다. 81%의 환자에서 육안적 혈관 침윤 또는 간 외 종양 전이가 있었습니다. Barcelona Clinic Liver Cancer(BCLC) 등급은 87%의 환자에서 C기, 13%의 환자에서 B기였습니다. 모든 환자들이 이전에 소라페닙 치료를 받았고, 61%가 이전에 국소 경동맥 색전술 또는 화학에멀젼 시술을 받았습니다.
유효성 결과는 아래 표 9와 그림 3에 요약되어 있습니다.
|
|
STIVARGA n=379 |
위약 n=194 |
|
전체 생존기간 |
||
|
사망 수(%) |
233 (62) |
140 (72) |
|
중앙 전체 생존기간, 개월(95% 신뢰구간a) |
10.6 (9.1, 12.1) |
7.8 (6.3, 8.8) |
|
위험비b (95% 신뢰구간a) |
0.63 (0.50, 0.79) |
|
|
P-값c |
<0.0001 |
|
|
무진행 생존기간 (mRECIST) |
||
|
이벤트 수(%) |
293 (77) |
181(93) |
|
진행성 질병 |
274 (72) |
173 (89) |
|
사망 |
19 (5) |
8 (4) |
|
중앙 무진행 생존기간, 개월(95% 신뢰구간a) |
3.1 (2.8, 4.2) |
1.5 (1.4, 1.6) |
|
위험비b (95% 신뢰구간a) |
0.46 (0.37, 0.56) |
|
|
P-값c |
<0.0001 |
|
|
무진행 생존기간 (RECIST 1.1) |
||
|
이벤트 수(%) |
288 (76) |
184 (95) |
|
진행성 질병 |
270 (71) |
175 (90) |
|
사망 |
18 (5) |
9 (5) |
|
중앙 무진행 생존기간, 개월(95% 신뢰구간a) |
3.4 (2.9, 4.2) |
1.5 (1.4, 1.5) |
|
위험비b (95% 신뢰구간a) |
0.43 ( 0.35, 0.52) |
|
|
전체 반응률 (mRECIST) |
||
|
전체 반응률 |
11% |
4% |
|
95% 신뢰구간a |
(8%, 14%) |
(2%, 8%) |
|
완전 반응 |
0.5% |
0 |
|
부분 반응 |
10% |
4% |
|
전반적 반응 (RECIST 1.1) |
||
|
전반적 반응률 |
7% |
3% |
|
95% CIa |
(4%, 10%) |
(1%, 6%) |
|
완전 반응 |
0 |
0 |
|
부분 반응 |
7% |
3% |
- aCI=신뢰구간.
- b지역, ECOG 수행 상태, 알파-태아단백질 수치, 간외 병변 유무 및 대혈관 침범 유무로 계층화된 Cox 비례위험모형으로 추정.
- c지역, ECOG 수행 상태, 알파-태아단백질 수치, 간외 병변 유무 및 대혈관 침범 유무로 계층화된 로그순위 검정.
16 제공/보관 및 취급 방법
제공 방법
정제는 다음과 같이 제공됩니다:
각 병에 28정이 들어있는 3개의 병이 포함된 패키지, 패키지 당 총 84정
(NDC 50419-171-03).
각 병에 21정이 들어있는 4개의 병이 포함된 패키지, 패키지 당 총 84정
(NDC 50419-171-06).
보관 및 취급 방법
STIVARGA를 25°C (77°F)에서 보관하며, 15~30°C (59~86°F) 범위 내에서의 일시적인 온도 변화는 허용됩니다[USP Controlled Room Temperature 참조].
정제는 원래 병에 보관하고 건조제를 제거하지 마십시오. 개봉 후에는 병을 꽉 닫아 보관하십시오.
개봉 후 7주가 지난 미사용 정제는 폐기하십시오. 미사용 정제는 지역 규정에 따라 폐기하십시오.
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨(환자 정보)을 읽도록 권고합니다.
간독성
환자에게 간 손상에 대한 모니터링이 필요하며 심각한 간 손상의 징후나 증상이 있을 경우 즉시 의료 서비스 제공자에게 보고해야 한다고 조언합니다[경고 및 주의사항 (5.1) 및 특정 집단에서의 사용 (8.6) 참조].
감염
환자에게 감염의 징후와 증상이 나타나면 의료 서비스 제공자에게 연락하도록 조언합니다[경고 및 주의사항 (5.2)] 참조
.
출혈
환자에게 비정상적인 출혈, 타박상 또는 현기증과 같은 출혈 증상이 있는 경우 의료 서비스 제공자에게 연락하도록 조언합니다[경고 및 주의사항 (5.3)] 참조.
위장관 천공 또는 누공
환자에게 복부에 심한 통증, 복부 팽만 지속, 고열, 오한, 오심, 구토 또는 탈수 증상이 있는 경우 즉시 의료 서비스 제공자에게 연락하도록 조언합니다[경고 및 주의사항 (5.4) 참조].
피부 독성
환자에게 HFSR, 발진, 통증, 물집, 출혈 또는 부종을 포함한 피부 변화가 있는 경우 의료 서비스 제공자에게 연락하도록 조언합니다 [경고 및 주의사항 (5.5)] 참조
.
고혈압
환자에게 혈압 모니터링이 필요하며 혈압이 상승하거나 심한 두통, 현기증 또는 신경계 증상 등 고혈압 증상이 나타나면 의료 서비스 제공자에게 연락하도록 조언합니다 [경고 및 주의사항 (5.6)] 참조
.
심장 허혈 및 심근경색
환자에게 가슴 통증, 숨참, 어지러움 또는 실신 증상이 있는 경우 즉시 응급 처치를 받도록 조언합니다[경고 및 주의사항 (5.7) 참조].
가역성 후두 백질병증 증후군
환자에게 RPLS의 징후와 증상이 나타나면 의료 서비스 제공자에게 연락하도록 조언합니다[경고 및 주의사항 (5.8) 참조].
상처 회복 장애 위험
환자에게 STIVARGA가 상처 회복을 저해할 수 있음을 조언합니다. 환자에게 선택적 수술 전에는 STIVARGA를 일시적으로 중단하는 것이 권장된다고 조언합니다[경고 및 주의사항 (5.9)] 참조
.
태아 독성
환자에게 regorafenib은 태아에게 해를 끼칠 수 있음을 조언합니다. 임신한 여성에게 태아에 대한 잠재적 위험을 조언합니다[경고 및 주의사항 (5.10) 및 특정 집단에서의 사용 (8.1, 8.3) 참조]
.
임신 가능성이 있는 여성과 남성
- •
- 임신 가능성이 있는 여성에게 STIVARGA 치료 기간 및 치료 종료 후 2개월 동안 효과적인 피임법이 필요함을 조언합니다. 임신 가능성이 있는 여성에게 STIVARGA 치료 중 또는 치료 종료 후 2개월 이내에 임신이 의심되거나 확인된 경우 즉시 의료 서비스 제공자에게 연락하도록 지시합니다[경고 및 주의사항 (5.10) 및 특정 집단에서의 사용 (8.1, 8.3) 참조].
- •
- 임신 가능성이 있는 남성에게 STIVARGA 치료 기간 및 치료 종료 후 2개월 동안 효과적인 피임법이 필요함을 조언합니다[특정 집단에서의 사용 (8.3) 참조].
수유
수유부에게 regorafenib이 모유에 존재하는지 알려지지 않았으며 수유를 중단할 것인지 또는 regorafenib 사용을 중단할 것인지에 대해 상담하도록 조언합니다[특정 집단에서의 사용 (8.2) 참조].
투여
- •
- 환자에게 STIVARGA 정제를 저지방식 식사 후 매일 같은 시간에 물과 함께 통째로 삼키도록 조언합니다. 환자에게 저지방식 식사는 600칼로리 미만, 지방 30% 미만이어야 함을 알려줍니다[용법 용량 (2.1) 참조].
- •
- 환자에게 약을 원래 용기에 보관하도록 조언합니다. 약을 일일 또는 주간 약통에 넣지 마십시오. 병을 연 후 7주가 지나면 남은 정제는 폐기하십시오. 사용 후에는 병을 꽉 닫고 건조제를 병에 넣어 두십시오[공급 방법 (16) 참조].
복용 지침
환자에게 저지방식 식사 후에 STIVARGA를 복용하도록 조언합니다. 환자에게 복용을 잊은 경우 기억난 그 날 복용하고, 전날 놓친 복용량을 보충하기 위해 하루에 두 번 복용해서는 안 된다고 조언합니다[용법 용량 (2.1) 참조].
제조사:
Bayer HealthCare Pharmaceuticals Inc.
Whippany, NJ 07981 USA
환자 정보 전단지
|
환자 안내서 STIVARGA (스티바가) (regorafenib) 정제 |
|
|
STIVARGA에 대해 알아야 할 가장 중요한 정보는 무엇입니까? STIVARGA는 심각한 부작용을 유발할 수 있습니다. 다음 증상이 나타나는 경우: 간 문제. STIVARGA는 심각하고 때로는 사망에 이를 수 있는 간 문제를 일으킬 수 있습니다. 의료진은 STIVARGA 복용을 시작하기 전과 치료 중에 간 기능 검사를 위한 혈액 검사를 실시할 것입니다. 치료 중 다음과 같은 증상이 나타나면 즉시 의료진에게 알리십시오: |
|
|
|
|
STIVARGA란 무엇입니까? STIVARGA는 다음 질환을 가진 환자의 치료에 사용되는 처방약입니다:
18세 미만 어린이에 대한 STIVARGA의 안전성과 유효성은 알려져 있지 않습니다. |
|
|
STIVARGA를 복용하기 전에, 다음을 포함한 모든 질병에 대해 의료진에게 알리십시오:
복용 중인 모든 약물에 대해 의료진에게 알리십시오. 처방약과 비처방약, 비타민, 허브 보조제 등이 포함됩니다. STIVARGA는 다른 약물의 작용 방식에 영향을 줄 수 있으며, 다른 약물은 STIVARGA의 작용 방식에 영향을 줄 수 있습니다. |
|
|
STIVARGA는 어떻게 복용해야 하나요?
STIVARGA를 과다 복용한 경우 의료진에게 연락하거나 가까운 응급실로 즉시 가십시오. |
|
|
STIVARGA 복용 중 피해야 할 것은 무엇입니까? STIVARGA 치료 중에는 자몽 주스를 마시거나 세인트 존스 워트를 복용하는 것을 피하십시오. 이는 STIVARGA의 작용 방식에 영향을 줄 수 있습니다. |
|
|
STIVARGA의 가능한 부작용은 무엇입니까? STIVARGA는 다음과 같은 심각한 부작용을 일으킬 수 있습니다:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
STIVARGA의 가장 흔한 부작용은 다음과 같습니다: |
|
|
|
|
특정 부작용이 있는 경우 의료 제공자가 STIVARGA 용량을 변경하거나 일시적 또는 영구적으로 치료를 중단할 수 있습니다. 이는 STIVARGA의 가능한 모든 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 1-800-FDA-1088로 부작용을 보고할 수 있습니다. |
|
|
STIVARGA는 어떻게 보관합니까?
STIVARGA와 모든 약은 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|
|
STIVARGA의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 Patient Information 전단지에 나열된 것 이외의 목적으로 처방됩니다. 처방되지 않은 상태에 대해 STIVARGA를 사용하지 마십시오. 귀하와 동일한 증상이 있더라도 다른 사람에게 STIVARGA를 제공하지 마십시오. 그들에게 해를 끼칠 수 있습니다. 의료 전문가를 위해 작성된 STIVARGA에 대한 정보는 의료 제공자 또는 약사에게 문의할 수 있습니다. |
|
|
STIVARGA의 성분은 무엇입니까? 활성 성분: regorafenib 비활성 성분: microcrystalline cellulose, croscarmellose sodium, magnesium stearate, povidone, colloidal silicon dioxide. 필름 코팅: ferric oxide red, ferric oxide yellow, lecithin(soy), polyethylene glycol 3350, polyvinyl alcohol, talc, titanium dioxide. Bayer HealthCare Pharmaceuticals Inc., Whippany, NJ 07981 미국을 위해 제조됨. © 2017 Bayer HealthCare Pharmaceuticals Inc. |
|
- 본 환자 정보는 미국 식품의약국(U.S. Food and Drug Administration)의 승인을 받았습니다. 개정: 02/2020
포장/라벨 주요 표시면
NDC 50419-171-03
Rx Only
Stivarga
(regorafenib) tablets
40 mg
3 x 28 정
경구 투여용