의약품 제조업체: Dr. Reddys Laboratories Inc. (Updated: 2021-12-20)
처방 정보 강조
SAPROPTERIN DIHYDROCHLORIDE 정제, 경구용
SAPROPTERIN DIHYDROCHLORIDE 분말, 경구용
미국 최초 승인: 2007년
최근 주요 변경 사항
경고 및 주의 사항
상부 위장관 점막 염증 (5.2) 12/2019
표시 및 사용
사프로테린 디하이드로클로라이드는 테트라하이드로바이오테린(BH4) 반응성 페닐케톤뇨증(PKU)로 인한 성인 및 소아 환자(1개월 이상)의 혈중 페닐알라닌(Phe) 수치를 감소시키는 페닐알라닌 하이드록시라제 활성화제로서 Phe 제한 식이와 함께 사용되어야 합니다. (1)
용량 및 투여 방법
사프로테린 디하이드로클로라이드로 치료 중인 모든 PKU 환자는 Phe 제한 식이(식이 단백질 및 Phe 제한 포함)로 치료되어야 합니다. (2.1)
시작용량
- 1개월에서 6세까지 소아 환자: 사프로테린 디하이드로클로라이드의 권장 시작용량은 1일 10 mg/kg입니다. (2.1)
- 7세 이상 환자: 사프로테린 디하이드로클로라이드의 권장 시작용량은 1일 10~20 mg/kg입니다. (2.1)
용량 조절
- 사프로테린 디하이드로클로라이드의 용량은 1일 5~20 mg/kg 범위로 조절될 수 있습니다. (2.1)
- 특히 소아 환자의 경우 혈중 Phe를 정기적으로 모니터링하십시오. (2.1, 5.3)
준비 및 투여
용량 형태 및 강도
- 정제: 100 mg 사프로테린 디하이드로클로라이드. (3)
- 경구용 분말: 100 mg 및 500 mg 사프로테린 디하이드로클로라이드. (3)
금기 사항
없음. (4)
경고 및 주의 사항
-
과민 반응(아나필락시스 포함): 사프로테린 디하이드로클로라이드는 사프로테린 디하이드로클로라이드에 대한 아나필락시스 이력이 있는 환자에게 권장되지 않으며, 아나필락시스를 경험한 환자에게는 치료를 중단하고 적절한 의료 치료를 시작하십시오.
Phe 제한 식이를 계속하세요. (5.1)
-
상부 위장관 점막 염증: 식도염 및 위염을 포함한 이러한 상태의 증상 및 징후를 모니터링하십시오. (5.2)
-
저페닐알라닌혈증: 7세 미만 소아 환자 중 1일 20 mg/kg 용량의 사프로테린 디하이드로클로라이드를 투여받은 환자는 7세 이상 환자와 비교하여 혈중 Phe 수치가 낮아질 위험이 높습니다. (5.3)
-
치료 중 혈중 Phe 수치 모니터링: 사프로테린 디하이드로클로라이드로 치료 중에는 적절한 혈중 Phe 조절과 영양 균형을 유지하십시오. 특히 소아 환자의 경우 정기적인 혈액 모니터링이 권장됩니다. (5.4, 2.1)
부작용
가장 흔한 부작용(≥4%)은 두통, 코막힘, 인후통, 설사, 구토, 기침 및 코막힘입니다. (6.1)
의심되는 부작용을 신고하려면 1-800-983-4587 또는 FDA 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호작용
환자 상담 정보 및 FDA 승인 환자 라벨링은 17을 참조하십시오.
개정일: 2020년 9월
목차
전체 처방 정보: 목차*
1 적응증 및 사용법
2 용법 및 투여
2.1 용량
2.2 조제 및 투여 지침
3 제형 및 함량
4 금기사항
5 경고 및 주의사항
5.1 아나필락시스를 포함한 과민반응
5.2 위장관 점막 염증
5.3 Hypophenylalaninemia
5.4 치료 중 혈중 Phe 수치 모니터링
5.5 Sapropterin Dihydrochloride에 대한 생화학적 반응 부족
5.6 Levodopa와의 상호작용
5.7 과다 행동
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아에서의 사용
8.5 노인에서의 사용
10 과량 투여
11 제품 설명
12 임상약리
12.1 작용기전
12.2 약력학
12.3 약동학
13 비임상 독성
13.1 발암성, 변이원성, 수태능 장애
14 임상시험
16 공급/보관 및 취급 방법
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않았습니다.
1 적응증 및 용법
Sapropterin dihydrochloride 정제는 tetrahydrobiopterin- (BH4-) 반응성 페닐케톤뇨증(PKU)으로 인한 고페닐알라닌혈증(HPA)이 있는 생후 1개월 이상의 성인 및 소아 환자의 혈중 phenylalanine (Phe) 수치를 감소시키는 데 사용됩니다. Sapropterin dihydrochloride는 Phe 제한 식단과 함께 사용해야 합니다.
2. 용량 및 투여 방법
2.1 용량
페닐케톤뇨증 관리에 숙련된 의사의 지도하에 사프로테린 디하이드로클로라이드 치료를 시행해야 합니다.
사프로테린 디하이드로클로라이드로 치료 중인 모든 페닐케톤뇨증 환자는 Phe 제한 식이, 포함하여 식이 단백질 및 Phe 제한을 받아야 합니다.
시작 용량
소아 환자 1개월에서 6세까지: 사프로테린 디하이드로클로라이드의 권장 시작 용량은 10 mg/kg로 하루 1회 투여합니다.
7세 이상 환자: 사프로테린 디하이드로클로라이드의 권장 시작 용량은 하루 1회 10~20 mg/kg입니다.
용량 조절 (평가 기간)
평가 기간 동안 기존의 식이 단백질 및 Phe 섭취량을 수정해서는 안 됩니다.
10 mg/kg/일의 시작 용량을 사용하는 경우, 사프로테린 디하이드로클로라이드 10 mg/kg/일 투여 후 1개월 동안의 혈액 Phe 변화를 통해 치료에 대한 반응을 판단합니다. 사프로테린 디하이드로클로라이드 치료 1주 후와 1개월 동안 주기적으로 혈액 Phe 수치를 확인해야 합니다. 10 mg/kg/일에서 기저선 수치에서 혈액 Phe가 감소하지 않는 경우, 용량을 하루 20 mg/kg로 증가시킬 수 있습니다. 20 mg/kg/일로 1개월 치료 후에도 혈액 Phe가 감소하지 않는 환자는 생화학적 반응이 없으므로 사프로테린 디하이드로클로라이드 치료를 중단해야 합니다.
20 mg/kg/일의 시작 용량을 사용하는 경우, 사프로테린 디하이드로클로라이드 20 mg/kg/일 투여 후 1개월 동안의 혈액 Phe 변화를 통해 치료에 대한 반응을 판단합니다. 사프로테린 디하이드로클로라이드 치료 1주 후와 첫 번째 달 동안 주기적으로 혈액 Phe 수치를 확인해야 합니다. 혈액 Phe가 감소하지 않는 환자는 치료에 대한 생화학적 반응이 없으므로 치료를 중단해야 합니다 [주의사항(5.4)].
사프로테린 디하이드로클로라이드에 대한 반응성이 확인된 후에는 생화학적 반응(혈액 Phe)에 따라 용량을 5~20 mg/kg/일 범위 내에서 조절할 수 있습니다. 특히 소아 환자의 경우 혈액 Phe 조절을 평가하기 위해 주기적인 혈액 Phe 모니터링이 권장됩니다 [주의사항(5.3)].
2.2 준비 및 투여 지침
사프로테린 디하이드로클로라이드 정제를 식사와 함께 경구로 복용하며, 가능한 매일 동일한 시간에 복용하십시오 [임상 약리학(12.3)]. 빠뜨린 복용량은 가능한 빨리 복용하되, 하루에 두 번의 복용량을 복용하지 마십시오.
사프로테린 디하이드로클로라이드 정제
사프로테린 디하이드로클로라이드 정제는 정제 전체를 복용하거나 120~240 mL의 물 또는 사과 주스에 용해하여 경구로 복용하십시오. 정제가 용해되는 데 몇 분이 걸릴 수 있습니다. 정제가 빨리 용해되도록 젓거나 분쇄할 수 있습니다. 정제가 완전히 용해되지 않을 수 있습니다. 환자는 물 또는 사과 주스 위에 작은 조각들이 떠다니는 것을 볼 수 있습니다. 이는 정상적이며 환자가 복용해도 안전합니다. 약을 마신 후에도 정제의 작은 조각들이 용기 안에 보이면, 모든 약을 복용하기 위해 물 또는 사과 주스를 추가할 수 있습니다. 사프로테린 디하이드로클로라이드 정제는 사과 소스나 푸딩과 같은 소프트 음식에 분쇄한 후 섞어 복용할 수도 있습니다.
사프로테린 디하이드로클로라이드 분말 경구용 용매
10 kg 이상의 환자
사프로테린 디하이드로클로라이드 분말 경구용 용매는 120~240 mL의 물 또는 사과 주스에 용해하여 경구로 복용하십시오. 사프로테린 디하이드로클로라이드 분말 경구용 용매는 사과 소스나 푸딩과 같은 소프트 음식에 젓거나 섞어 복용할 수도 있습니다. 소포에 들어있는 분말을 물, 사과 주스 또는 소프트 음식의 작은 양에 비우고 충분히 섞으십시오. 분말은 완전히 용해되어야 합니다.
10 kg 이하의 환자 (100 mg 소포 사용)
10 kg 이하의 영아의 경우, 사프로테린 디하이드로클로라이드 분말 경구용 용매를 5 mL 이상의 물 또는 사과 주스에 용해하고, 10 mg/kg 복용량에 해당하는 이 용매의 일부를 구강 투여 시런지를 통해 경구로 투여할 수 있습니다. 표 1은 10 mg/kg/일의 권장 시작 용량에서 영아의 복용 정보를 제공합니다. 용량 조절이 필요한 경우 20 mg/kg/일의 용량 정보는 표 2를 참조하십시오.
표 1: 10 mg/kg/일 복용 표 (10 kg 이하의 영아용)
| 환자 체중 (kg) | 시작 용량: 10 mg/kg/일* | |||
| 용량 (mg) | 사프로테린 디하이드로클로라이드 분말 경구용 용매100 mg 소포용해† | 희석 용량 (mL)‡ | 투여 용량 (mL)§ | |
| 1 | 10 | 1 | 10 | 1 |
| 2 | 20 | 1 | 10 | 2 |
| 3 | 30 | 1 | 10 | 3 |
| 4 | 40 | 1 | 10 | 4 |
| 5 | 50 | 1 | 10 | 5 |
| 6 | 60 | 1 | 5 | 3 |
| 7 | 70 | 1 | 5 | 3.5 |
| 8 | 80 | 1 | 5 | 4 |
| 9 | 90 | 1 | 5 | 4.5 |
| 10 | 100 | 1 | 5 | 5 |
*영아의 시작 용량은 10 mg/kg/일입니다. 20 mg/kg/일의 용량 정보는 표 2를 참조하십시오.
†소포 당 사프로테린 디하이드로클로라이드 100 mg가 들어있는 경구용 용매 분말
‡사프로테린 디하이드로클로라이드 분말 경구용 용매를 용해하기 위한 물 또는 사과 주스의 양
§투여할 용량을 그릇에 담은 후 남은 혼합물은 버리십시오.
표 2: 20 mg/kg/일 복용 표 (10 kg 이하의 영아용)
| 환자 체중 (kg) | 20 mg/kg/일 | |||
| 용량 (mg) | 사프로테린 디하이드로클로라이드 분말 경구용 용매 100 mg 소포*용해 | 희석 용량 (mL)† | 투여 용량 (mL)§ | |
| 1 | 20 | 1 | 5 | 1 |
| 2 | 40 | 1 | 5 | 2 |
| 3 | 60 | 1 | 5 | 3 |
| 4 | 80 | 1 | 5 | 4 |
| 5 | 100 | 1 | 5 | 5 |
| 6 | 120 | 2 | 5 | 3 |
| 7 | 140 | 2 | 5 | 3.5 |
| 8 | 160 | 2 | 5 | 4 |
| 9 | 180 | 2 | 5 | 4.5 |
| 10 | 200 | 2 | 5 | 5 |
*소포 당 사프로테린 디하이드로클로라이드 100 mg가 들어있는 경구용 용매 분말
†사프로테린 디하이드로클로라이드 분말 경구용 용매를 용해하기 위한 물 또는 사과 주스의 양
§투여할 용량을 그릇에 담은 후 남은 혼합물은 버리십시오.
3 제형 및 함량
Sapropterin dihydrochloride 정제는 경구용입니다. 각 정제는 sapropterin dihydrochloride 100mg을 함유하고 있습니다. 정제는 원형이고 미백색에서 연한 노란색을 띠며 얼룩져 있고 “177”이 양각되어 있습니다.
Sapropterin dihydrochloride 경구용 산제는 sapropterin dihydrochloride 100mg을 함유한 단위 용량 포장과 sapropterin dihydrochloride 500mg을 함유한 단위 용량 포장으로 제공됩니다. 산제는 미백색에서 노란색입니다.
4 금기 사항
없음.
5 경고 및 예방
5.1 아나필락시스를 포함한 과민 반응
Sapropterin dihydrochloride는 sapropterin dihydrochloride에 대한 아나필락시스의 병력이 있는 환자에게는 권장되지 않습니다. 아나필락시스와 발진을 포함한 과민 반응이 발생했습니다 [이상 반응 참조 (6.2)]. 아나필락시스의 징후로는 천명, 호흡곤란, 기침, 저혈압, 홍조, 오심, 발진 등이 있습니다. 아나필락시스를 경험한 환자에서 sapropterin dihydrochloride 투여를 중단하고 적절한 의학적 치료를 시작합니다. 아나필락시스를 경험한 환자에서 식이 단백질과 Phe 제한을 계속합니다.
5.2 상부 위장관 점막 염증
Sapropterin dihydrochloride와 함께 상부 위장관 점막 염증을 시사하는 위장관(GI) 이상 반응이 보고되었습니다. 심각한 이상 반응으로는 식도염과 위염이 포함되었습니다[이상 반응 참조 (6.2)]. 치료하지 않으면 식도 협착, 식도 궤양, 위궤양, 출혈 등의 심각한 후유증이 발생할 수 있으며 sapropterin dihydrochloride를 복용한 환자에서 이런 합병증이 보고되었습니다. 상부 위장관 점막 염증의 징후와 증상에 대해 환자를 모니터링합니다.
5.3 저페닐알라닌혈증
Sapropterin dihydrochloride의 임상시험에서, 일부 PKU 환자들은 sapropterin dihydrochloride 치료 중 저페닐알라닌혈증(낮은 혈중 Phe)을 경험했습니다. Sapropterin dihydrochloride 20 mg/kg/day로 치료받은 7세 미만 소아 환자의 임상연구에서, 저페닐알라닌혈증의 발생률은 더 나이 많은 환자의 임상시험보다 높았습니다 [이상 반응 참조 (6.1)].
5.4 치료 중 혈중 Phe 수치 모니터링
PKU 환자에서 혈중 Phe 수치가 장기간 상승되면 심각한 정신지체, 발달 지연, 소두증, 언어 발달 지연, 발작, 행동 이상을 포함한 심각한 신경학적 손상을 초래할 수 있습니다. 반대로, 혈중 Phe 수치가 너무 낮은 것은 이화작용 및 내인성 단백질 분해와 관련이 있는데, 이는 부정적인 발달 결과와 관련이 있습니다. Sapropterin dihydrochloride를 복용하는 동안 적절한 Phe 조절과 영양 균형을 위해서는 식이 Phe 섭취에 대한 적극적인 관리가 필요합니다. 적절한 혈중 Phe 수치 조절을 위해 치료 중 혈중 Phe 수치를 모니터링합니다. 소아 인구에서는 잦은 혈액 검사가 권장됩니다 [용량 및 투여 참조 (2.1)].
5.5 Sapropterin Dihydrochloride에 대한 생화학적 반응 부재
일부 PKU 환자는 sapropterin dihydrochloride 치료에 생화학적 반응(혈중 Phe 감소)을 보이지 않습니다. Sapropterin dihydrochloride 20 mg/kg/day 용량의 두 임상시험에서, 소아 PKU 환자의 56%~75%가 sapropterin dihydrochloride에 생화학적 반응을 보였고, 10 mg/kg/day 용량의 한 임상시험에서는 성인 및 소아 PKU 환자의 20%가 sapropterin dihydrochloride에 생화학적 반응을 보였습니다 [임상 연구 참조 (14)].
Sapropterin dihydrochloride 치료에 대한 생화학적 반응은 일반적으로 실험실 검사(예: 분자 검사)로 미리 결정할 수 없으며, sapropterin dihydrochloride 반응에 대한 치료 시험(평가)을 통해 결정되어야 합니다 [용량 및 투여 참조 (2.1)].
5.6 Levodopa와의 상호작용
PKU가 아닌 적응증에 대한 또 다른 sapropterin 제품을 사용한 10년 시판 후 안전성 감시 프로그램에서, 기저 신경 장애가 있는 3명의 환자가 levodopa와 sapropterin의 병용 투여 중 발작, 발작 악화, 과도한 자극, 과민성을 경험했습니다. Levodopa를 투여받는 환자는 sapropterin dihydrochloride 치료 중 신경학적 상태 변화에 대해 모니터링해야 합니다 [약물 상호 작용 참조 (7)].
5.7 과다행동
Sapropterin dihydrochloride 시판 후 안전성 감시 프로그램에서, PKU 환자 2명이 sapropterin dihydrochloride 치료 시 과다행동을 경험했습니다 [이상 반응 참조 (6.2)]. 과다행동에 대해 환자를 모니터링합니다.
6 부작용 반응
6.1 이상반응
임상시험은 광범위한 조건하에서 수행되므로 임상시험에서 관찰된 약물의 이상반응 발생률을 다른 약물의 임상시험에서 직접 비교할 수는 없으며, 실제 진료 환경에서 관찰된 발생률과 차이가 있을 수 있습니다.
PKU 임상연구
Sapropterin dihydrochloride의 안전성은 PKU 환자(1개월 ~ 50세)를 대상으로 한 7건의 임상연구에서 평가되었습니다 [임상시험 참조 (14)].
연구 1~4(대조 및 비대조 연구)에서 PKU 환자 579명(4~49세)이 sapropterin dihydrochloride를 1~164주 동안 1일 5~20 mg/kg의 용량으로 투여받았습니다. 대상 환자의 성별이 고르게 분포되어 있었고 약 95%가 백인이었습니다. 가장 흔한 이상반응(≥4% 환자)은 두통, 비염, 인후통, 설사, 구토, 기침, 코막힘이었습니다.
표 3은 2건의 이중맹검, 위약대조 임상시험(연구 2 및 4)에서 6~10주 동안 sapropterin dihydrochloride를 1일 10~20 mg/kg 투여받은 PKU 환자 74명의 노출을 반영합니다.
표 3은 상기 이중맹검, 위약대조 임상시험에서 sapropterin dihydrochloride 투여 환자의 4% 이상에서 발생한 이상반응을 열거하고 있습니다.
표 3: 위약대조 임상시험에서 Sapropterin Dihydrochloride 투여 시 4% 이상 환자에서 발생한 이상반응 요약
|
MedDRA 선호용어 |
투여군 |
|
|
Sapropterin Dihydrochloride (N=74) |
위약 (N=59) |
|
|
환자 수(%) |
환자 수(%) |
|
|
두통 |
11 (15) |
8 (14) |
|
비염 |
8 (11) |
0 |
|
인후통 |
7(10) |
1 (2) |
|
설사 |
6 (8) |
3 (5) |
|
구토 |
6 (8) |
4 (7) |
|
기침 |
5 (7) |
3 (5) |
|
코막힘 |
3 (4) |
0 |
개방표지, 비대조 임상시험(연구 1 및 3)에서 모든 환자는 sapropterin dihydrochloride를 1일 5~20 mg/kg 용량으로 투여받았고, 이상반응의 유형과 빈도는 이중맹검, 위약대조 임상시험과 유사했습니다 [임상시험 참조 (14)].
연구 5에서 1개월 ~ 6세 PKU 소아 환자 65명이 6개월 동안 sapropterin dihydrochloride 1일 20 mg/kg을 투여받았습니다. 이 환자들에서 이상반응은 유형과 빈도가 다른 sapropterin dihydrochloride 임상시험과 유사했으나 낮은 Phe 수치의 발생 빈도가 높았습니다. 환자의 25%(16/65명)에서 연령 대비 정상 미만의 Phe 수치를 보였습니다 [주의사항 (5.3), 소아 사용 (8.4), 임상시험 (14) 참조].
연구 6의 장기 개방표지 연장 연구에서 4~50세 환자 111명이 1일 5~20 mg/kg의 sapropterin dihydrochloride를 투여받았으며, 이상반응은 이전 임상시험에서와 유형 및 빈도가 유사했습니다. 55명의 환자는 용해 및 정제 형태로 sapropterin dihydrochloride를 투여받았습니다. 두 가지 투여 방식 간에 이상반응의 발생률이나 중증도에는 뚜렷한 차이가 없었습니다. 전체 연구 대상자의 sapropterin 노출 평균(±표준편차)은 659 ± 221일(최대 953일)이었습니다.
연구 7에서 0~4세 PKU 소아 환자 27명이 sapropterin dihydrochloride 1일 10 mg/kg 또는 20 mg/kg을 투여받았습니다. 이상반응의 유형과 빈도는 다른 임상시험에서와 유사했으며, 비염이 2명(7.4%)에서 추가로 보고되었습니다.
PKU 외 적응증 임상시험의 안전성 경험
건강한 피험자와 PKU 이외의 질환을 가진 환자 약 800명(일부는 기저 신경계 질환 또는 심혈관 질환을 가지고 있었음)에게 약 19건의 대조 및 비대조 임상시험에서 동일한 활성 성분(사프롭테린)의 다른 제형이 투여되었습니다. 이러한 임상시험에서 피험자들은 1일 1~100 mg/kg의 용량으로 사프롭테린을 투여받았으며 노출 기간은 1일에서 2년이었습니다. 사프롭테린 투여 중 발생한 중대하고 중증의 이상반응(인과관계와 무관)은 발작, 발작 악화 [Warnings and Precautions (5.3) 참조], 어지러움, 위장관 출혈, 시술 후 출혈, 두통, 과민증, 심근경색, 과자극, 호흡부전이었습니다. 일반적인 이상반응은 두통, 말초 부종, 관절통, 다뇨증, 초조, 어지러움, 구역, 인두염, 복통, 상복부 통증, 상기도 감염이었습니다.
6.2 시판 후 경험
사프롭테린 염산염의 승인 후 사용 중 다음과 같은 이상반응이 보고되었습니다. 이러한 반응은 크기가 알려지지 않은 모집단에서 자발적으로 보고되므로, 이들의 빈도를 확실히 예측하거나 약물 노출과의 인과관계를 확립하는 것이 항상 가능한 것은 아닙니다.
아나필락시스 및 발진을 포함한 과민 반응: 대부분의 과민 반응은 치료 시작 후 며칠 이내에 발생했습니다 [Warnings and Precautions (5.1) 참조].
위장관계 반응: 식도염, 위염, 구인두 통증, 인두염, 식도 통증, 복통, 소화불량, 구역 및 구토 [Warnings and Precautions (5.2) 참조].
과잉행동: 두 건이 보고되었습니다. 한 건에서 환자는 사프롭테린 염산염을 우발적으로 과량 투여했습니다 [Warnings and Precautions (5.6), Overdosage (10) 참조].
7. 약물 상호작용
표 4는 sapropterin dihydrochloride와 함께 투여할 때 임상적으로 중요한 약물 상호작용이 있는 약물과 이를 예방 또는 관리하기 위한 지침을 포함합니다.
표 4: 임상적으로 관련 있는 약물 상호작용
| Levodopa | |
| 임상적 영향 | Sapropterin dihydrochloride는 levodopa의 전구체인 tyrosine의 이용률을 증가시킬 수 있습니다. Sapropterin과 levodopa를 PKU가 아닌 적응증에 대해 병용 투여받은 환자에서 시판 후 신경계 이상반응이 보고되었습니다[경고 및 주의사항 참조(5.5)] |
| 중재 | 신경학적 상태의 변화에 대해 환자를 모니터링하십시오. |
| Folate 합성 억제제(예: methotrexate, valproic acid, phenobarbital, trimethoprim) | |
| 임상적 영향 | In vitro 및 in vivo 비임상 데이터는 folate 합성을 억제하는 약물이 BH4의 재활용(재생성)에 관여하는 효소인 dihydrofolate reductase를 억제함으로써 내인성 BH4의 생체이용률을 감소시킬 수 있음을 시사합니다. 이러한 BH4 수준의 감소는 Phe 수치를 증가시킬 수 있습니다. |
| 중재 | 병용 투여 중에는 혈중 Phe 수치를 더 자주 모니터링하는 것을 고려하십시오. 생화학적 반응을 얻기 위해 Sapropterin Dihydrochloride의 증량이 필요할 수 있습니다. |
| Nitric Oxide 매개 혈관 이완에 영향을 미치는 약물(예: sildenafil, vardenafil 또는 tadalafil과 같은 PDE-5 억제제) | |
| 임상적 영향 | Sapropterin dihydrochloride와 PDE-5 억제제 모두 혈관 이완을 유도할 수 있습니다. 혈압 저하가 발생할 수 있습니다. 그러나 이러한 약물의 병용 사용은 사람에서 평가되지 않았습니다. |
| 중재 | 혈압을 모니터링하십시오. |
8 특정 인구에서의 사용
8.1 임신
임신 노출 레지스트리
임신 중 sapropterin dihydrochloride에 노출된 여성의 임신 결과를 모니터링하는 임신 노출 레지스트리가 확립되었습니다. 레지스트리 프로그램에 대한 자세한 내용은 1-800-983-4587로 전화하십시오.
위험 요약
사용 가능한 임신 레지스트리 데이터는 sapropterin dihydrochloride를 임신 중 사용했을 때 sapropterin dihydrochloride와 주요 선천성 결함, 유산 또는 산모나 태아에 대한 이상반응 간의 연관성을 보고하지 않았습니다(데이터 참조)).
기관형성기 동안 최대 권장 인간 용량(MRHD)의 최대 3배까지 경구 투여한 랫트를 이용한 sapropterin dihydrochloride의 배아-태아 발달 연구에서는 영향이 없었습니다. 기관형성기 동안 sapropterin dihydrochloride를 경구 투여한 토끼 연구에서 MRHD의 10배에서 드문 결함인 holoprosencephaly가 관찰되었습니다.
모든 임신에는 주요 선천성 결함, 임신 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인지된 임신에서 주요 선천성 결함 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다. 임신 중 혈중 phenylalanine 농도를 600 micromol/L 이상으로 유지하는 PKU 임산부의 주요 선천성 결함 및 유산의 추정 배경 위험은 PKU가 없는 임산부의 해당 배경 위험보다 큽니다.
임상적 고려사항
질환 관련 산모 및/또는 배아-태아 위험
임신 전과 임신 중 조절되지 않은 혈중 phenylalanine 농도는 부작용 임신 결과 및 태아 이상 반응의 위험 증가와 관련이 있습니다. hyperphenylalaninemia로 인한 태아 이상 반응의 위험을 줄이기 위해 임신 중 및 임신 3개월 전에 혈중 phenylalanine 농도를 120~360 micromol/L로 유지해야 합니다[투여량 및 투여 방법 (2.1) 참조].
데이터
인체 데이터
조절되지 않은 산모 PKU
PKU 영향을 받은 여성의 468건의 임신 및 331건의 출생아에 대한 Maternal Phenylketonuria Collaborative Study의 사용 가능한 데이터에 따르면 600 micromol/L 이상의 조절되지 않은 Phe 수치는 신경학적, 심장, 얼굴 이형성 및 성장 이상의 매우 높은 발생률과 관련이 있습니다. 임신 중 혈중 phenylalanine의 조절은 Phe 유발 기형 효과의 발생률을 줄이는 데 필수적입니다.
임신 레지스트리 데이터
62건의 출생아 데이터에서 출생 시 3건의 이상(소두증, 구개열 및 혀끈 각 1건)이 보고되었습니다. 이러한 결과는 임신 중 360 micromol/L를 초과하는 Phe 수치와 관련이 있었습니다.
동물 데이터
기관형성기 동안 투여한 sapropterin dihydrochloride를 최대 400 mg/kg/day의 경구 용량(체표면적을 기준으로 MRHD 20 mg/kg/day의 약 3배)까지 사용한 랫트 생식 연구에서 배아-태아 발달에 미치는 영향은 관찰되지 않았습니다. 그러나 기관형성기 동안 최대 600 mg/kg/day(체표면적을 기준으로 MRHD의 약 10배)의 경구 투여와 관련된 토끼 생식 연구에서는 대조군 처리 litter(태아 1마리)와 비교하여 고용량 처리 litter 2마리(태아 4마리)에서 holoprosencephaly 발생률이 통계적으로 유의하지 않게 증가했습니다.
8.2 수유
위험 요약
모유에서 sapropterin의 존재를 평가할 데이터가 불충분하고 모유 생성에 미치는 영향에 대한 데이터가 없습니다. 시판 후 임신 레지스트리에서 두 레지스트리에서 총 16명의 여성이 평균 3.5개월 동안 모유 수유를 하는 것으로 확인되었습니다. sapropterin dihydrochloride로 치료하는 동안 수유모의 영아에서 수유 관련 안전성 문제는 보고되지 않았습니다. Sapropterin은 정맥 투여 후 수유 랫트의 우유에서 발견되었지만 경구 투여 후에는 발견되지 않았습니다.
모유 수유의 발달 및 건강상의 이점은 sapropterin dihydrochloride에 대한 산모의 임상적 필요성, sapropterin dihydrochloride 또는 기저 산모 상태로 인한 모유 수유 아동에 대한 잠재적 부작용과 함께 고려되어야 합니다.
8.4 소아 사용
생후 1개월에서 16세 사이의 PKU 소아 환자가 임상시험에서 sapropterin dihydrochloride로 치료를 받았습니다[임상 연구(14) 참조].
신생아에서 sapropterin dihydrochloride의 유효성과 안전성은 확립되지 않았습니다. 4세 미만 소아에서는 6개월 기간의 시험에서, 4세 이상 소아에서는 최대 3년 기간의 시험에서 sapropterin dihydrochloride의 안전성이 확립되었습니다[이상 반응(6.1) 참조].
생후 1개월 이상의 소아에서 sapropterin dihydrochloride의 유효성은 6주 이하 기간의 시험에서 입증되었습니다[임상 연구(14) 참조].
다기관, 공개, 단일 연구에서 4주간의 sapropterin dihydrochloride 치료와 Phe 식이 제한 후 sapropterin dihydrochloride 반응자로 정의된 생후 1개월에서 6세 사이의 환자 57명을 6개월 동안 sapropterin dihydrochloride 20 mg/kg/day로 치료했습니다. 4주 이후 혈중 Phe 수치 감소에 대한 sapropterin dihydrochloride 단독의 효과는 연구 기간 동안 Phe 섭취량의 동시 변화로 인해 결정할 수 없었습니다. 생후 1개월에서 2세 미만 및 2세에서 7세 미만 환자의 시간 경과에 따른 평균(±SD) 혈중 Phe 값은 Figure 1에 나와 있습니다.
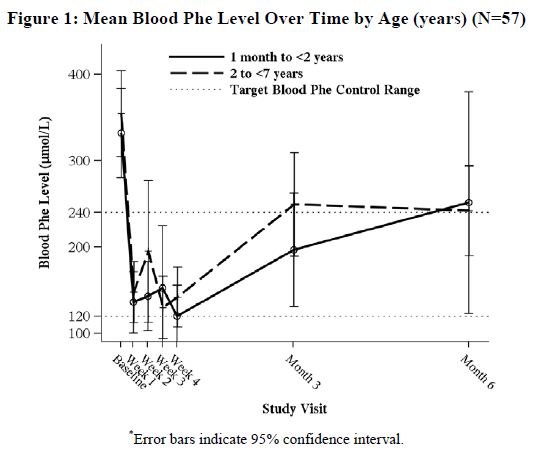
8.5 노인 사용
PKU 환자를 대상으로 한 sapropterin dihydrochloride의 임상 연구에는 65세 이상 환자가 포함되지 않았습니다. 이러한 환자가 젊은 환자와 다르게 반응하는지 여부는 알려져 있지 않습니다.
10 과량 투여
Sapropterin dihydrochloride의 의도하지 않은 과량 투여 두 건이 보고되었다. Sapropterin dihydrochloride 임상 시험에서 한 성인 환자는 2,600 mg (20 mg/kg) 대신 4,500 mg (36 mg/kg)의 sapropterin dihydrochloride 단일 용량을 투여 받았다. 환자는 약물 복용 직후 경미한 두통과 어지러움을 보고했으며, 두 증상 모두 치료 중재 없이 1시간 이내에 해결되었다. 관련된 실험실 검사 이상은 없었다. 환자는 24시간 동안 치료를 중단한 후 이상 징후나 증상 보고 없이 sapropterin dihydrochloride를 다시 시작했다. 시판 후 조사에서 한 소아 환자는 20 mg/kg/day 대신 45 mg/kg/day의 sapropterin dihydrochloride 용량을 투여 받았다. 환자는 과량 투여 후 불특정 시점에 시작되어 sapropterin dihydrochloride 용량을 20 mg/kg/day로 줄인 후 해결된 과잉 행동을 보고했다.
Sapropterin dihydrochloride가 심장 재분극에 미치는 영향을 평가하기 위한 임상 연구에서 54명의 건강한 성인에게 100 mg/kg (최대 권장 용량의 5배)의 단일 치료 용량을 투여했다. 연구 기간 동안 심각한 이상 반응은 보고되지 않았다. 치료 용량을 투여 받은 1명 이상의 피험자에서 보고된 유일한 이상 반응은 상복부 통증 (6%)과 어지러움 (4%)이었다. 용량 의존적인 QT 간격 단축이 관찰되었다[임상 약리학 참조 (12.2)].
과량 투여 시 환자에게 의사에게 알리도록 권고해야 한다.
11 제품 설명
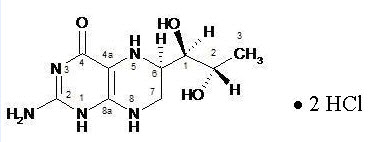
Sapropterin dihydrochloride 정제는 경구로 투여하는 Phenylalanine Hydroxylase 활성제(또는 PAH 활성제)입니다. Sapropterin dihydrochloride 정제와 경구용 액제의 활성 성분인 Sapropterin dihydrochloride는 천연 tetrahydrobiopterin (BH4)의 dihydrochloride 염의 합성 제제입니다. Sapropterin dihydrochloride는 황백색 내지 연황색의 결정 또는 결정성 분말입니다.
Sapropterin dihydrochloride의 화학명은 (6R)-2-amino-6-[(1R,2S)-1,2-dihydroxypropyl]-5,6,7,8-tetrahydro-4(1H)-pteridinone dihydrochloride이며 분자식은 C9H15N5O3·2HCl이고 분자량은 314.17입니다.
Sapropterin dihydrochloride의 구조식은 다음과 같습니다:
Sapropterin dihydrochloride는 sapropterin dihydrochloride 100mg(sapropterin base 76.8mg에 해당)을 함유한 정제와 분말 경구 용액제로 공급됩니다. Sapropterin dihydrochloride는 또한 sapropterin dihydrochloride 500mg(sapropterin base 384mg에 해당)을 함유한 분말 경구 용액제로 공급됩니다.
정제는 원형의 황백색 내지 연황색으로 얼룩무늬가 있으며 “177”이 새겨져 있습니다. 각 정제는 다음과 같은 비활성 성분을 포함합니다: ascorbic acid (USP), crospovidone (NF), dibasic calcium phosphate (USP), D-mannitol (USP), riboflavin (USP), sodium stearyl fumarate (NF).
Sapropterin dihydrochloride 분말 경구 용액제는 황백색 내지 황색입니다. 각 단위 용량 포장에는 다음과 같은 비활성 성분이 포함되어 있습니다: ascorbic acid (USP), D-mannitol (USP), potassium citrate (USP), sucralose (NF).
12 임상약리
12.1 작용기전
Sapropterin dihydrochloride는 phenylalanine hydroxylase (PAH) 효소의 cofactor인 BH4의 합성 형태이다. PAH는 산화 반응을 통해 Phe를 hydroxylation하여 tyrosine을 형성한다. PKU 환자에서는 PAH 활성이 없거나 결핍되어 있다. BH4로 치료하면 잔류 PAH 효소 활성을 활성화시키고 Phe의 정상적인 산화 대사를 개선하며 일부 환자에서 Phe 수치를 감소시킬 수 있다.
12.2 Pharmacodynamics
BH4 치료에 반응하는 PKU 환자에서는 sapropterin dihydrochloride 단일 투여 후 24시간 이내에 혈중 Phe 수치가 감소하지만, Phe 수치에 대한 최대 효과는 환자에 따라 최대 한 달이 걸릴 수 있다. Sapropterin dihydrochloride를 하루에 한 번 복용하면 24시간 동안 안정적인 혈중 Phe 수치를 유지하기에 충분하다. 혈중 Phe 수치가 516~986 micromol/L(평균 747 ± 153 micromol/L)인 12명의 환자를 대상으로 10 mg/kg/day의 아침 용량 투여 후 24시간 혈중 Phe 수치 모니터링을 실시했다. 24시간 관찰 기간 동안 혈중 Phe 수치는 안정적으로 유지되었다. 24시간 동안 음식 섭취 후 혈중 Phe 수치의 상당한 증가는 관찰되지 않았다.
Sapropterin dihydrochloride 용량-반응 관계는 5 mg/kg/day, 20 mg/kg/day, 10 mg/kg/day 용량으로 open-label, forced titration 연구(연구 3)에서 연구되었다 [임상 연구 참조 (14.1)]. 환자 간 개별 혈중 Phe 수치는 매우 다양했다. 각 2주 용량 기간 종료 시 관찰된 평균 혈중 Phe 수치는 sapropterin dihydrochloride 용량이 증가함에 따라 감소했으며, sapropterin dihydrochloride 용량과 평균 혈중 Phe 수치 사이의 역관계를 보여주었다.
심장 전기생리
56명의 건강한 성인을 대상으로 QTc 연구가 수행되었다. 이 무작위, 위약 및 active controlled crossover 연구는 sapropterin dihydrochloride의 단일 supra-therapeutic (100 mg/kg) 용량 또는 단일 therapeutic (20 mg/kg) 용량이 심장 재분극에 미치는 영향을 확인하기 위해 수행되었다. 이 연구에서 sapropterin dihydrochloride는 물에 녹인 정제를 fed 상태에서 투여했다. 이 연구는 용량 의존적인 QT 간격 단축을 입증했다. 위약을 뺀 QTc 간격의 기저치 대비 최대 평균 변화량은 20 및 100 mg/kg에서 각각 -3.69 및 -8.32 ms (90% CI의 하한: -5.3 및 -10.6 ms)였다.
12.3 Pharmacokinetics
건강한 피험자를 대상으로 한 연구에서는 공복 상태에서 물이나 오렌지 주스에 정제를 녹여 복용할 때 sapropterin의 흡수가 유사함을 보여주었다. 고지방/고칼로리 식사 후 녹인 정제를 투여하면 Cmax는 평균 84%, AUC는 87% 증가했다(물에 녹인 경우). 그러나 투여 방법 및 식사 조건에 따른 Cmax 및 AUC의 개별 피험자 값은 매우 다양했다. Sapropterin dihydrochloride의 임상시험에서는 식사와 관계없이 아침에 녹인 정제를 투여했다. PKU 환자에서 평균 소실 반감기는 약 6.7시간(범위 3.9~17시간)으로 건강한 피험자에서 관찰된 값(범위 3.0~5.3시간)과 유사했다.
Sapropterin dihydrochloride 10 mg/kg을 투여한 건강한 성인 대상 연구에서는 공복 상태에서 녹인 정제 투여 시에 비해 intact 정제 투여 시 AUC0-t에 기반한 흡수가 40% 더 높았다. Fed 상태에서 intact 정제를 투여하면 AUC0-t에 기반한 흡수 정도가 공복 상태에 비해 약 43% 증가했다 [용량 및 투여 참조 (2.2)].
1개월~49세 환자를 포함한 sapropterin의 population pharmacokinetic 분석에서는 체중이 clearance 또는 분포 용적에 실질적으로 영향을 미치는 유일한 공변량임을 보여주었다(표 5 참조). 49세 초과 환자에서의 pharmacokinetics는 연구되지 않았다.
표 5. 연령별 겉보기 혈장 청소율
|
Parameter |
0 to <1 yr* (N=10) |
1 to <6 yr* (N=57) |
6 to <12 yr† (N=23) |
12 to <18 yr† (N=24) |
≥18 yr† (N=42) |
|
CL/F (L/hr/kg) 평균 ± SD (중앙값) |
81.5 ± 92.4 |
50.7 ± 20.1 |
51.7 ± 21.9 |
39.2 ± 9.3 |
37.9 ± 20.2 |
*20 mg/kg/day 용량에서 평가
†5, 10, 또는 20 mg/kg/day 용량에서 평가
대사
Sapropterin은 tetrahydrobiopterin (BH4)의 합성 형태이며 동일한 내인성 효소에 의해 대사되고 재순환될 것으로 예상된다. In vivo에서 내인성 BH4는 quinoid dihydrobiopterin으로 전환되고 dihydrobiopterin과 biopterin으로 대사된다. Dihydrofolate reductase와 dihydropteridine reductase 효소가 BH4의 대사와 재순환을 담당한다.
약물 상호작용 연구
임상 연구
건강한 피험자에서 sapropterin dihydrochloride를 최대 치료 용량인 20 mg/kg으로 단회 투여하는 것은 병용 투여된 digoxin (P-gp 기질) 단회 투여의 pharmacokinetics에 영향을 미치지 않았다.
약물 상호작용 가능성이 임상적으로 추가 평가되지 않은 in vitro 연구
Sapropterin이 cytochrome P450 효소를 유도하거나 억제할 가능성은 in vitro 연구에서 평가되었으며, sapropterin은 CYP 1A2, 2B6, 2C8, 2C9, 2C19, 2D6 또는 3A4/5를 억제하지 않았고 CYP 1A2, 2B6 또는 3A4/5를 유도하지 않았다.
In vitro에서 sapropterin은 OAT1, OAT3, OCT2, MATE1 및 MATE2-K 수송체를 억제하지 않았다. Sapropterin이 OATP1B1과 OATP1B3을 억제할 가능성은 적절히 연구되지 않았다. In vitro에서 sapropterin은 breast cancer resistance protein (BCRP)을 억제하지만 sapropterin dihydrochloride에 의한 BCRP 기질의 전신 노출 임상적으로 유의한 증가 가능성은 낮아 보인다.
13 비임상 독성학
13.1 발암성, 변이원성, 수태능 장애
F-344 랫드에서 2년간의 발암성 연구가 수행되었고, CD-1 마우스에서 78주간의 발암성 연구가 수행되었다. 랫드에서의 104주 경구 발암성 연구에서는 sapropterin dihydrochloride를 25, 80, 250 mg/kg/day 용량(체표면적을 기준으로 각각 최대 권장 인체 용량 20 mg/kg/day의 0.2, 0.7, 2배)으로 사용하였다. 마우스에서의 78주 경구 발암성 연구에서는 sapropterin dihydrochloride를 25, 80, 250 mg/kg/day 용량(체표면적을 기준으로 각각 권장 인체 용량의 0.1, 0.3, 2배)으로 사용하였다. 2년간의 랫드 발암성 연구에서, vehicle 투여 랫드에 비해 250 mg/kg/day 용량(체표면적을 기준으로 최대 권장 인체 용량의 약 2배)으로 치료한 수컷 랫드에서 양성 부신 갈색세포종 발생률이 통계적으로 유의하게 증가하였다. 마우스 발암성 연구에서는 발암 효과의 증거가 없었으나, 104주 대신 78주 동안 진행되어 이상적인 연구는 아니었다.
Sapropterin dihydrochloride는 대사 활성화 없이 625 mcg (TA98) 및 5000 mcg (TA100) per plate 농도에서 in vitro Ames 시험에서 genotoxic하였다. 그러나 대사 활성화가 있는 in vitro Ames 시험에서는 genotoxicity가 관찰되지 않았다. Sapropterin dihydrochloride는 0.25 및 0.5 mM 농도의 Chinese hamster lung cell에서 in vitro 염색체 이상 분석에서 genotoxic하였다. Sapropterin dihydrochloride는 최대 2,000 mg/kg/day 용량(체표면적을 기준으로 최대 권장 인체 용량 20 mg/kg/day의 약 8배)으로 마우스에서 in vivo micronucleus assay에서 mutagenic하지 않았다. 최대 400 mg/kg/day 용량(체표면적을 기준으로 최대 권장 인체 용량의 약 3배)의 경구 투여 sapropterin dihydrochloride는 수컷 및 암컷 랫드의 수태능 및 생식 기능에 영향을 미치지 않는 것으로 확인되었다.
14 임상 연구
Sapropterin dihydrochloride의 효능은 PKU 환자를 대상으로 한 5개의 임상 연구에서 평가되었습니다.
연구 1은 기준치 혈중 Phe 농도가 ≥ 450 micromol/L이고 Phe 제한 식단을 하지 않은 8세에서 48세(평균 22세)의 PKU 환자 489명을 대상으로 한 다기관, 공개, 비대조 임상시험이었습니다. 모든 환자는 8일 동안 sapropterin dihydrochloride 10 mg/kg/day 투여를 받았습니다. 이 연구의 목적상, sapropterin dihydrochloride 치료에 대한 반응은 기준치 대비 혈중 Phe의 ≥ 30% 감소로 정의되었습니다. 8일째에 96명(20%)의 환자가 반응자로 확인되었습니다.
연구 2는 연구 1에서 sapropterin dihydrochloride에 반응한 PKU 환자 88명을 대상으로 한 다기관, 이중 맹검, 위약 대조 연구였습니다. 연구 1에서 휴약기 후, 환자들은 6주 동안 sapropterin dihydrochloride 10 mg/kg/day(N=41) 또는 위약(N=47)으로 동일하게 무작위 배정되었습니다. 유효성은 위약군의 평균 변화와 비교하여 기준치에서 6주까지 sapropterin dihydrochloride 치료군의 혈중 Phe 농도의 평균 변화로 평가되었습니다.
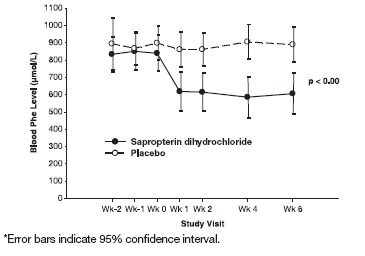
결과는 기준치에서 sapropterin dihydrochloride 치료군의 평균(±SD) 혈중 Phe 농도가 843 (±300) micromol/L이고 위약군은 888 (±323) micromol/L이었음을 보여주었습니다. 6주차에 sapropterin dihydrochloride 치료군은 평균(±SD) 혈중 Phe 농도가 607 (±377) micromol/L이었고, 위약군은 평균 혈중 Phe 농도가 891 (±348) micromol/L이었습니다. 6주차에 sapropterin dihydrochloride 및 위약 치료군은 각각 –239 및 6 micromol/L의 평균 혈중 Phe 농도 변화를 보였습니다(각각 –29% (±32) 및 3% (±33)의 평균 백분율 변화). 두 그룹 간의 차이는 통계적으로 유의했습니다(p < 0.001) (Table 6).
Table 6: Study 2의 혈중 Phe 결과
|
Sapropterin (N=41) |
Placebo (N=47) |
|
|
기준치 혈중 Phe 농도* (micromol/L) |
||
|
평균 (±SD) |
843 (±300) |
888 (±323) |
|
백분위수 (25th, 75th) |
620, 990 |
618, 1141 |
|
6주차 혈중 Phe 농도 (micromol/L) |
||
|
평균 (±SD) |
607 (±377) |
891 (±348) |
|
백분위수 (25th, 75th) |
307, 812 |
619, 1143 |
|
기준치에서 6주까지 혈중 Phe의 평균 변화 (micromol/L) |
||
|
보정 평균 (±SE)† |
-239 (±38) |
6 (±36) |
|
백분위수 (25th, 75th) |
-397, -92 |
-96, 93 |
|
기준치에서 6주까지 혈중 Phe의 평균 백분율 변화 |
||
|
평균 (±SD) |
– 29 (±32) |
3 (±33) |
|
백분위수 (25th, 75th) |
-61, -11 |
-13, 12 |
*이 표에 나타난 평균 기준치 농도는 3 가지 치료 전 농도(Wk -2, Wk -1, Wk 0)의 평균을 나타냅니다. Sapropterin dihydrochloride 정제 또는 위약 치료는 Wk 0에 시작되었습니다.
†p-value < 0.001, 반응 변수로서 기준치에서 6주까지 혈중 Phe 농도의 변화와 covariates로서 치료군 및 기준치 혈중 Phe 농도 모두를 포함한 ANCOVA 모델에서 보정된 평균 및 표준 오차.
Sapropterin dihydrochloride 치료군에서 1주차에 혈중 Phe 변화가 관찰되었고 6주까지 지속되었습니다(Figure 2).
Figure 2: 시간 경과에 따른 평균 혈중 Phenylalanine (Phe) 농도*
연구 3은 연구 1에서 sapropterin dihydrochloride 치료에 반응하고 연구 2를 완료한 80명의 환자가 3가지 다른 용량의 sapropterin dihydrochloride로 6주간의 강제 용량 적정을 받은 다기관, 공개, 연장 연구였습니다. 치료는 sapropterin dihydrochloride를 5, 20, 10 mg/kg/day 용량으로 각각 2주씩 연속 3회 투여하는 것으로 구성되었습니다. 혈중 Phe 농도는 각 용량 수준에서 2주간의 치료 후 모니터링되었습니다. 기준치에서 평균(±SD) 혈중 Phe는 844 (±398) micromol/L이었습니다. 5, 10, 20 mg/kg/day 치료 종료 시, 평균(±SD) 혈중 Phe 농도는 각각 744 (±384) micromol/L, 640 (±382) micromol/L, 581 (±399) micromol/L이었습니다(Table 7).
Table 7: 연구 3의 강제 용량 적정에서의 혈중 Phe 결과
|
Sapropterin Dihydrochloride 용량 수준 (mg/kg/day) |
환자 수 |
평균 (±SD) 혈액 Phe 수준 (마이크로mol/L) |
기준치로부터 평균 혈액 Phe 수준의 변화 (±SD) (마이크로mol/L) |
|
기준치 (무 처치) |
80 |
844 (±398) |
— |
|
5 |
80 |
744 (±384) |
‑100 (±295) |
|
10 |
80 |
640 (±382) |
‑204 (±303) |
|
20 |
80 |
581 (±399) |
-263 (±318) |
연구 4는 페닐알라닌 제한 식이 요법을 받고 있으며 스크리닝 시 혈액 페닐알라닌 수치가 ≤480 마이크로mol/L인 4세에서 12세 사이의 PKU 소아 환자 90명을 대상으로 한 다기관 연구였습니다. 모든 환자에게 공개라벨 사프로프테린 이염화물 20mg/kg/일을 8일간 투여했습니다. 사프로프테린 이염화물에 대한 반응은 8일 차 기준 혈액 페닐알라닌 수치가 기준치 대비 ≥30% 감소한 경우로 정의되었습니다. 8일 차에 50명의 환자(56%)가 혈액 페닐알라닌 수치 ≥30% 감소를 보였습니다.
연구 5는 1개월에서 6세 사이의 PKU 소아 환자 93명을 대상으로 한 공개라벨, 단일군, 다기관 시험이었습니다. 대상 환자는 스크리닝 시 페닐알라닌 수치가 360 마이크로mol/L 이상이었습니다. 모든 환자에게 사프로프테린 이염화물 20mg/kg/일을 투여하고 페닐알라닌 제한 식이 요법을 병행했습니다. 4주 차에 57명의 환자(61%)가 반응자(기준치 대비 혈액 페닐알라닌 수치 ≥30% 감소)로 확인되었습니다(그림 1, 섹션 8.4 참조).
16 공급/보관 및 취급방법
Sapropterin Dihydrochloride 정제
100 mg sapropterin dihydrochloride 정제는 원형이며, 미백색에서 연한 노란색을 띠고, 얼룩져 있으며, “177”이 음각되어 있습니다. 정제는 다음과 같이 공급됩니다:
NDC 43598-749-04 120정 들이 병
Dr. Reddy’s는 sapropterin dihydrochloride 정제만 판매합니다.
보관법
Sapropterin dihydrochloride 정제는 20ºC~25ºC(68ºF~77ºF)에서 보관하며, 15ºC~30ºC(59ºF~86ºF) 사이에서의 일시적인 노출은 허용됩니다[USP Controlled Room Temperature 참조]. 용기를 밀폐하여 보관하십시오. 습기로부터 보호하십시오.
Sapropterin dihydrochloride 경구용 파우더는 20ºC~25ºC(68ºF~77ºF)에서 보관하며, 15ºC~30ºC(59ºF~86ºF) 사이에서의 일시적인 노출은 허용됩니다[USP Controlled Room Temperature 참조]. 습기로부터 보호하십시오.
17 환자 상담 정보
환자 또는 간병인에게 FDA 승인 환자 라벨(환자 정보 및 사용 지침)을 읽도록 권고합니다.
아나필락시스를 포함한 과민 반응
환자와 간병인에게 천명, 호흡곤란, 기침, 저혈압, 홍조, 구역질, 발진 등의 아나필락시스 증상이 나타나면 sapropterin dihydrochloride 투여를 중단하고 즉시 환자의 의료진에게 연락하도록 권고합니다. 식이 단백질 및 Phe 제한을 포함한 영양 관리를 지속합니다 [Warnings and Precautions (5.1) 참조].
상부 위장관 점막 염증
환자가 구역질, 구토, 연하곤란, 소화불량, 식욕 감소, 구강인두, 식도 또는 상복부 통증 등 상부 위장관 점막 염증을 시사하는 징후 및 증상을 경험하는 경우 의료진에게 연락하도록 환자와 간병인에게 권고합니다 [Warnings and Precautions (5.3) 참조].
Hypophenylalaninemia [Warnings and Precautions (5.3) 참조]
Sapropterin dihydrochloride는 특히 7세 미만의 소아 환자에서 hypophenylalaninemia(낮은 혈중 Phe 수치)를 유발할 수 있음을 환자와 간병인에게 조언합니다.
혈중 Phe 수치 모니터링 [Warnings and Precautions (5.4) 참조]
혈중 Phe 수치가 바람직한 범위 내에 있도록 하려면 잦은 혈중 Phe 모니터링이 중요하며, sapropterin dihydrochloride 투여 중에도 식이 단백질과 Phe 제한을 유지해야 함을 환자와 간병인에게 조언합니다.
PKU 환자의 장기간 hyperphenylalaninemia(높은 혈중 Phe 수치)는 지적 장애, 발달 지연, 소두증, 언어 지연, 발작 및 행동 이상을 포함한 심각한 신경학적 손상을 초래할 수 있습니다.
Sapropterin Dihydrochloride에 대한 생화학적 반응 부족
일부 환자는 sapropterin dihydrochloride로 치료할 때 생화학적 반응(혈중 Phe 감소)을 보이지 않습니다. 환자가 sapropterin dihydrochloride 20mg/kg/day로 1개월 치료 후 혈중 Phe에서 적절한 생화학적 반응을 보이지 않으면 sapropterin dihydrochloride 투여를 중단하도록 환자와 간병인에게 조언합니다 [Dosage and Administration (2.1), Warnings and Precautions (5.4) 참조].
Levodopa와의 상호작용
기저 신경계 장애가 있는 환자가 levodopa와 병용하여 sapropterin dihydrochloride를 복용하면 발작, 발작 악화, 과다자극 또는 과민반응이 나타날 수 있음을 환자와 간병인에게 조언합니다. Sapropterin dihydrochloride 치료 중 신경학적 상태 변화가 있는 경우 의료진에게 연락하도록 환자와 보호자에게 알립니다 [Warnings and Precautions (5.5) 참조].
과잉 행동
Sapropterin dihydrochloride가 과잉 행동을 유발할 수 있으며, 환자가 과잉 행동, 안절부절, 안절부절못함 또는 과도한 말을 경험하는 경우 의료 서비스 제공자에게 연락하도록 환자와 보호자에게 조언하십시오 [Warnings and Precautions (5.6) 참조].
용량 및 모니터링 [Dosage and Administration (2.1) 참조]
다음 사항을 환자 및 간병인에게 조언합니다:
-
Sapropterin dihydrochloride는 식이 단백질 및 Phe 제한을 포함하여 PKU 특이적 식단과 함께 사용해야 합니다.
-
생화학적 반응을 평가할 때 sapropterin dihydrochloride 평가 기간 동안 식이 단백질 및 Phe 섭취량을 수정해서는 안 됩니다.
-
연령에 따라 권장 용량으로 sapropterin dihydrochloride 치료 후 환자의 혈중 Phe 변화를 평가하여 생화학적 반응이 있는지 확인해야 하며, sapropterin dihydrochloride 치료 첫 달 동안 혈중 Phe 수치와 식이 Phe 섭취량을 자주 평가해야 합니다.
-
Sapropterin dihydrochloride 치료 중 혈중 Phe 수치 모니터링이 중요합니다.
준비 및 투여 [Dosage and Administration (2.2) 참조]
환자 및 간병인에게 다음과 같이 조언합니다:
-
Sapropterin dihydrochloride 정제는 통째로 삼키거나 물이나 사과 주스에 녹이거나 으깨어 사과 소스나 푸딩 같은 부드러운 음식에 섞어 먹을 수 있습니다.
-
Sapropterin dihydrochloride 경구용 분말은 물이나 사과 주스에 녹이거나 사과 소스나 푸딩 같은 부드러운 음식에 섞어야 합니다.
-
Sapropterin dihydrochloride는 식사와 함께, 가급적 매일 같은 시간에 복용하십시오.
임신
Sapropterin dihydrochloride 치료를 받는 동안 임신한 PKU 여성에 대한 데이터를 수집하기 위해 PKU 환자를 위한 제품 레지스트리가 있음을 환자에게 조언합니다 [Use in Specific Populations (8.1) 참조].
유통:
Dr. Reddy’s Laboratories, Inc.
Princeton, NJ 085409 USA
환자 정보
| 환자 정보 Sapropterin (SAP-roe-PTER-in) Dihydrochloride 정제 Sapropterin (SAP-roe-PTER-in) Dihydrochloride 경구용 분말 |
|
| Sapropterin dihydrochloride는 무엇인가요? Sapropterin dihydrochloride는 특정 유형의 페닐케톤뇨증(PKU)이 있는 1개월 이상의 성인 및 어린이의 혈중 페닐알라닌(Phe) 수치를 낮추는 데 사용되는 처방약입니다. Sapropterin dihydrochloride는 Phe 제한 식단과 함께 사용됩니다. |
|
| Sapropterin dihydrochloride를 복용하기 전에 의사에게 무엇을 말해야 하나요?
Sapropterin dihydrochloride를 복용하기 전에 다음을 포함한 모든 의학적 상태에 대해 의사에게 알리십시오:
복용 중인 모든 약물에 대해 의사에게 알리십시오. 여기에는 처방약, 비처방약, 비타민, 허브 및 식이 보조제가 포함됩니다. Sapropterin dihydrochloride와 다른 약물이 상호 작용할 수 있습니다. 특히 다음과 같은 약물을 복용하는 경우 의사에게 알리십시오:
복용 중인 약물이 위에 나열된 약물인지 확실하지 않은 경우 의사에게 알리십시오. 복용 중인 약물을 알아두십시오. 새로운 약물을 받을 때 의사와 약사에게 보여줄 목록을 만드십시오. |
|
|
Sapropterin dihydrochloride는 어떻게 복용해야 하나요?
|
|
| Sapropterin dihydrochloride의 가능한 부작용은 무엇인가요?
Sapropterin dihydrochloride는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다:
|
|
|
|
Sapropterin dihydrochloride의 가장 흔한 부작용은 다음과 같습니다:
불편하거나 사라지지 않는 부작용이 있는 경우 의사에게 알리십시오. 이것이 sapropterin dihydrochloride의 가능한 모든 부작용은 아닙니다. 자세한 정보는 의사나 약사에게 문의하십시오. 부작용에 대해 의사와 상담하십시오. 부작용은 FDA에 1-800-FDA-1088로 보고할 수 있습니다. |
|
|
Sapropterin dihydrochloride는 어떻게 보관해야 합니까?
Sapropterin dihydrochloride 정제와 모든 약물은 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|
| Sapropterin dihydrochloride의 안전하고 효과적인 사용에 대한 일반 정보 . 의약품은 때때로 환자 정보 전단지에 나열된 것 이외의 목적으로 처방됩니다. Sapropterin dihydrochloride를 처방받지 않은 상태에 사용하지 마십시오. 증상이 같더라도 sapropterin dihydrochloride를 다른 사람에게 주지 마십시오. 해를 끼칠 수 있습니다. 의료 전문가를 위해 작성된 sapropterin dihydrochloride에 대한 정보는 약사나 의사에게 문의할 수 있습니다. |
|
| Sapropterin dihydrochloride의 성분은 무엇입니까?
활성 성분: sapropterin dihydrochloride. Sapropterin dihydrochloride 정제의 비활성 성분: ascorbic acid, crospovidone, dibasic calcium phosphate, D-mannitol, riboflavin 및 sodium stearyl fumarate. 경구용 용액 분말의 비활성 성분: ascorbic acid, D-mannitol, potassium citrate 및 sucralose. Dr. Reddy’s는 sapropterin dihydrochloride 정제만 판매합니다. 배포: 자세한 내용은 1-800-983-4587로 전화하십시오. |
|
이 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다.
발행일: 09/2020
사용 설명서
사프로테린 디하이드로클로라이드 정제
사프로테린 디하이드로클로라이드 분말 경구용 용해액
사프로테린 디하이드로클로라이드를 복용하기 전에 이 사용 설명서를 읽고 처방전을 다시 채울 때마다 읽으십시오. 새로운 정보가 있을 수 있습니다. 이 정보는 의료 공급자와의 대화를 대체하지 않습니다. 사프로테린 디하이드로클로라이드의 적절한 용량 또는 혼합 방법에 대한 질문이 있으면 의사와 상담하십시오.
중요한 정보:
- 사프로테린 디하이드로클로라이드는 정제 혹은 분말 형태로 제공됩니다.
- 사프로테린 디하이드로클로라이드는 의사의 지시에 따라 정확히 복용하십시오. 의사는 복용량과 복용 시기에 대해 지시할 것입니다.
- 치료에 대한 반응이나 아기의 체중에 따라 의사는 사프로테린 디하이드로클로라이드의 용량을 조정할 수 있습니다.
- 아기의 체중이 22 파운드 이하인 경우, “22 파운드 이하의 아기에게 사프로테린 디하이드로클로라이드 분말 경구용 용해액 (사프로테린 디하이드로클로라이드 100 mg 패킷)” 섹션을 따르십시오.
- 사프로테린 디하이드로클로라이드 정제는 하루에 한 번 식사와 함께 복용하십시오. 가능하면 매일 같은 시간에 복용하는 것이 좋습니다.
사프로테린 디하이드로클로라이드 정제 복용 방법:
사프로테린 디하이드로클로라이드 정제는 통째로 삼킬 수도 있고 물이나 사과 주스에 용해시킬 수도 있습니다. 또한 정제를 분쇄하여 사과 소스나 푸딩과 같은 소프트 음식에 섞을 수도 있습니다.
사프로테린 디하이드로클로라이드 정제 용해 방법:
- 사프로테린 디하이드로클로라이드 정제를 4온스에서 8온스(½컵에서 1컵)의 물이나 사과 주스에 섞으십시오. 정제가 용해되는 데 몇 분이 걸릴 수 있습니다. 정제가 빨리 용해되도록 저어주거나 분쇄할 수 있습니다.
- 정제가 완전히 용해되지 않을 수 있습니다. 물이나 사과 주스 위에 작은 조각이 떠다닐 수 있습니다. 이는 정상적이며 복용해도 안전합니다.
- 15분 이내에 마십시오.
- 약을 마신 후에도 정제의 작은 조각이 보이면 물이나 사과 주스를 추가로 섞어서 약을 모두 복용하십시오.
사프로테린 디하이드로클로라이드 분말 경구용 용해액 복용 방법:
22 파운드 이하인 아기에게는 아래에 “22 파운드 이하의 아기에게 사프로테린 디하이드로클로라이드 분말 경구용 용해액 (사프로테린 디하이드로클로라이드 100 mg 패킷)”이라고 표시된 섹션을 참조하십시오.
사프로테린 디하이드로클로라이드 분말 경구용 용해액은 물이나 사과 주스에 용해시켜야 합니다. 분말 용해액은 사과 소스나 푸딩과 같은 소프트 음식에도 섞을 수 있습니다.
사프로테린 디하이드로클로라이드 분말 경구용 용해 방법:
• 의사가 지정한 사프로테린 디하이드로클로라이드 용량과 사프로테린 디하이드로클로라이드 100 mg 패킷, 사프로테린 디하이드로클로라이드 500 mg 패킷 또는 두 종류의 패킷을 혼합하여 용량을 준비해야 하는지 확인하십시오.
• 사프로테린 디하이드로클로라이드 분말 경구용 용해액 패킷을 사용하기 전에 패킷의 오른쪽 상단에 점선으로 표시된 부분을 접거나 자르십시오. 패킷을 사용할 준비가 되었을 때에만 패킷을 엽니다.
• 사프로테린 디하이드로클로라이드 분말 경구용 용해액 패킷의 내용물을 4온스에서 8온스(½컵에서 1컵)의 물이나 사과 주스에 붓십시오.
• 30분 이내에 마십시오.
22 파운드 이하인 아기에게 사프로테린 디하이드로클로라이드 분말 경구용 용해액 (사프로테린 디하이드로클로라이드 100 mg 패킷) 복용 방법:
• 사프로테린 디하이드로클로라이드 용량은 체중을 기준으로 합니다.
아기가 성장함에 따라 용량이 변경됩니다. 의사는 다음 사항을 알려줄 것입니다:
- 한 번 투여할 때 필요한 사프로테린 디하이드로클로라이드 100 mg 패킷의 개수
- 사프로테린 디하이드로클로라이드를 혼합하기 위해 필요한 물 또는 사과 주스의 양
- 아기에게 처방된 약의 용량을 위해 혼합물(분말과 물 또는 사과 주스)의 양
• 혼합물(분말과 물 또는 사과 주스)을 혼합한 후 30분 이내에 아기에게 권장 용량을 투여하십시오. 혼합한 후 30분 이내에 아기에게 투여할 수 없는 경우 사용하지 않은 약을 버리고 새로운 용량을 혼합해야 합니다.
아기에게 사프로테린 디하이드로클로라이드 분말 경구용 용해액을 혼합하고 투여하기 위해 필요한 용품:
• 한 번 투여할 때 필요한 사프로테린 디하이드로클로라이드 100 mg 패킷의 개수
• 작은 컵에 물이나 사과 주스
• 혼합을 위한 30 mL 약용 컵
• 혼합을 위한 작은 숟가락 또는 깨끗한 주방용품
• 10 mL 구강 투여 주사기
• 가위(선택 사항)
이러한 용품이 없는 경우 약사에게 문의하십시오.
1단계: 깨끗하고 평평한 작업 표면을 찾으십시오.
2단계: 작업 표면에 작은 컵에 물이나 사과 주스, 구강 투여 주사기 및 빈 약용 컵을 놓으십시오(그림 A 참조).
그림 A
3단계: 의사의 지시에 따라 작은 컵에서 5 mL 또는 10 mL의 물이나 사과 주스를 약용 컵에 붓십시오. 약용 컵에 붓는 액체의 양이 의사가 지시한 양과 일치하는지 확인하십시오(그림 B 참조).
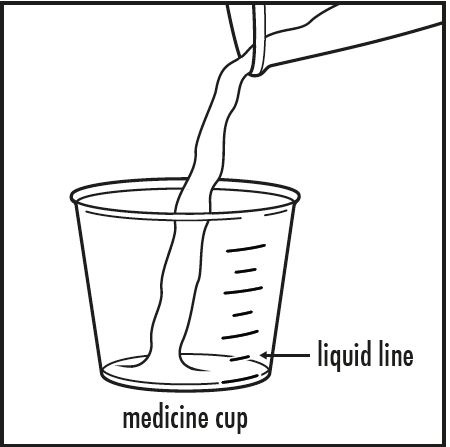
그림 B
4단계: 사프로테린 디하이드로클로라이드 패킷의 라벨을 확인하십시오. 패킷에 “사프로테린 디하이드로클로라이드 100 mg”라고 표시되어 있는 경우 사프로테린 디하이드로클로라이드 패킷 전체 내용물을 약용 컵에 붓으십시오(그림 C 참조).
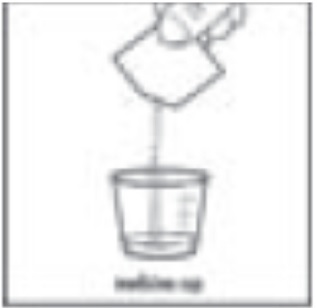
그림 C
5단계: 작은 숟가락이나 깨끗한 주방용품으로 혼합물을 완전히 용해될 때까지 저어주십시오(그림 D 참조).
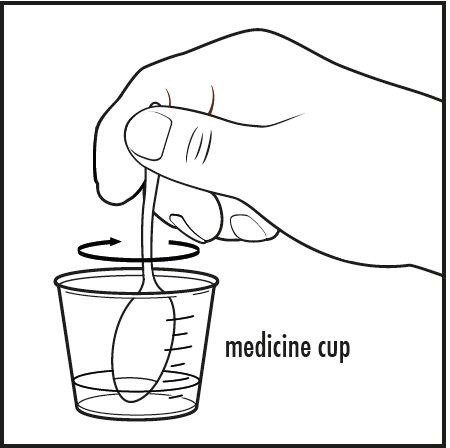
그림 D
6단계: 아기에게 사프로테린 디하이드로클로라이드를 투여하려면: 구강 투여 주사기의 끝을 약용 컵 안의 액체에 넣으십시오. 플런저를 당겨서 의사가 지시한 혼합물의 양만큼 흡입하십시오(그림 E 참조).
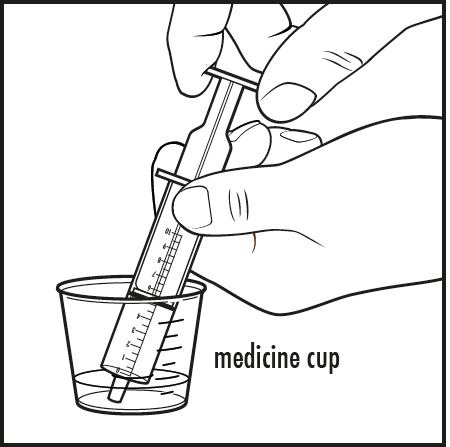
그림 E
7단계: 구강 투여 주사기를 약용 컵에서 꺼내십시오. 주사기의 끝이 위를 향하도록 주의하여 약용 컵 안의 약의 양이 의사가 지시한 혼합물의 양과 일치하는지 확인하십시오(그림 F 참조).
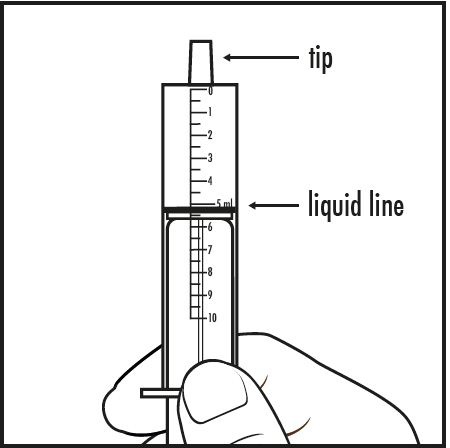
그림 F
8단계: 구강 투여 주사기의 끝을 아기의 입으로 넣으십시오. 구강 투여 주사기의 끝을 아기의 볼 쪽으로 향하도록 하십시오(그림 G 참조). 플런저를 천천히 누르면서 약용 주사기 안의 혼합물이 모두 투여됩니다.
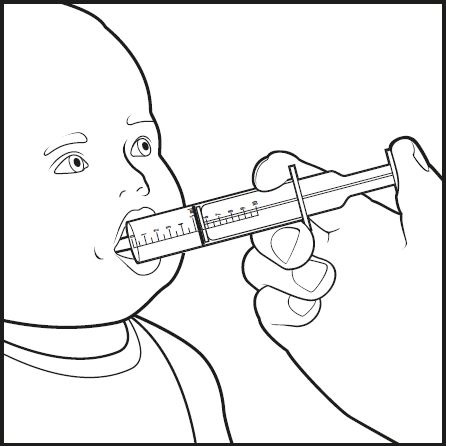
그림 G
9단계: 남은 혼합물을 버리십시오. 구강 투여 주사기의 플런저를 주사기 본체에서 분리하십시오. 온수로 주사기와 약용 컵을 세척한 후 천천히 건조시키십시오. 구강 투여 주사기가 건조되면 플런저를 다시 본체에 넣으십시오. 다음 사용을 위해 구강 투여 주사기와 약용 컵을 보관하십시오.
사프로테린 디하이드로클로라이드를 어떻게 보관해야 합니까?
- 사프로테린 디하이드로클로라이드를 68°F에서 77°F(20°C에서 25°C)의 실온에서 보관하십시오.
- 사프로테린 디하이드로클로라이드 정제를 원본 병에 밀폐하여 보관하십시오.
- 습기로부터 보호하십시오.
사프로테린 디하이드로클로라이드와 모든 약을 어린이의 손이 닿지 않는 곳에 보관하십시오.
Dr. Reddy’s는 사프로테린 디하이드로클로라이드 정제만을 시판합니다.
이 사용 설명서는 미국 식품의약국(FDA)에서 승인되었습니다.
유통사:
Dr. Reddy’s Laboratories, Inc.
Princeton, NJ 08540 USA
발행일: 09/2020
패키지 라벨 주요 디스플레이 패널 섹션
용기 : 120개입

주요 디스플레이 패널
용기 카톤: 1 카톤 당 1 병


