의약품 제조업체: Wockhardt USA LLC. (Updated: 2021-12-07)
처방 정보 하이라이트
최근 주요 변경사항
경고 및 주의사항, 심혈관계 사망 (
5.5) 11/2021
적응증 및 용법
용량 및 투여법
- Mycobacterial 감염 (
2.2)
제형 및 함량
- Azithromycin 정제 600 mg (
3)
금기사항
경고 및 주의사항
- 심각한 (치명적인 경우 포함) 알레르기 및 피부 반응. 반응이 발생하면 azithromycin 투여를 중단하고 적절한 치료를 시작하십시오. (
5.1)
- 간독성: 간염의 징후 및 증상이 나타나면 즉시 azithromycin 투여를 중단하십시오. (
5.2)
- 영아 비대성 유문 협착증(IHPS): 신생아(출생 후 42일까지의 치료)에서 azithromycin 사용 후 IHPS가 보고되었습니다. 구토 또는 수유 시 과민성이 발생하면 의사에게 연락하도록 부모와 보호자에게 지시하십시오. (
5.3)
- QT 간격 연장 및 torsades de pointes 사례가 보고되었습니다. 치명적일 수 있는 이 위험은 QT 연장 또는 torsades de pointes 병력이 알려진 경우, proarrhythmic 상태인 경우, QT 간격을 연장시키는 다른 약물과 함께 복용하는 경우 등 특정 심혈관 장애가 있는 환자에서 고려되어야 합니다. (
5.4)
- 심혈관계 사망: 일부 관찰 연구에 따르면 amoxicillin을 포함한 다른 항균제에 비해 azithromycin에 노출된 성인에서 급성 심혈관 사망의 단기 잠재적 위험이 약 2배 증가하는 것으로 나타났습니다. Azithromycin 처방 시 이러한 잠재적 위험과 치료 이점의 균형을 고려하십시오. (
5.5)
- Clostridium difficile 관련 설사: 설사가 발생하면 환자를 평가하십시오. (
5.6)
- Azithromycin은 중증 근무력증 환자의 근력 약화를 악화시킬 수 있습니다. (
5.7)
이상반응
가장 흔한 이상반응은 설사(5%), 구역(3%), 복통(3%) 또는 구토(비율 제시되지 않음)입니다. (
6)
이상반응이 의심되는 경우 Wockhardt USA LLC.에 1-800-346-6854로 연락하거나 FDA에 1-800-FDA-1088 또는
www.fda.gov/medwatch로 보고하십시오.
약물 상호작용
특정 집단에서의 사용
환자 상담 정보는 17번을 참조하십시오.
개정: 12/2021
목차
전체 처방 정보: 목차*
1 적응증 및 용법
1.2 Mycobacterial Infections
1.3 사용법
2 용량 및 투여 방법
2.2 Mycobacterial Infections
3 제형 및 함량
4 금기사항
4.1 과민증
4.2 간 기능 장애
5 경고 및 주의사항
5.1 과민증
5.2 간독성
5.3 영아 비대성 유문협착증(IHPS)
5.4 QT 연장
5.5 심혈관계 사망
5.6 Clostridium difficile 연관 설사(CDAD)
5.7 중증 근무력증 악화
5.9 내성균 발현
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
6.3 실험실적 이상
7 약물 상호작용
7.1 Nelfinavir
7.2 Warfarin
7.3 Macrolides와의 잠재적 약물 상호작용
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아에 대한 사용
8.5 고령자에 대한 사용
10 과량 투여
11 성상
12 임상약리
12.1 작용기전
12.2 약력학
12.3 약동학
12.4 미생물학
13 비임상 독성학
13.1 발암성, 돌연변이, 수태능 장애
13.2 동물 독성학
14 임상시험
14.1 진행성 HIV 감염 환자에서 파종성 MAC 질환의 예방 및 치료를 위한 임상시험
15 참고문헌
16 공급/보관 및 취급방법
17 환자 상담 정보
- *
- 전체 처방 정보에 포함되지 않은 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 사용법
Azithromycin 정제, USP는 아래에 나열된 특정 조건에서 지정된 미생물의 감수성 균주에 의해 유발되는 경증에서 중등도의 감염 치료를 위해 사용되는 macrolide 항생제입니다.
1.2 Mycobacterial 감염
파종성 Mycobacterium avium complex (MAC) 질환의 예방
Azithromycin 정제, USP는 단독으로 또는 승인된 용량의 rifabutin과 병용 투여 시 진행된 HIV 감염 환자에서 파종성 MAC 질환을 예방하기 위해 사용됩니다
[
용법 용량 (2) 참조].
파종성 MAC 질환의 치료
Azithromycin 정제, USP는 ethambutol과 병용 투여 시 진행된 HIV 감염 환자에서 파종성 MAC 감염 치료에 사용됩니다
[
임상시험 (14.1) 참조].
1.3 사용법
내성균의 발현을 줄이고 azithromycin 및 기타 항균제의 효과를 유지하기 위해, azithromycin은 감수성 세균에 의해 발생한 것으로 입증되었거나 강력하게 의심되는 감염증 치료에만 사용해야 합니다. 배양 및 감수성 정보가 있는 경우, 항균 요법을 선택하거나 수정할 때 고려해야 합니다. 그러한 데이터가 없는 경우, 해당 지역의 역학 및 감수성 양상이 경험적 요법 선택에 기여할 수 있습니다.
2 용법 및 투여
2.2 mycobacterial 감염
파종성
Mycobacterium avium complex (MAC) 질환 예방을 위한 azithromycin의 권장 용량은 다음과 같습니다: 1200 mg을 주 1회 복용. azithromycin tablets, USP의 이 용량은 rifabutin의 승인된 용법과 병용할 수 있습니다.
파종성 MAC 감염 치료
Azithromycin은 권장 일일 용량 15 mg/kg의 ethambutol과 병용하여 1일 600 mg을 복용해야 합니다. MAC에 대해
in vitro 활성을 보인 다른 항결핵제는 의사 또는 의료 제공자의 재량에 따라 azithromycin과 ethambutol 요법에 추가할 수 있습니다.
3 제형 및 함량
Azithromycin 정제 600 mg은 한 면에는 W962가 각인되어 있고 다른 면은 평평한 흰색 필름코팅 타원형 biconvex 정제로 무수 azithromycin 600 mg이 함유되어 있습니다. 30정이 1병에 포장되어 있습니다.
4 금기 사항
4.1 과민반응
Azithromycin 정제는 azithromycin, erythromycin, 기타 macrolide 또는 ketolide 계열 약물에 대해 알려진 과민반응이 있는 환자에게 금기이다.
5 경고 및 주의사항
5.1 과민반응
Azithromycin 요법을 받는 환자에서 angioedema, anaphylaxis, Acute Generalized Exanthematous Pustulosis (AGEP), Stevens-Johnson Syndrome, toxic epidermal necrolysis를 포함한 심각한 알레르기 반응 및 피부 반응이 드물게 보고되었습니다.
[
치명적인 사례가 보고된 바 있습니다. Drug Reaction with Eosinophilia and Systemic Symptoms (DRESS) 사례도 보고되었습니다. 일부 환자에서는 알레르기 증상에 대한 초기 대증요법이 성공적이었음에도 불구하고, 대증요법을 중단하면 추가적인 azithromycin 노출 없이도 알레르기 증상이 곧바로 재발하였습니다. 이러한 환자들은 장기간의 관찰과 대증요법이 필요했습니다. 이러한 에피소드와 azithromycin의 긴 조직 반감기 및 이로 인한 항원에 대한 장기간 노출 간의 관계는 현재 알려져 있지 않습니다.
알레르기 반응이 발생하면 약물 투여를 중단하고 적절한 치료를 시작해야 합니다. 의사는 대증요법을 중단할 때 알레르기 증상이 재발할 수 있음을 인지해야 합니다.
5.2 간독성
간기능 이상, 간염, 담즙정체성 황달, 간 괴사, 간부전이 보고되었으며, 일부는 사망에 이르렀습니다. 간염의 징후와 증상이 나타나면 즉시 azithromycin 투여를 중단하십시오.
5.3 영아 비대성 유문 협착증(IHPS)
신생아(생후 42일까지 치료)에서 azithromycin 사용 후 IHPS가 보고되었습니다. 수유 시 구토 또는 과민성이 발생하면 의사에게 연락하도록 부모와 보호자에게 지시하십시오.
5.4 QT 연장
Azithromycin을 포함한 macrolide 계열 항생제 치료 시 심장 재분극 및 QT 간격 연장이 관찰되었으며, 이는 심장 부정맥 및 torsades de pointes를 유발할 위험이 있습니다. Azithromycin을 투여받은 환자에서 시판 후 조사 기간 동안 torsades de pointes 사례가 자발적으로 보고되었습니다. 의료진은 다음과 같은 고위험군에서 azithromycin의 위험과 이점을 고려할 때 치명적일 수 있는 QT 연장의 위험을 고려해야 합니다:
- QT 간격 연장, torsades de pointes 병력, 선천성 long QT 증후군, 서맥 부정맥 또는 조절되지 않은 심부전이 있는 환자
- QT 간격을 연장시키는 것으로 알려진 약물을 복용 중인 환자
- 저칼륨혈증이나 저마그네슘혈증과 같이 교정되지 않은 부정맥 유발 상태, 임상적으로 유의한 서맥, Class IA(quinidine, procainamide) 또는 Class III(dofetilide, amiodarone, sotalol) 항부정맥제를 투여받는 환자
5.5 심혈관계 사망
일부 관찰 연구에서 azithromycin에 노출된 성인은 amoxicillin을 포함한 다른 항생제에 비해 급성 심혈관 사망의 단기 잠재적 위험이 약 2배 증가한 것으로 나타났습니다. 이러한 연구에서 관찰된 5일 심혈관 사망률은 백만 명당 azithromycin 치료 과정 중 20~400건이었습니다. 이 잠재적 위험은 azithromycin 사용 첫 5일 동안 더 큰 것으로 나타났으며 기존 심혈관 질환이 있는 환자에게만 국한되는 것으로 보이지는 않습니다. 이러한 관찰 연구의 데이터는 급성 심혈관 사망과 azithromycin 사용 간의 인과 관계를 확립하거나 배제하기에 충분하지 않습니다. Azithromycin 처방 시 이러한 잠재적 위험과 치료 이점의 균형을 고려하십시오.
5.6 Clostridium difficile 관련 설사(CDAD)
CDAD는 azithromycin을 포함한 거의 모든 항균제 사용과 관련하여 보고되었으며, 경증 설사에서 치명적인 대장염에 이르기까지 다양한 중증도를 보일 수 있습니다. 항균제 치료는 대장의 정상 세균총을 변화시켜
C. difficile의 과증식을 초래합니다.
C. difficile은 CDAD 발생에 기여하는 독소 A와 B를 생성합니다. Hypertoxin
–을 생성하는
C. difficile 균주는 항균 요법에 불응성일 수 있고 대장 절제술이 필요할 수 있으므로 이러한 감염은 이환율과 사망률을 증가시킵니다. 항생제 사용 후 설사가 발생한 모든 환자에서 CDAD를 고려해야 합니다. CDAD는 항균제 투여 후 2개월 이상 지나서 발생한 것으로 보고되었기 때문에 주의 깊은 병력 청취가 필요합니다.
CDAD가 의심되거나 확인된 경우에는
C. difficile를 대상으로 하지 않는 항생제 사용을 중단해야 할 수 있습니다. 적절한 수액 및 전해질 관리, 단백질 보충,
C. difficile에 대한 항생제 치료, 임상적으로 필요한 경우 수술적 평가를 시행해야 합니다.
5.9 내성균 발생
입증되었거나 강력히 의심되는 세균 감염 또는 예방적 적응증이 없는 상태에서 azithromycin을 처방하는 것은 환자에게 이익을 제공할 가능성이 적고 내성균 발생의 위험을 증가시킵니다.
6 부작용 반응
- 과민성
[주의사항 참조 (5.1)]
- 간독성
[주의사항 참조 (5.2)]
- 유아기 비대성 유문협착증 (IHPS)
[주의사항 참조 (5.3)]
- QT 간격 연장
[주의사항 참조 (5.4)]
- 심혈관 사망
[주의사항 참조 (5.5)]
-
클로스트리디움 디피실 -연관된 설사 (CDAD)
[주의사항 참조 (5.6)]
- 근육약화증 악화
[주의사항 참조 (5.7)]
6.1 임상시험 경험
임상시험은 다양한 조건에서 수행되므로, 한 약물의 임상시험에서 관찰된 부작용 발생률은 다른 약물의 임상시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제 관찰된 발생률을 반영하지 않을 수 있습니다.
임상시험에서 보고된 대부분의 부작용은 경미하거나 중등도이며, 약물 중단 시 회복되었습니다. 다회 투여 임상시험에서 약물 관련 부작용으로 인해 약 0.7%의 환자가 아지스로마이신 치료를 중단했습니다. 중대한 부작용으로는 안지오테드마와 담즙색소증이 포함되었습니다. 중단을 유발한 대부분의 부작용은 위장관과 관련되었습니다. 예를 들어, 메스꺼움, 구토, 설사 또는 복통 등이 있었습니다.
[참조
다회 투여 요법
전반적으로, 아지스로마이신 다회 투여 요법을 받은 성인 환자에서 가장 흔한 부작용은 위장계와 관련이 있었으며, 설사/무른 대변 (5%), 메스꺼움 (3%), 복통 (3%)이 가장 자주 보고되었습니다.
1% 이하의 빈도로 발생한 다른 부작용은 다음과 같습니다:
심혈관: 두근거림과 흉통.
위장계: 소화불량, 가스, 구토, 검은 변, 담즙색소증.
비뇨생식계: 칸디다, 질염, 신우염.
신경계: 어지러움, 두통, 현기증, 졸음.
일반: 피로.
알레르기: 발진, 빛 과민성, 안지오테드마.
주 1200mg 요법으로 만성 치료
심각한 면역기능 저하를 가진 HIV 감염 환자에서
마이코박테리움 아비움 감염 예방을 위한 주 1200mg 투여 요법으로 관찰된 부작용은 단기 투여 요법과 유사했습니다.
[임상 연구 참조 (14)]
주 600mg 요법과 에탐부톨 병용으로 만성 치료
심각한 면역기능 저하를 가진 HIV 감염 환자에서
마이코박테리움 아비움 복합감염 치료를 위한 주 600mg 투여 요법으로 관찰된 부작용은 단기 투여 요법과 유사했습니다. 88명의 환자를 대상으로 한 중요한 임상시험에서 5%의 환자가 일시적인 청력 손상을 경험했습니다. 매크로라이드 계열 항생제는 특히 높은 용량에서 청력 손상이 보고되었습니다. 치료 기간 동안 5% 이상의 환자에서 발생한 다른 치료 관련 부작용은 다음과 같습니다: 복통 (14%), 메스꺼움 (14%), 구토 (13%), 설사 (12%), 가스 (5%), 두통 (5%), 시야 이상 (5%). 연구 약물과 관련된 랩 검사 이상 또는 부작용으로 인한 치료 중단은 88명 중 8명 (9.1%)에서 발생했습니다.
1그램 단회 투여 요법
1그램 아지스로마이신의 단회 투여 요법을 받은 환자에서 가장 흔한 부작용은 위장계와 관련되었으며, 다회 투여 요법을 받은 환자보다 더 자주 보고되었습니다.
1% 이상의 빈도로 발생한 다음과 같은 부작용이 1그램 아지스로마이신 단회 투여 요법을 받은 환자에서 보고되었습니다: 설사/무른 대변 (7%), 메스꺼움 (5%), 복통 (5%), 구토 (2%), 소화불량 (1%), 질염 (1%).
6.2 사후 임상 경험
아지스로마이신의 사후 승인 사용 중 보고된 다음의 부작용은 인구의 크기가 불확실한 인구에서 자발적으로 보고된 것이기 때문에 그 빈도를 신뢰할 수 없거나 약물 노출과 인과 관계를 확립하기 어려울 수 있습니다.
성인 및/또는 소아 환자에서 아지스로마이신과 관련하여 사후 임상시험 기간 동안 보고된 부작용은 다음과 같습니다:
알레르기: 관절통, 부종, 두드러기, 안지오테드마.
심혈관: 부정맥, 심실성 빈맥, 저혈압. QT 간격 연장,
토르사드 및 심혈관 사망이 보고되었습니다.
위장계: 식욕부진, 변비, 소화불량, 가스, 구토/설사, 가짜막성 대장염, 췌장염, 구강 칸디다, 유문협착증, 혀 변색.
일반: 피로, 저림현상, 피로, 불쾌감, 아나필락시스.
비뇨생식계: 신간질, 급성 신부전, 질염.
혈액형성계: 혈소판 감소.
간/담도: 간 기능 이상, 간염, 담즙색소증, 간괴사, 간부전,
[주의사항 참조 (5.2)]
.
신경계: 경련, 어지러움/현기증, 두통, 졸음, 과활동성, 초조함, 흥분 및 실신.
정신과: 공격적인 반응 및 불안감.
피부/부속기관: 가려움증 및 홍반다형증, AGEP, 스티븐스-존슨 증후군, 중독성 표피괴사 및 DRESS를 포함한 심각한 피부반응.
특수감각: 청력장애(청력 손실, 난청 및/또는 이명), 맛/냄새 변질 및/또는 손실에 대한 보고.
6.3 실험실 이상 반응
임상시험 중 발생한 유의한 이상 반응(약물 관련 여부와 관계없이)은 다음과 같이 보고되었습니다:
- 1~2%의 빈도로 고혈청 크레아틴 인산키나제, 칼륨, ALT(SGPT), GGT 및 AST(SGOT)의 상승.
- 1% 미만의 빈도로 백혈구 감소, 뉴트로필 감소, 혈소판 수 감소, 고혈청 알칼리성 인산효소, 빌리루빈, BUN, 크레아티닌, 혈당, LDH 및 인산염의 상승.
추적 관찰 시, 실험실 검사의 변화는 되돌릴 수 있는 것으로 나타났습니다.
3000명 이상의 환자를 대상으로 한 다회용량 임상시험에서, 3명의 환자가 치료와 관련된 간 효소 이상으로 인해 치료를 중단하였으며, 1명은 신기능 이상으로 인해 치료를 중단하였습니다.
정상 건강한 자원자를 대상으로 한 1상 약물 상호작용 연구에서, 아지트로마이신과 리파부틴을 병용 투여받은 6명 중 1명, 리파부틴 단독 투여받은 7명 중 1명, 아지트로마이신 단독 투여받은 6명 중 0명이 임상적으로 유의한 뉴트로필 감소(<500 cells/mm
3)를 경험하였습니다.
심각한 면역기능 저하 HIV 감염 환자에서 전이성
마이코박테리움 아비움 질환 예방을 위한 임상시험에서 관찰된 실험실 이상 반응입니다.
[14. 임상 연구 참조]
심각한 면역기능 저하 HIV 감염 환자에서 전이성 MAC 치료를 위해 아지트로마이신 600mg을 매일 에탐부톨과 병용하여 중요한 임상시험에서 기준치가 정상인 대상자의 5% 이상에서 실험실 이상 반응이 관찰되었습니다. 이러한 반응에는 절대성 중성구의 기준치 하한의 50% 이하로 감소(10/52, 19%) 및 알칼리성 인산효소의 상한치의 5배 증가(3/35, 9%)가 포함됩니다. 기준치가 정상인 대상자를 대상으로 한 중성구 감소(22/75, 29%) 및 알칼리성 인산효소 상승(16/80, 20%) 분석과 비교했을 때, 이러한 실험실 이상 반응의 인과관계는 연구 약물 사용과 연관성이 확립되지 않았습니다.
7 약물 상호 작용
7.1 Nelfinavir
Azithromycin 단회 경구 투여와 함께 nelfinavir를 steady-state로 병용투여하면 azithromycin 혈청 농도가 증가했습니다. Nelfinavir와 병용 투여 시 azithromycin 용량 조절은 권장되지 않지만, 간 효소 이상 및 청력 장애와 같은 azithromycin의 알려진 이상반응에 대한 면밀한 모니터링이 필요합니다.
[
이상반응 (6) 참조]
7.2 Warfarin
자발적인 시판 후 보고에 따르면 azithromycin과 warfarin의 전용 약물 상호작용 연구에서 prothrombin time이 영향을 받지 않았음에도 불구하고, azithromycin의 병용 투여가 warfarin과 같은 경구 항응고제의 효과를 증강시킬 수 있음을 시사합니다. 환자가 azithromycin과 경구 항응고제를 병용 투여받는 동안 prothrombin time을 주의 깊게 모니터링해야 합니다.
7.3 Macrolide와의 잠재적 약물-약물 상호 작용
Azithromycin의 임상시험에서 digoxin, colchicine 또는 phenytoin과의 상호작용은 보고되지 않았습니다. 잠재적 약물-약물 상호작용을 평가하기 위한 특정 약물 상호작용 연구는 수행되지 않았습니다. 그러나 다른 macrolide 제품에서 약물 상호작용이 관찰되었습니다. Digoxin, colchicine 또는 phenytoin을 azithromycin과 함께 사용할 때의 약물 상호작용에 관한 추가 데이터가 개발될 때까지 환자에 대한 주의 깊은 모니터링이 권고됩니다.
8 특정 집단에서의 사용
8.1 임신
임신한 여성에서 azithromycin 사용에 대한 수십 년간의 발표된 문헌 및 시판 후 경험에서 얻은 데이터는 주요 선천적 결손, 유산 또는 모체나 태아에 대한 부작용과 관련된 약물 관련 위험을 확인하지 못했습니다(
데이터 참조).
랫드, 마우스 및 토끼를 이용한 azithromycin의 발달 독성 연구에서는 체표면적을 기준으로 성인 1일 600mg 용량의 각각 3배, 2배 및 1배 용량에서 약물로 인한 태아 기형이 관찰되지 않았습니다. 임신 6일부터 이유 시까지 azithromycin을 투여한 임신 랫드의 자손에서 생존 능력 감소 및 발달 지연이 관찰되었으며, 이는 체표면적을 기준으로 성인 1일 600mg 용량의 3배에 해당하는 용량이었습니다(
데이터 참조).
적응증 집단에 대한 주요 선천적 결손 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 결손, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인지된 임신에서 주요 선천적 결손 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
데이터
인체 데이터
수십 년 동안 발표된 관찰 연구, 사례 시리즈 및 사례 보고에서 얻은 데이터는 임신한 여성에서 azithromycin 사용 시 주요 선천적 결손, 유산 또는 모체나 태아에 대한 부작용 위험 증가를 시사하지 않습니다. 이러한 데이터의 한계로는 무작위 배정의 부족과 기저 모체 질환 및 병용 투여 약물의 모체 사용과 같은 교란 요인을 통제할 수 없다는 점이 있습니다.
동물 데이터
기관형성기 동안 투여된 azithromycin은 최대 200mg/kg/day의 경구 용량에서 랫드 및 마우스에서 태아 기형을 유발하지 않았습니다(중등도의 모체 독성). 체표면적을 기준으로 이 용량은 성인 1일 600mg 용량의 약 3배(랫드) 및 2배(마우스)에 해당합니다. 기관형성기 동안 10, 20 및 40mg/kg/day의 경구 용량으로 azithromycin을 투여받은 토끼에서는 모든 군에서 모체 체중 감소 및 섭식 감소가 관찰되었습니다. 체표면적을 기준으로 성인 1일 600mg 용량과 거의 동등한 이 용량에서는 태아 독성이나 기형 발생의 증거가 관찰되지 않았습니다.
출생 전후 발달 연구에서 임신 6일부터 이유 시까지 50 또는 200mg/kg/day 용량으로 azithromycin을 경구 투여했습니다. 고용량에서 모체 독성(섭식 감소 및 체중 증가 감소, 분만 시 스트레스 증가)이 관찰되었습니다. 출생 후 발달 기간 동안 200mg/kg/day에서 자손에 대한 영향(생존 능력 감소, 발달 지표 지연)이 관찰되었습니다. 이러한 영향은 임신 15일부터 이유 시까지 최대 200mg/kg/day의 azithromycin을 경구 투여한 랫드의 출생 전후 연구에서는 관찰되지 않았습니다.
8.2 수유
위험 요약 Azithromycin은 모유에 존재합니다(
데이터 참조). 모체에 azithromycin 투여 후 모유 수유 영아에서 비중대한 이상반응이 보고되었습니다(
임상적 고려사항 참조). Azithromycin이 모유 생성에 미치는 영향에 대한 사용 가능한 데이터는 없습니다. 모유 수유의 발달 및 건강상 이점은 모체의 azithromycin에 대한 임상적 필요성 및 azithromycin 또는 기저 모체 상태로 인한 모유 수유 영아에 대한 잠재적 이상반응과 함께 고려되어야 합니다.
임상적 고려사항
모유 수유 영아에서 설사, 구토 또는 발진이 있는지 관찰하도록 여성에게 조언하십시오.
데이터
분만 중 2g의 azithromycin 단회 경구 투여 후 20명의 여성에서 azithromycin 모유 농도를 측정했습니다. 분만 후 3일 및 6일, 그리고 분만 후 2주 및 4주에 수집된 모유 검체는 투여 후 최대 4주까지 모유에 azithromycin이 존재함을 나타냈습니다. 다른 연구에서는 제왕절개를 위한 절개 전 8명의 여성에게 azithromycin 500mg을 단회 정맥 투여했습니다. 투여 후 12~48시간 사이에 얻은 모유(초유) 검체는 azithromycin이 투여 후 최대 48시간까지 모유에 지속됨을 나타냈습니다.
8.4 소아 사용
대조 임상 연구에서 azithromycin은 생후 6개월에서 12세 사이의 소아 환자에게 투여되었습니다. 소아 환자 치료에서 azithromycin 현탁액 사용에 관한 정보는
[
및
의 azithromycin 현탁액 100mg/5mL 및 200mg/5mL 병에 대한 처방 정보를 참조하십시오.
HIV 감염 소아 환자: HIV에 감염된 소아에서 MAC의 예방 또는 치료를 위한 azithromycin의 안전성과 유효성은 확립되지 않았습니다. 기회감염 치료를 위해 azithromycin을 투여받은 생후 5개월에서 18세(평균 7세)의 소아 72명에 대한 안전성 데이터가 있습니다. 평균 치료 기간은 242일(범위 3~2004일)이었으며 용량은 <1~52mg/kg/day(평균 12mg/kg/day)였습니다. 이상반응은 대부분 위장관 계통과 관련이 있었으며 성인 인구에서 관찰된 것과 유사했습니다. 치료와 관련된 가역적 청력 손상은 4명(5.6%)의 소아에서 관찰되었습니다. 2명(2.8%)의 소아는 이상반응으로 인해 조기에 치료를 중단했습니다. 1명은 요통으로 인해, 다른 1명은 복통, 열감 및 한기, 어지러움, 두통 및 무감각으로 인해 중단했습니다. 세 번째 소아는 실험실 이상(호산구 증가증)으로 인해 중단했습니다. 이러한 데이터의 기반이 되는 프로토콜은 azithromycin 10~20mg/kg/day(경구 및/또는 IV)의 1일 용량을 규정했습니다.
8.5 노인 사용
경구 azithromycin의 다회 투여 임상시험에서 환자의 9%(458/4949)가 65세 이상이었고 환자의 3%(144/4949)가 75세 이상이었습니다. 이러한 피험자와 젊은 피험자 사이에 전반적인 안전성이나 유효성의 차이는 관찰되지 않았으며, 보고된 다른 임상 경험에서 노인 환자와 젊은 환자 사이의 반응 차이가 확인되지 않았지만 일부 고령자의 민감도 증가를 배제할 수는 없습니다.
고령 환자는 젊은 환자에 비해 Torsades de pointes 부정맥 발생에 더 민감할 수 있습니다. [
경고 및 주의사항(5.4) 참조]
Azithromycin 600mg 정제에는 정제당 2.9mg의 나트륨이 함유되어 있습니다.
기회감염(MAC 질환 포함)이 있는 노인 환자: 65~94세 환자 30명을 대상으로 하여 >300mg/day 용량의 azithromycin으로 평균 207일 동안 치료한 안전성 데이터가 있습니다. 이 환자들은 MAC를 포함한 다양한 기회감염에 대해 치료를 받았습니다. 이상반응은 위장관계 및 가역적 청력 손상과 관련된 이상반응의 발생률이 더 높은 것을 제외하고는 일반적으로 젊은 환자에서 관찰된 것과 유사했습니다.
[
용법 및 용량(2) 참조]
10 과다 복용
권장량보다 높은 용량에서 경험한 이상반응은 정상 용량에서 관찰된 것과 유사했습니다. 과다 복용이 발생한 경우, 필요에 따라 일반적인 대증요법 및 지지요법이 권장됩니다.
11 설명
Azithromycin 정제, USP는 경구 투여용 macrolide 항균제인 azithromycin을 활성 성분으로 함유하고 있습니다. Azithromycin의 화학명은 (
2R,3S,4R,5R,8R,10R,11R,12S,13S,14R)-13-[(2,6-dideoxy-3-
C-methyl-3-
O-methyl-α
-L-ribo-hexopyranosyl)oxy]-2-ethyl-3,4,10-trihydroxy-3,5,6,8,10,12,14-heptamethyl-11-[[3,4,6-trideoxy-3-(dimethylamino)-β-
D-xylo-hexopyranosyl]oxy]-1-oxa-6-azacyclopentadecan-15-one입니다. Azithromycin은 erythromycin에서 유래되었지만, 화학적으로는 메틸기로 치환된 질소 원자가 lactone 고리에 결합되어 있다는 점에서 erythromycin과 다릅니다. 분자식은 C
38H
72N
2O
12이고 분자량은 749입니다. Azithromycin의 구조식은 다음과 같습니다:
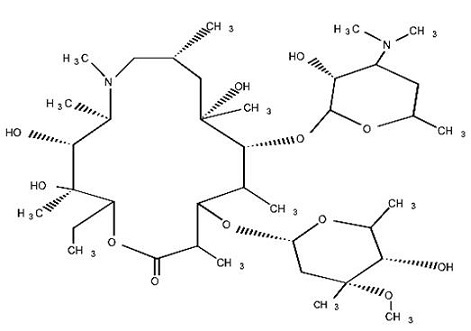
38H
72N
2O
12, 분자량 749의 흰색 무정형 분말입니다.
Azithromycin 정제, USP는 600mg 무수 azithromycin을 함유하는 흰색의 필름 코팅된 타원형 양면 볼록 정제로 경구 투여됩니다. 또한 각 정제에는 colloidal silicon dioxide, corn starch, croscarmellose sodium, hydroxypropyl cellulose, magnesium stearate, magnesium trisilicate, microcrystalline cellulose, sodium lauryl sulfate 및 hypromellose, polyethylene glycol, titanium dioxide로 구성된 수성 필름 코팅이 포함되어 있습니다.
12 약물동력학
12.2 약력학
감염 동물 모델에 근거할 때, 아지트로마이신의 항균 활성은 특정 병원체(
S. pneumoniae 및
S. aureus)에 대한 농도-시간 곡선 밑 면적과 최소억제농도의 비율(AUC/MIC)과 상관관계가 있는 것으로 보입니다. 임상시험에서 아지트로마이신의 임상적 및 미생물학적 치유와 가장 잘 관련된 주요 약력학/약동학 변수는 명확하지 않습니다.
심전기 생리학
116명의 건강한 대상자를 무작위 배정하여 위약 대조 평행 시험을 실시하여 QTc 간격 연장을 연구했습니다. 대상자들은 클로로퀸(1000 mg) 단독 또는 아지트로마이신(500 mg, 1000 mg 및 1500 mg 1일 1회 경구)과 병용하여 투여받았습니다. 아지트로마이신 병용 투여는 용량 및 농도 의존적으로 QTc 간격을 연장시켰습니다. 클로로퀸 단독 투여에 비해 500 mg, 1000 mg 및 1500 mg 아지트로마이신 병용 시 QTcF의 최대 평균(95% 상한 신뢰구간) 증가폭은 각각 5(10) ms, 7(12) ms 및 9(14) ms였습니다.
12.3 약동학
건강한 젊은 성인과 무증상 HIV 양성 성인(18~40세)에게 권장 라벨 용량으로 투여했을 때 혈장 내 아지트로마이신의 약동학 파라미터는 다음 표와 같습니다.
|
aAUC 0-24 ; b0-마지막. |
||||||||
| 투여량/제형 (혈청, 별도 표기가 없는 경우) |
대상 |
일차 |
C
max (mcg/mL) |
T
max (시간) |
C
24 (mcg/mL) |
AUC (mcg·hr/mL) |
T
1/2 (시간) |
요중 배설 (% 투여량) |
| 500 mg/250 mg 캡슐
|
12
|
1
|
0.41
|
2.5
|
0.05
|
2.6
a |
–
|
4.5
|
| 2~5일차 250 mg
|
12
|
5
|
0.24
|
3.2
|
0.05
|
2.1
a |
–
|
6.5
|
| 1200 mg/600 mg 정제
|
12
|
1
|
0.66
|
2.5
|
0.074
|
6.8
b |
40
|
–
|
| %CV
|
(62%)
|
(79%)
|
(49%)
|
(64%)
|
(33%)
|
|||
| 600 mg 정제/일
|
7
|
1
|
0.33
|
2
|
0.039
|
2.4
a |
||
| %CV
|
(25%)
|
(50%)
|
(36%)
|
(19%)
|
||||
| 7
|
22
|
0.55
|
2.1
|
0.14
|
5.8
a |
84.5
|
–
|
|
| %CV
|
(18%)
|
(52%)
|
(26%)
|
(25%)
|
–
|
|||
| 600 mg 정제/일 (백혈구)
|
7
|
22
|
252
|
10.9
|
146
|
4763
a |
82.8
|
–
|
| %CV
|
(49%)
|
(28%)
|
(33%)
|
(42%)
|
–
|
–
|
||
500 mg를 1일차에 1회 투여하고 2일부터 5일까지는 250 mg/일 투여하는 경우, C
min 및 C
max는 치료 2일부터 5일까지 거의 변화하지 않았습니다. 그러나 로딩용량 없이 아지트로마이신 C
min 농도는 안정 상태에 도달하기까지 5~7일이 소요되었습니다.
22일 동안 600 mg 아지트로마이신 정을 1일 1회 투여받은 비증상성 HIV 양성 성인 대상자에서 안정 상태의 아지트로마이신 혈중 농도는 투약 15일째에 도달하였습니다.
성인에서의 표준 안정 분포용적(31.1 L/kg) 및 혈장 클리어런스(630 mL/min)는 긴 반감기가 조직으로부터의 약물 흡수 및 방출로 인한 것으로 보입니다.
흡수
1그램 단일
–투여용 포장은 250 mg 아지트로마이신 캡슐 4정과 생물학적 동등함을 가지고 있습니다.
아지트로마이신 경구 액체가 음식과 함께 투여될 경우, C
max가 46% 증가하고 AUC가 14% 증가합니다.
600 mg 정 2정의 절대 생체이용률은 34% (CV=56%)입니다. 음식과 함께 600 mg 정 2정을 투여할 경우, C
max가 31% 증가하고 (CV=43%) 흡수의 범위(AUC)는 변경되지 않았습니다 (AUC 비율 평균=1; CV=55%).
분포
아지트로마이신의 혈장 단백 결합은 농도 범위에 따라 가변적이며, 0.02 mcg/mL에서 51%에서 2 mcg/mL에서 7%로 감소합니다. 아지트로마이신의 항균 활성은 pH에 관련이 있으며, pH가 낮아질수록 감소하는 것으로 보입니다. 그러나 조직으로의 약물 분포는 임상적인 활동과 관련이 있을 수 있습니다.
아지트로마이신은 피부, 폐, 편도 및 자궁을 포함한 인체 조직으로 침투하는 것으로 확인되었습니다. 추가 조직 및 체액 (뼈, 정액, 전립선, 난소, 자궁, 난관, 위, 간 및 담낭)의 조사로 광범위한 조직 분포가 확인되었습니다. 이러한 추가 부위에서의 감염에 대한 아지트로마이신 치료에 대한 충분하고 잘 통제된 연구 자료가 없으므로, 이러한 조직 농도 자료의 임상적 중요성은 알려져 있지 않습니다.
아지트로마이신은 세포포식세포 및 섬유아세포에 농축되는 것으로
in vitro 배양 기법을 통해 입증되었습니다. 이러한 방법을 사용하여, 세포 내외 농도 비율은 1시간의 배양 후에 30 이상이었습니다.
In vivo 연구에서는 포식세포 내 농도가 염증 조직으로의 약물 분포에 기여할 수 있음을 시사합니다.
단일 1200 mg 투여 (2정 600 mg) 후 경구 투여 시, 말초 백혈구에서의 평균 최대 농도는 140 mcg/mL이었습니다. 농도는 약 60시간 동안 32 mcg/mL 이상 유지되었습니다. 6명의 남성과 6명의 여성의 평균 반감기는 각각 34시간과 57시간이었습니다. 남성과 여성의 백혈구 대혈장 C
max 비율은 각각 258 (±77%) 및 175 (±60%)이었으며, AUC 비율은 각각 804 (±31%) 및 541 (±28%)이었습니다. 이러한 결과의 임상적 중요성은 알려져 있지 않습니다. 비증상성 HIV 양성 성인에게 600 mg (1정/일)의 다량 일일 투여 후 말초 백혈구에서의 평균 최대 농도는 252 mcg/mL (±49%)이었습니다. 안정 상태에서의 말초 백혈구의 최저 농도는 146 mcg/mL (±33%)이었습니다. 백혈구 대혈장 C
max 비율의 평균은 456 (±38%)이었으며, 백혈구 대혈장 AUC 비율의 평균은 816 (±31%)이었습니다. 이러한 결과의 임상적 중요성은 알려져 있지 않습니다.
대사
in vitro 및
in vivo 아지트로마이신의 대사를 평가하기 위한 연구는 수행되지 않았습니다.
배설
단일 500 mg 경구 및 정맥 투여 후의 아지트로마이신의 혈장 농도는 다상성 양상으로 감소하여 평균 말기 반감기는 68시간입니다. 담즙 배설은 변하지 않은 약물로 주로 이루어지며, 투여량의 약 6%가 변하지 않은 약물로서 소변에 나타납니다.
특정 인구군
신장 기능 장애 환자
다양한 정도의 신장 기능 장애를 가진 42명의 성인 (21세에서 85세)에서 아지트로마이신 약동학을 조사하였습니다. 1 g 아지트로마이신 (4 × 250 mg 캡슐)의 경구 투여 후, GFR이 10에서 80 mL/min인 대상자에서는 정상 신기능 (GFR >80 mL/min)을 가진 대상자와 비교하여 평균 C
max 및 AUC
0-120가 각각 5.1% 및 4.2% 증가하였습니다. 말기 신장 질환 (GFR <10 mL/min)을 가진 대상자에서는 평균 C
max 및 AUC
0-120가 각각 61% 및 35% 증가하였습니다. 이러한 결과의 임상적 중요성은 알려져 있지 않습니다.
간 기능 장애 환자
간 기능 장애 환자에서의 아지트로마이신 약동학은 확립되지 않았습니다.
남성 및 여성 환자
아지트로마이신의 배설은 남성과 여성 환자 사이에서 유의한 차이가 없습니다. 성별에 따른 용량 조절은 권장되지 않습니다.
노인 환자
5일 치료 요법에서, 노인 자원자(65세에서 85세)의 약동학 매개변수는 젊은 자원자(18세에서 40세)와 유사했습니다. 이 용량 요법으로 치료를 받는 정상 신장 및 간 기능을 가진 노인 환자에게 용량 조절이 필요하지 않은 것으로 보입니다.
[노인 사용 (8.5) 참조]
소아 환자
소아 환자에서 구강용 아지스로마이신의 약동학에 대한 정보는 아지스로마이신 구강용 혼합액 100 mg/5 mL 및 200 mg/5 mL 병에 대한 처방 정보를 참조하십시오.
약물 상호작용 연구
아지스로마이신과 공동 투여될 가능성이 있는 다른 약물과의 약물 상호작용 연구가 수행되었습니다. 아지스로마이신의 공동 투여가 다른 약물의 약동학에 미치는 영향은 표 1에 나와 있으며, 다른 약물이 아지스로마이신의 약동학에 미치는 영향은 표 2에 나와 있습니다.
치료용 용량으로 아지스로마이신을 공동 투여한 경우, 표 1에 나열된 약물의 약동학에는 약간의 영향이 있었습니다. 표 1에 나열된 약물은 아지스로마이신과 공동 투여할 때 용량 조절이 권장되지 않습니다.
아지스로마이신을 에파비렌츠 또는 플루코나졸과 공동 투여한 경우, 아지스로마이신의 약동학에 약간의 영향이 있었습니다. 넬피나비르는 아지스로마이신의 C
max 및 AUC를 유의하게 증가시켰습니다. 표 2에 나열된 약물과 함께 투여할 때 아지스로마이신의 용량 조절이 권장되지 않습니다.
[약물 상호작용 (7.3) 참조]
|
*-90% 신뢰구간은 보고되지 않음 12 임상 약리학 |
|||||
| 병용 투여된 약물 |
병용 투여된 약물의 용량 |
아지스로마이신의 용량 |
n | 병용 투여된 약물의 약동학 파라미터의 아지스로마이신 병용/단독 투여 비율 (90% CI); 무영향 = 1 |
|
| 평균 Cmax | 평균 AUC | ||||
| 아토르바스타틴 | 8일 동안 하루 10mg |
6~8일차에 하루 500mg 경구 투여 |
12 | 0.83 (0.63 – 1.08) | 1.01 (0.81 – 1.25) |
| 카르바마제핀 | 2일간 하루 200mg, 그 후 18일간 하루 400mg |
16~18일차에 하루 500mg 경구 투여 |
7 | 0.97 (0.88 – 1.06) | 0.96 (0.88 – 1.06) |
| 세티리진 | 11일간 하루 20mg | 7일차 500mg 경구, 8~11일차 하루 250mg 경구 투여 |
14 | 1.03 (0.93 – 1.14) | 1.02 (0.92 – 1.13) |
| 디다노신 | 21일간 하루 2회 200mg 경구 |
8~21일차 하루 1,200mg 경구 투여 |
6 | 1.44 (0.85 – 2.43) | 1.14 (0.83 – 1.57) |
| 에파비렌즈 | 7일간 하루 400mg | 7일차 600mg 경구 투여 | 14 | 1.04* | 0.95* |
| 플루코나졸 | 1회 200mg 경구 | 1회 1,200mg 경구 투여 | 18 | 1.04 (0.98 – 1.11) | 1.01 (0.97 – 1.05) |
| 인디나비르 | 5일간 하루 3회 800mg 투여 |
5일차 1,200mg 경구 투여 |
18 | 0.96 (0.86 – 1.08) | 0.90 (0.81 – 1) |
| 미다졸람 | 3일차 15mg 경구 | 3일간 하루 500mg 경구 투여 |
12 | 1.27 (0.89 – 1.81) | 1.26 (1.01 – 1.56) |
| 넬피나비르 | 11일간 하루 3회 750mg 투여 |
9일차 1,200mg 경구 투여 |
14 | 0.90 (0.81 – 1.01) | 0.85 (0.78 – 0.93) |
| 실데나필 | |||||
| 라니티딘
|
1일차와 4일차에 100mg
|
3일 동안 하루에 500mg 경구 투여
|
12
|
1.16 (0.86 ~ 1.57)
|
0.92 (0.75 ~ 1.12)
|
| 테오필린
|
1일차, 11일차, 25일차에 4mg/kg IV 투여
|
7일차에 500mg 경구 투여, 8일차부터 11일차까지 하루에 250mg 경구 투여
|
10
|
1.19 (1.02 ~ 1.40)
|
1.02 (0.86 ~ 1.22)
|
| 테오필린
|
15일 동안 하루에 300mg 경구 투여 2회
|
6일차에 500mg 경구 투여, 7일차부터 10일차까지 하루에 250mg 경구 투여
|
8
|
1.09 (0.92 ~ 1.29)
|
1.08 (0.89 ~ 1.31)
|
| 트리아졸람
|
2일차에 0.125mg
|
1일차에 500mg 경구 투여, 2일차에 하루에 250mg 경구 투여
|
12
|
1.06*
|
1.02*
|
| 트리메토프림/설파메톡사졸
|
7일 동안 하루에 160mg/800mg 경구 투여
|
7일차에 1,200mg 경구 투여
|
12
|
0.85 (0.75 ~ 0.97) / 0.90 (0.78 ~ 1.03)
|
0.87 (0.80 ~ 0.95) / 0.96 (0.88 ~ 1.03)
|
| 지도부딘
|
21일 동안 하루에 500mg 경구 투여
|
14일 동안 하루에 600mg 경구 투여
|
5
|
1.12 (0.42 ~ 3.02)
|
0.94 (0.52 ~ 1.70)
|
| 지도부딘
|
21일 동안 하루에 500mg 경구 투여
|
14일 동안 하루에 1,200mg 경구 투여
|
4
|
1.31 (0.43 ~ 3.97)
|
1.30 (0.69 ~ 2.43)
|
|
* 90% 신뢰구간이 보고되지 않음 |
|||||
| 병용 투여 약물 |
병용 투여 약물의 용량 |
아지스로마이신 용량 |
n |
병용 약물 유무에 따른 아지스로마이신 약동학 파라미터 비율 (90% CI); 영향 없음 = 1 |
|
| 평균 C
max |
평균 AUC |
||||
| 에파비렌즈
|
7일간 하루 400mg
|
7일째 600mg 경구 투여
|
14
|
1.22
(1.04 ~ 1.42)
|
0.92*
|
| 플루코나졸
|
단회 경구 200mg
|
단회 경구 1,200mg
|
18
|
0.82
(0.66 ~ 1.02)
|
1.07
(0.94 ~ 1.22)
|
| 넬피나비르
|
11일간 하루 3회 750mg
|
9일째 1,200mg 경구 투여
|
14
|
2.36
(1.77 ~ 3.15)
|
2.12
(1.80 ~ 2.50)
|
12.4 미생물학
아지스로마이신은 감수성 미생물의 50S 리보솜 소단위체 23S rRNA에 결합하여 세균 단백질 합성을 억제하고 50S 리보솜 소단위체의 조립을 방해한다.
내성
아지스로마이신 내성에 가장 많이 관여하는 기전은 23S rRNA 표적 부위의 변형, 특히 메틸화이다. 리보솜 변형은 다른 마크로라이드계, 린코사마이드계, 스트렙토그라민 B (MLS
B 표현형)에 대한 교차내성을 초래할 수 있다.
Mycobacterium avium 복합체 균주의 획득된 돌연변이 내성 기전 (즉, 23S rRNA 유전자 돌연변이)은 클래리스로마이신과 아지스로마이신 모두에서 동일하다.
항균 활성
아지스로마이신은
in vitro와 실제 감염 모두에서 다음 미생물에 대해 활성을 나타내는 것으로 확인되었다. [
사용 지침 (1) 참조]
마이코박테리아
Mycobacterium avium 복합체 (MAC):
Mycobacterium avium
Mycobacterium intracellulare
기타 미생물
Chlamydia trachomatis
감수성 검사
이 약물에 대한 감수성 검사 판정 기준, 관련 검사 방법 및 FDA 인정 품질 관리 기준에 관한 구체적인 정보는 https://www.fda.gov/STIC를 참고하십시오.
13 비임상 독성학
13.1 발암성, 변이원성, 생식능력 장애
발암 가능성을 평가하기 위한 동물에서의 장기 연구는 수행되지 않았습니다. Azithromycin은 표준 실험실 검사(마우스 림프종 분석, 인간 림프구 clastogenic 분석, 마우스 골수 clastogenic 분석)에서 변이원성 가능성을 보이지 않았습니다. 수컷 및 암컷 랫드에서 수행된 생식능력 연구에서, azithromycin을 교미 전 64~66일(수컷) 또는 15일(암컷) 동안 경구 투여하고 교미 중에도 투여한 결과, 수컷과 암컷 모두 azithromycin 20 및 30 mg/kg/day 용량에서 임신율 감소가 나타났습니다. 임신율에 대한 이 최소한의 영향(동시 대조군과 비교하여 약 12% 감소)은 용량을 20에서 30 mg/kg/day로 증가시켰을 때 더 뚜렷해지지 않았으며(체표면적을 기준으로 성인 1일 600 mg 용량의 약 0.3~0.5배), 교배된 쌍에서 한 동물만 azithromycin으로 처리된 경우에는 관찰되지 않았습니다. 다른 모든 생식 매개변수에는 영향이 없었으며 10 mg/kg/day에서는 생식능력에 영향이 없었습니다. 처방 정보에서 권장되는 용량 및 기간으로 azithromycin 치료를 받는 환자에 대한 이러한 연구 결과의 연관성은 불확실합니다.
13.2 동물 독성학
Phospholipidosis(세포 내 인지질 축적)가 azithromycin을 여러 번 투여한 마우스, 랫드 및 개의 일부 조직에서 관찰되었습니다. 이는 체표면적을 기준으로 가장 높은 성인 권장용량과 유사하거나 낮은 용량의 azithromycin으로 치료된 개와 랫드의 많은 장기 계통(예: 눈, 등쪽 신경근, 간, 담낭, 신장, 비장 및/또는 췌장)에서 입증되었습니다. 이 효과는 azithromycin 치료 중단 후 가역적인 것으로 나타났습니다. 약동학 데이터에 기준하여, phospholipidosis는 랫드(50 mg/kg/day 용량)에서 관찰된 최대 혈장 농도 1.3 mcg/mL(성인 2 g 용량에서 관찰된 C
max 0.821 mcg/mL의 1.6배)에서 관찰되었습니다. 유사하게, 개(10 mg/kg/day 용량)에서는 관찰된 최대 혈청 농도 1 mcg/mL(성인 2 g 용량에서 관찰된 C
max 0.821 mcg/mL의 1.2배)에서 나타났습니다.
Phospholipidosis는 또한 18일 동안 30 mg/kg/day 용량으로 투여한 신생 랫드에서도 관찰되었는데, 이는 표면적을 기준으로 한 소아 용량 60 mg/kg보다 낮은 수준입니다. 평균 최대 혈청 농도가 1.86 mcg/mL인 40 mg/kg/day 용량으로 10일 동안 치료한 신생 랫드에서는 관찰되지 않았는데, 이는 소아 용량에서의 C
max 1.27 mcg/mL의 약 1.5배입니다. Phospholipidosis는 최대 평균 전혈 농도가 3.54 mcg/mL인 신생 개(10 mg/kg/day)에서 관찰되었는데, 이는 소아 용량 C
max의 약 3배입니다.
동물과 인간에 대한 이 연구 결과의 의의는 알려져 있지 않습니다.
14 CLINICAL STUDIES
14.1 임상 연구: 진행성 HIV 감염 환자에서 박테로이드 복합 감염증의 예방 및 치료
사용 지침 (1)을 참조하십시오]
박테로이드 복합 감염증의 예방
CD4 수치가 100 cells/µL 미만인 환자를 대상으로 한 두 개의 무작위 배정, 이중 맹검 임상시험이 수행되었습니다. 첫 번째 시험(155 연구)에서는 아지스로마이신(1회 주 1200mg)과 위약을 비교했으며, 평균 CD4 수치가 35 cells/mcgL인 182명의 환자가 등록되었습니다. 두 번째 시험(174 연구)에서는 723명의 환자를 아지스로마이신(1회 주 1200mg), 리파부틴(1일 300mg) 또는 두 약물 병용군으로 무작위 배정하였습니다. 평균 CD4 수치는 51 cells/mcgL였습니다. 이 시험의 주요 평가변수는 박테로이드 복합 감염증의 발생이었습니다. 다른 평가변수에는 임상적으로 유의한 박테로이드 복합 감염증의 발생과 약물 관련 부작용으로 인한 투약 중단이 포함되었습니다.
박테로이드 균혈증
155 연구에서 아지스로마이신군 85명, 위약군 89명의 환자가 등록 기준을 만족했습니다. 6, 12, 18개월 시점에서의 누적 발생률은 다음 표와 같습니다.
| 누적 발생률, %: 위약군(n=89) |
||||
| 개월 |
박테로이드 무발생, 생존 |
박테로이드 복합 감염증 |
이상반응 |
추적 불가 |
| 6
|
69.7
|
13.5
|
6.7
|
10.1
|
| 12
|
47.2
|
19.1
|
15.7
|
18
|
| 18
|
37.1
|
22.5
|
18
|
22.5
|
| 누적 발생률, %: 아지스로마이신군(n=85) |
||||
| 개월 |
박테로이드 무발생, 생존 |
박테로이드 복합 감염증 |
이상반응 |
추적 불가 |
| 6
|
84.7
|
3.5
|
9.4
|
2.4
|
| 12
|
63.5
|
8.2
|
16.5
|
11.8
|
| 18
|
44.7
|
11.8
|
25.9
|
17.6
|
1년 시점에서 박테로이드 복합 감염증의 누적 발생률 차이(위약군 – 아지스로마이신군)는 10.9%입니다. 이 차이는 통계적으로 유의하며(p=0.037), 95% 신뢰구간은 0.8%-20.9%입니다. 이상반응 발생 환자 수가 비슷하고 추적 불가 환자 수가 아지스로마이신군에서 적은 점을 고려해야 합니다.
174 연구에서 리파부틴군 223명, 아지스로마이신군 223명, 리파부틴+아지스로마이신 병용군 218명의 환자가 등록 기준을 만족했습니다. 6, 12, 18개월 시점에서의 누적 발생률은 다음 표와 같습니다.
| 누적 발생률, %: 리파부틴(n=223) |
||||
| 월 |
MAC 없음 및 생존 |
MAC |
이상반응 |
추적 상실 |
| 6
|
83.4
|
7.2
|
8.1
|
1.3
|
| 12
|
60.1
|
15.2
|
16.1
|
8.5
|
| 18
|
40.8
|
21.5
|
24.2
|
13.5
|
| 누적 발생률, %: 아지스로마이신(n=223) |
||||
| 월 |
MAC 없음 및 생존 |
MAC |
이상반응 |
추적 상실 |
| 6
|
85.2
|
3.6
|
5.8
|
5.4
|
| 12
|
65.5
|
7.6
|
16.1
|
10.8
|
| 18
|
45.3
|
12.1
|
23.8
|
18.8
|
| 누적 발생률, %: 아지스로마이신/리파부틴 병용(n=218) |
||||
| 월 |
MAC 없음 및 생존 |
MAC |
이상반응 |
추적 상실 |
| 6
|
89.4
|
1.8
|
5.5
|
3.2
|
| 12
|
71.6
|
2.8
|
15.1
|
10.6
|
| 18
|
49.1
|
6.4
|
29.4
|
15.1
|
1년 누적 발생률을 비교했을 때, 아지스로마이신 단독요법은 적어도 리파부틴 단독요법만큼 효과적입니다. 두 요법의 1년 발생률 차이(7.6%)는 통계적으로 유의하며(p=0.022) 조정된 95% 신뢰구간은 0.9~14.3%입니다. 또한 아지스로마이신/리파부틴 병용요법은 리파부틴 단독요법보다 효과적입니다. 1년 누적 발생률 차이(12.5%)는 통계적으로 유의하며(p<0.001) 조정된 95% 신뢰구간은 6.6~18.4%입니다. 이상반응 경험 환자 수가 비슷하고 리파부틴군에서 추적 상실 환자 수가 적다는 점을 고려하여 이 차이의 의미를 해석해야 합니다.
스터디 174에서는 아지트로마이신, 리파부틴 또는 조합에 무작위로 할당된 대상자들로부터 모든 가능한 MAC 분리체에 대한 감수성 검사를 수행했습니다. 균주 격파 분리체에 대한 아지트로마이신의 MIC 값 분포는 임상 시험군 간에 유사했습니다. 전이성 MAC 치료에서 아지트로마이신의 효능이 확립되지 않았으므로, 이러한 in vitro MIC 값이 감수성 또는 내성의 지표로서의 임상적 중요성은 알려져 있지 않습니다.
임상적으로 중요한 전이성 MAC 질환
혈증 발생률 감소와 관련하여, 아지트로마이신 단독 또는 리파부틴과 조합하여 무작위로 할당된 그룹의 환자들은 열이나 야간 땀, 체중 감소 및 빈혈 등 전이성 MAC 질환의 증상과 징후에서 감소를 보였습니다.
약물 관련 부작용으로 인한 치료 중단
스터디 155에서, 아지트로마이신을 투여받은 대상자 중 8.2%가 약물 관련 독성으로 인해 치료를 중단하였으며, 플라시보를 투여받은 대상자 중 2.3%가 치료를 중단하였습니다 (p=0.121). 스터디 174에서는 아지트로마이신과 리파부틴의 조합에서 치료 중단이 더 많이 발생하였습니다 (22.7%) 아지트로마이신 단독 (13.5%; p=0.026) 또는 리파부틴 단독 (15.9%; p=0.209)에 비해.
안전성
고도의 HIV 질환을 가진 이러한 환자들은 다양한 동반 약물을 복용하고 다양한 동반 질환을 겪었기 때문에 연구 약물에 부작용을 연결하기가 어려웠습니다. 전반적으로, 고도의 HIV 질환을 가진 환자들에게 약 1년 동안 주간 용량 요법으로 아지트로마이신을 투여한 경우, 이전에 보고된 단기 요법에 대한 부작용과 유사한 부작용이 관찰되었습니다.
|
a 연구 약물과 가능성이 있는 관련이 있는 반응을 포함합니다. |
|||||
|
b HIV 감염 환자에서 전이성 MAC 예방을 받는 그룹에서 2% 이상의 부작용 발생률 (안질환 제외) |
1200 mg 주 1회
(N=89)
1200 mg 주 1회
(N=233)
300 mg 1일 1회
(N=236)
리파부틴 (N=224)
감소
아지스로마이신을 투여받은 환자에서 위장관 이상반응이 위약 또는 리파부틴을 투여받은 환자보다 더 자주 발생했다. 174 연구에서 설사 발생의 86%가 경증에서 중등증 수준이었으며, 이 이유로 치료를 중단한 경우는 233명 중 단지 9명(3.8%)에 불과했다.
검사실 수치 변화
이 후기 HIV 감염 면역저하 환자들에게서는 기저치가 정상 범위를 벗어났을 경우 임상시험 중 발생한 검사실 이상치를 추가 기준에 따라 평가할 필요가 있었다.
|
a 기저치에서 정상 범위를 벗어난 대상은 제외 |
|||||||||
|
b 정상 상한치 |
|||||||||
| 위약 |
아지스로마이신 1200 mg 주 1회 |
리파부틴 300 mg 1일 1회 |
아지스로마이신 & 리파부틴 |
||||||
| 혈색소
|
<8 g/dL
|
1/51
|
2%
|
4/170
|
2%
|
4/114
|
4%
|
8/107
|
8%
|
| 혈소판 수
|
<50 × 10
3/mm 3 |
1/71
|
1%
|
4/260
|
2%
|
2/182
|
1%
|
6/181
|
3%
|
| 백혈구 수
|
<1 × 10
3/mm 3 |
0/8
|
0%
|
2/70
|
3%
|
2/47
|
4%
|
0/43
|
0%
|
| 호중구
|
<500/mm
3 |
0/26
|
0%
|
4/106
|
4%
|
3/82
|
4%
|
2/78
|
3%
|
| SGOT
|
>5 × ULN
b |
1/41
|
2%
|
8/158
|
5%
|
3/121
|
3%
|
6/114
|
5%
|
| SGPT
|
>5 × ULN
|
0/49
|
0%
|
8/166
|
5%
|
3/130
|
2%
|
5/117
|
4%
|
| 알칼리성 인산가수분해 효소
|
>5 × ULN
|
1/80
|
1%
|
4/247
|
2%
|
2/172
|
1%
|
3/164
|
2%
|
본 무작위, 이중 맹검 임상 시험(연구 189)은 파종성 MAC 환자를 대상으로 수행되었다. 이 시험에서 파종성 MAC을 가진 246명의 HIV 감염 환자는 아지스로마이신 250 mg 1일 1회(N=65), 아지스로마이신 600 mg 1일 1회(N=91) 또는 클래리스로마이신 500 mg 1일 2회(N=90)를 에탐부톨 15 mg/kg 1일 1회와 함께 24주 동안 투여받았다. 혈액배양 및 임상평가는 12주차까지 3주마다, 이후 24주차까지 매월 수행되었다. 24주 이후, 환자들은 연구자의 재량에 따라 공개 라벨 요법으로 전환되었고 시험의 마지막 추적 방문까지 3개월마다 추적 관찰되었다. 환자들은 기준시점부터 최대 3.7년(중앙값: 9개월) 동안 추적 관찰되었다. 치료 중 또는 치료 후 회복된 MAC 분리주는 가능한 한 획득되었다.
일차 평가변수는 24주차까지의 무균화였다. 무균화는 중앙 실험실의 데이터를 기반으로 하였으며, 두 번의 음성 관찰 사이에 누락된 배양 데이터와 무관하게 MAC에 대해 연속적으로 관찰된 두 번의 음성 혈액배양으로 정의되었다. 분석은 MAC에 대해 양성 기준시점 배양을 가진 모든 무작위 배정 환자에서 수행되었다.
아지스로마이신 250 mg 군은 12주차에 수행된 중간 분석에서 클래리스로마이신 500 mg 1일 2회 투여 대비 유의하게 낮은 균혈증 제거율을 보여 중단되었다. 아지스로마이신 600 mg 1일 1회 및 클래리스로마이신 500 mg 1일 2회 치료요법에 대한 유효성 결과는 다음 표에 기술되어 있다:
|
a 제거율 차이(아지스로마이신-클래리스로마이신)에 대한 [95% 신뢰구간] |
|||
|
b 일차 평가변수 |
|||
| 에탐부톨과 아지스로마이신 600 mg 1일 1회 또는 클래리스로마이신 500 mg 1일 2회 투여 환자의 치료 반응 |
|||
| 아지스로마이신 600 mg 1일 1회 |
클래리스로마이신 500 mg 1일 2회 |
a 차이에 대한 95.1% CI |
|
| 기준시점에 배양 양성 환자
|
68
|
57
|
|
| 24주차
|
|||
| 두 번의 연속적 음성 혈액
배양 b |
31/68 (46%)
|
32/57 (56%)
|
[-28, 7]
|
| 사망률
|
16/68 (24%)
|
15/57 (26%)
|
[-18, 13]
|
일차 평가변수인 24주차 혈액배양 무균화율(두 번의 연속적 음성 배양)은 아지스로마이신 600 mg 1일 1회 군이 클래리스로마이신 500 mg 1일 2회 군보다 낮았다.
기준시점 집락수에 따른 무균화
두 치료군 모두에서 24주차 무균화율은 MAC cfu/mL 범위가 증가함에 따라 감소하였다.
| 아지트로마이신 600mg (N=68) |
클라리트로마이신 500mg 하루 2회 (N=57) |
|
| 기저 시점의 MAC 집락 수에 따라 계층화된 그룹 |
24주 차에 해당 계층에서 균음전자의 비율 |
24주 차에 해당 계층에서 균음전자의 비율 |
| ≤10 cfu/mL |
10/15 (66.7%) |
12/17 (70.6%) |
| 11 ~ 100 cfu/mL |
13/28 (46.4%) |
13/19 (68.4%) |
| 101 ~ 1,000 cfu/mL |
7/19 (36.8%) |
5/13 (38.5%) |
| 1,001 ~ 10,000 cfu/mL |
1/5 (20%) |
1/5 (20%) |
| >10,000 cfu/mL |
0/1 (0%) |
1/3 (33.3%) |
치료 시작 시점, 치료 중단 시점 또는 치료 후 추적관찰 중에 회복된 MAC 분리주에 대해 감수성 검사를 실시했다. T100 방사능 측정 육액법을 사용하여 아지트로마이신 및 클라리트로마이신의 MIC 값을 결정했다. 아지트로마이신 MIC 값은 <4 ~ >256 mcg/mL 범위였고, 클라리트로마이신 MIC 값은 <1 ~ >32 mcg/mL 범위였다. 개별 MAC 감수성 결과에서 아지트로마이신 MIC 값이 클라리트로마이신 MIC 값보다 4배에서 32배 더 높을 수 있음을 보여주었다.
연구 189에서 치료 중 및 최대 3.7년(중앙값: 9개월)간의 치료 후 추적관찰 기간 동안, 아지트로마이신 600mg 1일 1회 투여군의 6/68명(9%)과 클라리트로마이신 500mg 1일 2회 투여군의 6/57명(11%)에서 MIC 값이 급격히 증가한 MAC 혈액 배양 분리주가 발견되었다. 이 12개 MAC 분리주 모두 아지트로마이신 MIC ≥256 mcg/mL 및 클라리트로마이신 MIC >32 mcg/mL를 보였다. 이렇게 높은 MIC 값은 내성 발현을 시사한다. 그러나 현재까지 어느 macrolide에 대해서도 MAC 감수성 분리주와 내성 분리주를 구분할 수 있는 특정 기준값은 설정되지 않았다.
15 참고 문헌
- Griffith DE, Aksamit T, Brown-Elliot BA, et al. An official ATS/IDSA statement: Diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases.
Am J Respir Crit Care Med. 2007; 175:367-416.
16 제공/보관 및 취급 방법
Azithromycin 정제 USP, 600 mg은 한 면에 W962가 양각되어 있고 다른 면은 무지의 백색 필름코팅 타원형 양면이 볼록한 정제로 제공되며, anhydrous azithromycin 600 mg을 함유하고 있습니다. 포장 형태는 다음과 같습니다:
30정들이 병: NDC 64679-962-01
20° ~ 25°C (68° ~ 77°F)에서 보관하십시오. [USP Controlled Room Temperature 참조].
17 환자 상담 정보
Azithromycin 정제는 식사와 함께 또는 식사 없이 복용할 수 있습니다. 그러나 정제를 음식과 함께 복용할 때 내약성이 증가한 것으로 관찰되었습니다.
또한 환자는 알루미늄 및 마그네슘 함유 제산제와 azithromycin을 동시에 복용하지 않도록 주의해야 합니다.
알레르기 반응의 징후가 나타나면 즉시 azithromycin 복용을 중단하고 의사와 상담하도록 환자에게 지시해야 합니다.
영아에게 구토와 수유 시 과민 반응이 발생하면 부모나 보호자에게 의사와 상담하도록 지시합니다.
Azithromycin 정제를 포함한 항균제는 세균 감염 치료에만 사용해야 한다고 환자에게 상담해야 합니다. 항균제는 바이러스 감염(예: 일반 감기)을 치료하지 않습니다. Azithromycin 정제가 세균 감염 치료를 위해 처방될 때, 치료 초기에 느낌이 좋아지는 것이 일반적이지만 지시대로 정확히 약을 복용해야 한다고 환자에게 알려야 합니다. 복용량을 건너뛰거나 치료 과정을 완료하지 않으면 (1) 즉각적인 치료 효과가 감소하고 (2) 세균이 내성을 갖게 되어 향후 azithromycin 정제 또는 다른 항균제로 치료할 수 없게 될 가능성이 높아집니다.
설사는 항균제로 인한 흔한 문제로 보통 항균제 중단 시 종료됩니다. 때로는 항균제 치료를 시작한 후, 마지막 항균제 복용 후 2개월 이상 지난 시점에도 환자에게 물 설사와 혈변(복부 경련 및 발열 동반 또는 동반하지 않음)이 나타날 수 있습니다. 이런 경우 환자는 가능한 한 빨리 의사와 상담해야 합니다.
처방전 전용
Vivimed Life Sciences Private Limited
Plot No. 101, 102, 107 & 108,
SIDCO Pharmaceutical Complex,
Alathur, Kanchipuram-603110,
Tamilnadu, India.
유통사:
Wockhardt USA LLC.
20 Waterview Blvd.
Parsippany, NJ 07054
USA.
Rev.191121
패키지 라벨.주요 표시 패널
GENERIC: Azithromycin
DOSAGE: Film-coated Tablets, USP
ADMINSTRATION: Oral
NDC: 64679-962-01
STRENGTH: 600 mg
COLOR: White
SHAPE: Oval (Biconvex)
SCORE: No Score
SIZE: 17 mm
IMPRINT: W962
QTY: 30 Tablets


