의약품 제조업체: Pharmacyclics LLC (Updated: 2024-05-09)
처방 정보 하이라이트
IMBRUVICA® (ibrutinib) capsules, for oral use
IMBRUVICA® (ibrutinib) tablets, for oral use
IMBRUVICA® (ibrutinib) oral suspension
Initial U.S. Approval: 2013
최근 주요 변경 사항
| Warnings and Precautions, Hepatotoxicity, Including Drug-Induced Liver Injury (5.7) |
5/2024 |
적응증 및 용법
용량 및 투여
금기
없음 (4)
경고 및 주의사항
- 출혈: 출혈 여부를 모니터링하고 관리하십시오 (5.1).
- 감염: 환자의 열 및 감염 여부를 모니터링하고, 즉시 평가하고, 치료하십시오 (5.2).
- 심장 부정맥, 심부전 및 급사: 부정맥 및 심부전의 증상을 모니터링하고 관리하십시오 (5.3).
- 고혈압: 혈압을 모니터링하고 치료하십시오 (5.4).
- 혈구감소증: 매월 전체 혈구 수를 확인하십시오 (5.5).
- 두 번째 원발성 악성 종양: 피부암 및 기타 암종을 포함한 다른 악성 종양이 환자에게서 발생했습니다 (5.6).
- 약물성 간 손상을 포함한 간독성: 치료하는 동안 간 기능을 모니터링하십시오 (5.7).
- 종양 용해 증후군(TLS): 기준 위험을 평가하고 예방 조치를 취하십시오. TLS를 모니터링하고 치료하십시오 (5.8).
- 태아 독성: 태아에게 해를 끼칠 수 있습니다. 임신 가능성이 있는 여성에게 태아에 대한 잠재적 위험과 효과적인 피임법을 사용하도록 조언하십시오 (5.9, 8.1, 8.3).
이상 반응
- B세포 악성 종양 환자에서 가장 흔한(≥30%) 이상 반응은 혈소판 감소증, 설사, 피로, 근골격계 통증, 호중구 감소증, 발진, 빈혈, 멍, 메스꺼움입니다 (6).
- cGVHD 성인 또는 소아 환자에서 가장 흔한(≥20%) 이상 반응은 피로, 빈혈, 멍, 설사, 혈소판 감소증, 근골격계 통증, 열, 근육 경련, 구내염, 출혈, 메스꺼움, 복통, 폐렴, 두통입니다 (6).
이상 반응이 의심되는 경우 Pharmacyclics(1-877-877-3536) 또는 FDA(1-800-FDA-1088 또는 www.fda.gov/medwatch)에 보고하십시오.
약물 상호 작용
특정 집단에서의 사용
환자 상담 정보 및 FDA 승인 환자 라벨링은 17을 참조하십시오.
개정일: 2024년 5월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
1
적응증 및 용법
1.1
만성 림프구성 백혈병/소림프구성 림프종
1.2
17p 결손이 있는 만성 림프구성 백혈병/소림프구성 림프종
1.3
발덴스트롬 마크로글로불린혈증
1.4
만성 이식편대숙주병
2
용량 및 투여
2.1
권장 복용량
2.2
이상 반응에 대한 용량 수정
2.3
CYP3A 억제제와 함께 사용하기 위한 용량 수정
2.4
간 장애에서의 용량 수정
3
제형 및 함량
4
금기
5
경고 및 주의사항
5.1
출혈
5.2
감염
5.3
심장 부정맥, 심부전 및 급사
5.4
고혈압
5.5
혈구감소증
5.6
제2 원발암
5.7
약물 유발 간 손상을 포함한 간독성
5.8
종양 용해 증후군
5.9
태아 독성
6
이상 반응
6.1
임상 시험 경험
6.2
시판 후 경험
7
약물 상호 작용
7.1
이브루티닙에 대한 CYP3A 억제제의 영향
7.2
이브루티닙에 대한 CYP3A 유도제의 영향
8
특정 집단에서의 사용
8.1
임신
8.2
수유
8.3
가임기 여성 및 남성
8.4
소아 사용
8.5
노인 사용
8.6
간 장애
8.7
혈장분리반출술
10
과다 복용
11
설명
12
임상 약리학
12.1
작용 기전
12.2
약력학
12.3
약동학
13
비임상 독성학
13.1
발암성, 돌연변이 유발성, 생식 능력 손상
14
임상 연구
14.1
만성 림프구성 백혈병 / 소림프구성 림프종
14.2
발덴스트롬 마크로글로불린혈증
14.3
만성 이식편대숙주병
16
공급 방법/보관 및 취급
17
환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션이나 하위 섹션은 나열되지 않습니다.
1
적응증 및 용법
1.2
17p 결손이 있는 만성 림프구성 백혈병/소림프구성 림프종
IMBRUVICA는 17p 결손이 있는 성인 만성 림프구성 백혈병(CLL)/소림프구성 림프종(SLL) 환자 치료에 사용됩니다.
2
복용량 및 투여 방법
2.1
권장 복용량
만성 림프구성 백혈병/소림프구성 림프종 및 발덴스트롬 마크로글로불린혈증
CLL/SLL 및 WM에 대한 IMBRUVICA의 권장 복용량은 질병 진행이나 허용할 수 없는 독성이 나타날 때까지 1일 1회 420mg을 경구 복용하는 것입니다.
CLL/SLL의 경우 IMBRUVICA는 단일 제제로, 리툭시맙 또는 오비누투주맙과 병용하여, 또는 벤다무스틴 및 리툭시맙(BR)과 병용하여 투여할 수 있습니다.
WM의 경우 IMBRUVICA는 단일 제제로 투여하거나 리툭시맙과 병용하여 투여할 수 있습니다.
IMBRUVICA를 리툭시맙 또는 오비누투주맙과 병용하여 투여할 경우, 같은 날 투여할 때 리툭시맙 또는 오비누투주맙 전에 IMBRUVICA를 투여하는 것을 고려하십시오.
만성 이식편대숙주병
cGVHD 환자의 경우 12세 이상 환자에게 권장되는 IMBRUVICA 복용량은 1일 1회 420mg을 경구 복용하는 것이고, 1세 이상 12세 미만의 cGVHD 환자에게 권장되는 복용량은 cGVHD가 진행되거나, 기저 악성 종양이 재발하거나, 허용할 수 없는 독성이 나타날 때까지 1일 1회 240mg/m2을 경구 복용하는 것입니다(최대 420mg까지). cGVHD 치료를 더 이상 필요로 하지 않는 환자의 경우, 개별 환자에 대한 의학적 평가를 고려하여 IMBRUVICA 투여를 중단해야 합니다.
| 240mg/m2을 달성하기 위한 권장 복용량 | ||
| BSA*(m2) 범위 | 투여할 IMBRUVICA 캡슐/정제 용량(mg) | 투여할 IMBRUVICA 경구용 현탁액(70mg/mL) 부피(mL) |
| > 0.3 ~ 0.4 | – | 1.2mL |
| > 0.4 ~ 0.5 | – | 1.5mL |
| > 0.5 ~ 0.6 | – | 1.9mL |
| > 0.6 ~ 0.7 | – | 2.2mL |
| > 0.7 ~ 0.8 | 210mg | 2.6mL |
| > 0.8 ~ 0.9 | 210mg | 2.9mL |
| > 0.9 ~ 1 | 210mg | 3.3mL |
| > 1 ~ 1.1 | 280mg | 3.6mL |
| > 1.1 ~ 1.2 | 280mg | 4mL |
| > 1.2 ~ 1.3 | 280mg | 4.3mL |
| > 1.3 ~ 1.4 | 350mg | 4.6mL |
| > 1.4 ~ 1.5 | 350mg | 5mL |
| > 1.5 ~ 1.6 | 350mg | 5.3mL |
| > 1.6 | 420mg | 6mL |
*BSA = 신체 표면적.
투여
매일 거의 같은 시간에 IMBRUVICA를 투여하십시오.
캡슐은 물 한 컵과 함께 통째로 삼키십시오. 캡슐을 개봉하거나, 쪼개거나, 씹지 마십시오. 정제를 자르거나, 부수거나, 씹지 마십시오.
IMBRUVICA 경구 현탁액의 추가 투여에 대한 자세한 내용은 사용 지침을 따르십시오.
IMBRUVICA를 예정된 시간에 복용하지 않은 경우, 당일에 가능한 한 빨리 복용하고 다음 날부터는 정상적인 일정으로 돌아갈 수 있습니다. 복용하지 않은 용량을 보충하기 위해 IMBRUVICA를 추가로 복용하지 마십시오.
2.2
이상반응에 대한 용량 조절
표 2에 나열된 이상반응의 경우, IMBRUVICA 치료를 중단하십시오. 이상반응이 1등급 또는 기준치(회복)로 개선되면, 권장 용량 조절을 따르십시오(표 2 참조).
| 이상반응a,b | 발생 | CLL/SLL, WM 및 cGVHD가 있는 12세 이상 환자의 경우 회복 후 용량 조절 시작 용량 = 420mg |
cGVHD가 있는 1세 이상 12세 미만 환자의 경우 회복 후 용량 조절 시작 용량 = 240mg/m2 |
| 2등급 심부전 | 처음 | 1일 280mg으로 다시 시작c | 1일 160mg/m2으로 다시 시작c |
| 두 번째 | 1일 140mg으로 다시 시작c | 1일 80mg/m2 으로 다시 시작c | |
| 세 번째 | IMBRUVICA 중단 | IMBRUVICA 중단 | |
| 3등급 심장 부정맥 | 처음 | 1일 280mg으로 다시 시작c | 1일 160mg/m2으로 다시 시작c |
| 두 번째 | IMBRUVICA 중단 | IMBRUVICA 중단 | |
| 3등급 또는 4등급 심부전 4등급 심장 부정맥 |
처음 | IMBRUVICA 중단 | IMBRUVICA 중단 |
| 기타 3등급 또는 4등급 비혈액학적 독성d 감염 또는 발열을 동반한 3등급 또는 4등급 호중구감소증 4등급 혈액학적 독성 |
처음 | 1일 280mg으로 다시 시작 | 1일 160mg/m2으로 다시 시작c |
| 두 번째 | 1일 140mg으로 다시 시작 | 1일 80mg/m2 으로 다시 시작c | |
| 세 번째 | IMBRUVICA 중단 | IMBRUVICA 중단 |
a [see Warnings and Precautions (5)].
b 국립 암 연구소-일반 용어 기준 부작용(NCI-CTCAE) 기준 또는 CLL/SLL의 혈액학적 독성에 대한 만성 림프구성 백혈병 국제 워크샵(iwCLL) 기준에 따른 등급입니다.
c 치료 재개 전에 유익성-위험성을 평가하십시오.
d 4등급 비혈액학적 독성의 경우 치료 재개 전에 유익성-위험성을 평가하십시오.
| 160mg/m를 달성하기 위한 권장 용량2 | 80mg/m를 달성하기 위한 권장 용량2 | |||
| BSA*(m2) 범위 | 투여할 IMBRUVICA 캡슐/정제 용량(mg) | 투여할 IMBRUVICA 경구 현탁액 부피(mL) (70mg/mL) | 투여할 IMBRUVICA 캡슐/정제 용량(mg) | 투여할 IMBRUVICA 경구 현탁액 부피(mL) (70mg/mL) |
| > 0.3 to 0.4 | – | 0.8mL | – | 0.4mL |
| > 0.4 to 0.5 | – | 1mL | – | 0.5mL |
| > 0.5 to 0.6 | – | 1.3mL | – | 0.6mL |
| > 0.6 to 0.7 | – | 1.5mL | – | 0.7mL |
| > 0.7 to 0.8 | 140mg | 1.7mL | 70mg | 0.9mL |
| > 0.8 to 0.9 | 140mg | 1.9mL | 70mg | 1mL |
| > 0.9 to 1 | 140mg | 2.2mL | 70mg | 1.1mL |
| > 1 to 1.1 | 140mg | 2.4mL | 70mg | 1.2mL |
| > 1.1 to 1.2 | 210mg | 2.6mL | – | 1.3mL |
| > 1.2 to 1.3 | 210mg | 2.9mL | – | 1.4mL |
| > 1.3 to 1.4 | 210mg | 3.1mL | – | 1.5mL |
| > 1.4 to 1.5 | 210mg | 3.3mL | 140mg | 1.7mL |
| > 1.5 to 1.6 | 280mg | 3.5mL | 140mg | 1.8mL |
| > 1.6 | 280mg | 4mL | 140mg | 2mL |
*BSA = 체표면적
2.3
CYP3A 억제제와 함께 사용하기 위한 용량 수정
권장 용량 수정은 아래에 설명되어 있습니다. [상호 작용 참조 (7.1)]:
| 환자 집단 | 병용 약물 | 권장 IMBRUVICA 용량 |
| B 세포 악성 종양 |
|
280mg 1일 1회 경구 복용
권장에 따라 용량 수정 [용량 및 투여 참조 (2.2)]. |
|
140mg 1일 1회 경구 복용
권장에 따라 용량 수정 [용량 및 투여 참조 (2.2)]. |
|
|
70mg 1일 1회 경구 복용
권장에 따라 용량 중단 [용량 및 투여 참조 (2.2)]. |
|
|
병용 투여 금지.
이러한 억제제를 단기간(예: 항감염제를 7일 이하) 사용해야 하는 경우, IMBRUVICA를 중단합니다. |
|
| cGVHD가 있는 12세 이상 환자 |
|
420mg 1일 1회 경구 복용
권장에 따라 용량 수정 [용량 및 투여 참조 (2.2)]. |
|
280mg 1일 1회 경구 복용
권장에 따라 용량 수정 [용량 및 투여 참조 (2.2)]. |
|
|
140mg 1일 1회 경구 복용
권장에 따라 용량 중단 [용량 및 투여 참조 (2.2)]. |
|
|
병용 투여 금지.
이러한 억제제를 단기간(예: 항감염제를 7일 이하) 사용해야 하는 경우, IMBRUVICA를 중단합니다. |
|
| cGVHD가 있는 1세 이상 12세 미만 환자 |
|
240mg/m2 1일 1회 경구 복용
권장에 따라 용량 수정 [용량 및 투여 참조 (2.2)]. |
|
160mg/m2 1일 1회 경구 복용 | |
|
80mg/m2 1일 1회 경구 복용 | |
|
병용 투여 금지.
이러한 억제제를 단기간(예: 항감염제를 7일 이하) 사용해야 하는 경우, IMBRUVICA를 중단합니다. |
CYP3A 억제제를 중단한 후에는 이전 용량의 IMBRUVICA로 재개합니다[see Dosage and Administration (2.1), Drug Interactions (7.1)].
2.4
간 장애가 있는 경우 사용하기 위한 용량 수정
B 세포 악성종양이 있는 성인 환자
경증의 간 장애(Child-Pugh 등급 A)가 있는 환자에게 권장되는 용량은 140mg/일입니다.
중등도의 간 장애(Child-Pugh 등급 B)가 있는 환자에게 권장되는 용량은 70mg/일입니다.
중증의 간 장애(Child-Pugh 등급 C)가 있는 환자에게는 IMBRUVICA 사용을 피하십시오. [see Use in Specific Populations (8.6), Clinical Pharmacology (12.3)].
cGVHD 환자
총 빌리루빈 수치가 정상 상한치(ULN)의 1.5~3배인 12세 이상 환자에게 권장되는 용량은 140mg/일입니다(비간성 원인 또는 Gilbert 증후군으로 인한 경우 제외).
총 빌리루빈 수치가 정상 상한치(ULN)의 1.5~3배인 1~12세 미만 환자에게 권장되는 용량은 80mg/m2/일입니다(비간성 원인 또는 Gilbert 증후군으로 인한 경우 제외).
총 빌리루빈 수치가 정상 상한치(ULN)의 3배를 초과하는 이러한 환자에게는 IMBRUVICA 사용을 피하십시오(비간성 원인 또는 Gilbert 증후군으로 인한 경우 제외). [see Use in Specific Populations (8.6), Clinical Pharmacology (12.3)].
4
금기
없음
5. 경고 및 주의사항
5.1
출혈
IMBRUVICA를 투여받은 환자에서 치명적인 출혈 사례가 발생했습니다. 주요 출혈(≥ 3등급, 중증 또는 중추 신경계 사례, 예: 두개내 출혈[경막하 혈종 포함], 위장관 출혈, 혈뇨 및 시술 후 출혈)이 환자의 4.2%에서 발생했으며, 27건의 임상 시험에서 IMBRUVICA를 투여받은 2,838명의 환자 중 0.4%에서 사망이 발생했습니다. 멍과 점상 출혈을 포함한 모든 등급의 출혈 사례는 IMBRUVICA를 투여받은 환자의 39%에서 발생했으며, 멍과 점상 출혈을 제외한 출혈 사례는 각각 23%에서 발생했습니다 [부작용(6.1) 참조].
출혈 사례에 대한 메커니즘은 잘 알려져 있지 않습니다.
IMBRUVICA와 함께 항응고제 또는 항혈소판제를 병용하면 주요 출혈 위험이 증가합니다. 임상 시험에서 항혈소판제 또는 항응고제 치료 없이 IMBRUVICA를 투여받은 2,838명의 환자 중 3.1%에서 주요 출혈이 발생했습니다. 항응고제 치료 병행 여부와 관계없이 항혈소판제 치료를 추가하면 이 비율이 4.4%로 증가했으며, 항혈소판제 치료 병행 여부와 관계없이 항응고제 치료를 추가하면 이 비율이 6.1%로 증가했습니다. IMBRUVICA와 병용 투여할 때는 항응고제 또는 항혈소판제 치료의 위험과 이점을 고려해야 합니다. 출혈의 징후와 증상을 모니터링해야 합니다.
수술 유형 및 출혈 위험에 따라 수술 전후 최소 3~7일 동안 IMBRUVICA 보류의 이점-위험을 고려해야 합니다 [ 임상 연구(14) 참조].
5.2
감염
IMBRUVICA 치료를 받은 환자에서 치명적 및 비치명적 감염(세균성, 바이러스성 또는 진균성 포함)이 발생했습니다. 임상 시험에서 IMBRUVICA를 투여받은 B세포 악성종 환자 1,476명 중 21%에서 3등급 이상의 감염이 발생했습니다 [부작용(6.1, 6.2) 참조]. IMBRUVICA로 치료받은 환자에서 진행성 다초점 백질뇌병증(PML) 및 Pneumocystis jirovecii 폐렴(PJP) 사례가 발생했습니다. 기회 감염 위험이 증가한 환자의 경우 표준 치료법에 따라 예방을 고려해야 합니다. 환자의 열 및 감염 여부를 모니터링 및 평가하고 적절하게 치료해야 합니다.
5.3
심장 부정맥, 심부전 및 급사
IMBRUVICA를 사용한 환자에서 치명적이고 심각한 심장 부정맥과 심부전이 발생했습니다. 심장 질환으로 인한 사망 또는 급사는 임상 시험에서 IMBRUVICA를 투여받은 4,896명의 환자 중 1%에서 발생했으며, 여기에는 승인되지 않은 단독 요법 또는 병용 요법으로 IMBRUVICA를 투여받은 환자가 포함됩니다. 이러한 이상 반응은 고혈압 또는 심장 질환의 병력이 있는 환자와 없는 환자 모두에서 발생했습니다. 심장 질환이 있는 환자는 이러한 사례의 위험이 더 높을 수 있습니다.
3등급 이상의 심실 빈맥은 0.2%, 3등급 이상의 심방 세동 및 심방 조동은 3.7%, 3등급 이상의 심부전은 임상 시험에서 IMBRUVICA를 투여받은 4,896명의 환자 중 1.3%에서 보고되었으며, 여기에는 승인되지 않은 단독 요법 또는 병용 요법으로 IMBRUVICA를 투여받은 환자가 포함됩니다. 이러한 사례는 특히 고혈압 및 당뇨병, 심장 부정맥의 병력이 있는 환자와 급성 감염 환자에서 발생했습니다 [부작용(6.1) 참조].
기준 시점에서 심장 질환의 병력 및 기능을 평가하고, 환자의 심장 부정맥 및 심장 기능을 모니터링해야 합니다. 부정맥(예: 심계항진, 어지러움, 실신, 흉통), 새롭게 나타나는 호흡곤란 또는 기타 심혈관계 문제의 증상이 발생하는 환자의 경우 추가 평가(예: 심전도, 심초음파)를 실시해야 합니다. 심장 부정맥 및 심부전을 적절하게 관리하고, 용량 조절 지침을 따라야 하며 [용량 및 투여(2.2) 참조], IMBRUVICA 치료 지속의 위험과 이점을 고려해야 합니다.
5.4
고혈압
임상 시험에서 IMBRUVICA를 투여받은 B세포 악성종 환자 1,476명 중 19%에서 고혈압이 발생했습니다. 환자의 8%에서 3등급 이상의 고혈압이 발생했습니다 [부작용(6.1) 참조]. 이러한 환자의 하위 집단(N=1,124)의 데이터에 따르면 발병까지의 중간 기간은 5.9개월(범위: 0~24개월)이었습니다. B세포 악성종 환자 1,284명을 대상으로 평균 36개월(범위: 0~98개월) 동안 치료한 5년 이상의 장기 안전성 분석에서 고혈압의 누적 발생률은 시간이 지남에 따라 증가했습니다. 3등급 이상 고혈압의 유병률은 4%(0~1년), 7%(1~2년), 9%(2~3년), 9%(3~4년), 9%(4~5년)였으며, 5년 동안의 전체 발생률은 11%였습니다.
IMBRUVICA로 치료받는 환자의 혈압을 모니터링하고, IMBRUVICA 치료를 받는 동안 적절하게 고혈압 치료제를 시작하거나 조절하고, 3등급 이상의 고혈압에 대한 용량 조절 지침을 따라야 합니다 [용량 및 투여(2.2) 참조].
5.5
혈구감소증
단일 제제로 IMBRUVICA를 투여받은 B세포 악성종 환자 645명에서 실험실 측정 결과를 기준으로 3등급 또는 4등급 호중구감소증이 환자의 23%에서, 3등급 또는 4등급 혈소판감소증이 8%에서, 3등급 또는 4등급 빈혈이 2.8%에서 발생했습니다 [부작용(6.1) 참조].
매달 전체 혈구 수를 모니터링합니다.
5.6
제2 원발성 악성종양
임상시험에서 IMBRUVICA를 투여받은 B세포 악성종양 환자 1,476명 중 비피부암(3.9%)을 포함한 다른 악성종양(10%)이 발생했습니다 [부작용(6.1) 참조]. 가장 빈번하게 발생한 제2 원발성 악성종양은 비흑색종 피부암(6%)이었습니다.
5.7
약물 유발 간 손상을 포함한 간독성
IMBRUVICA를 포함한 Bruton tyrosine kinase 억제제로 치료받은 환자에서 중증, 생명을 위협하고, 잠재적으로 치명적인 약물 유발 간 손상(DILI) 사례를 포함한 간독성이 발생했습니다.
IMBRUVICA로 치료를 시작하기 전과 치료하는 동안 빌리루빈 및 트랜스아미나제를 평가하십시오. IMBRUVICA 투여 후 간 기능 검사 결과에 이상이 있는 환자는 간 기능 검사 이상 및 간독성의 임상 징후 및 증상을 더 자주 모니터링해야 합니다. DILI가 의심되는 경우 IMBRUVICA 투여를 중단하십시오. DILI가 확인되면 IMBRUVICA를 중단하십시오.
5.8
종양 용해 증후군
IMBRUVICA 투여 시 종양 용해 증후군이 드물게 보고되었습니다 [부작용(6.2) 참조]. 기준 위험(예: 높은 종양 부담)을 평가하고 적절한 예방 조치를 취하십시오. 환자를 주의 깊게 모니터링하고 적절하게 치료하십시오.
5.9
배아-태아 독성
동물 실험 결과에 따르면, IMBRUVICA는 임산부에게 투여 시 태아에게 해를 끼칠 수 있습니다. 기관형성 기간 동안 임신한 랫드 및 토끼에게 이브루티닙을 투여한 결과, 혈액 악성종양 환자에서 보고된 것보다 3-20배 높은 노출에서 기형을 포함한 배아-태아 독성이 나타났습니다. 임산부에게는 태아에 대한 잠재적 위험을 알리십시오. 가임 여성에게는 IMBRUVICA 치료 중 및 마지막 복용 후 1개월 동안 효과적인 피임법을 사용하도록 조언하십시오. [특정 환자군에서의 사용(8.1) 참조].
6
이상반응
다음과 같은 임상적으로 유의미한 이상반응은 라벨의 다른 곳에서 설명합니다.
- 출혈 [see Warnings and Precautions (5.1)]
- 감염 [see Warnings and Precautions (5.2)]
- 심장 부정맥, 심부전 및 급사 [see Warnings and Precautions (5.3)]
- 고혈압 [see Warnings and Precautions (5.4)]
- 혈구감소증 [see Warnings and Precautions (5.5)]
- 제2의 원발 악성종양 [see Warnings and Precautions (5.6)]
- DILI를 포함한 간독성 [see Warnings and Precautions (5.7)]
- 종양 용해 증후군 [see Warnings and Precautions (5.8)]
6.1
임상시험 경험
임상시험은 매우 다양한 조건에서 수행되기 때문에, 한 약물의 임상시험에서 관찰된 이상반응 발생률을 다른 약물의 임상시험의 발생률과 직접 비교할 수 없으며, 실제로 관찰되는 발생률을 반영하지 않을 수 있습니다.
달리 명시되지 않는 한, 경고 및 주의사항에 설명된 통합 안전성 모집단은 B세포 악성종양 환자를 대상으로 한 6건의 임상시험에서 IMBRUVICA에 노출된 경우를 반영합니다. IMBRUVICA는 단일 제제로서 1일 1회 420mg을 경구 투여(환자 475명)하거나, 단일 제제로서 1일 1회 560mg[권장 성인 용량의 1.3배(환자 174명)]을 경구 투여하거나, 다른 약물과 병용하여 1일 1회 420mg을 경구 투여(환자 827명)했습니다. 환자 1,476명으로 구성된 이 통합 안전성 모집단에서 87%는 6개월 이상 노출되었고 68%는 1년 넘게 노출되었습니다. 가장 흔한 이상반응(≥ 30%)은 혈소판 감소증, 설사, 피로, 근골격계 통증, 호중구 감소증, 발진, 빈혈, 멍 및 메스꺼움이었습니다.
경고 및 주의사항의 특정 하위 섹션에는 승인되지 않은 단독 요법 또는 병용 요법으로 IMBRUVICA를 투여받은 환자가 포함되어 있습니다.
만성 림프구성 백혈병/소림프구성 림프종
아래에 설명된 데이터는 CLL/SLL 환자를 대상으로 한 1건의 단일군, 공개 라벨 임상시험(1102 연구) 및 5건의 무작위 대조 임상시험(RESONATE, RESONATE-2, HELIOS, iLLUMINATE 및 E1912)에서 IMBRUVICA에 노출된 경우를 반영합니다(총 n=2,016명, IMBRUVICA에 노출된 환자 n=1,133명 포함). 일반적으로 크레아티닌 청소율(CLcr) ≤ 30mL/min, AST 또는 ALT ≥ 2.5 x ULN 또는 총 빌리루빈 ≥ 1.5 x ULN(비간성 원인이 아닌 경우)인 환자는 이러한 임상시험에서 제외되었습니다. E1912 연구에서는 AST 또는 ALT > 3 x ULN 또는 총 빌리루빈 > 2.5 x ULN인 환자가 제외되었습니다. 1102 연구에는 이전에 치료받은 CLL/SLL 환자 51명이 포함되었습니다. RESONATE에는 단일 제제 IMBRUVICA 또는 오파투무맙을 투여받은 이전에 치료받은 CLL 또는 SLL 환자 386명이 무작위로 배정되었습니다. RESONATE-2에는 단일 제제 IMBRUVICA 또는 클로람부실을 투여받은 65세 이상의 치료 경험이 없는 CLL 또는 SLL 환자 267명이 무작위로 배정되었습니다. HELIOS에는 BR과 병용 투여한 IMBRUVICA 또는 BR과 병용 투여한 위약을 투여받은 이전에 치료받은 CLL 또는 SLL 환자 574명이 무작위로 배정되었습니다. iLLUMINATE에는 오비누투주맙과 병용 투여한 IMBRUVICA 또는 오비누투주맙과 병용 투여한 클로람부실을 투여받은 65세 이상이거나 동반 질환이 있는 치료 경험이 없는 CLL/SLL 환자 228명이 무작위로 배정되었습니다. E1912에는 리툭시맙과 병용 투여한 IMBRUVICA 또는 플루다라빈, 사이클로포스파미드 및 리툭시맙(FCR)을 투여받은 70세 이하의 이전에 치료받지 않은 CLL/SLL 환자 510명이 포함되었습니다.
IMBRUVICA를 투여받은 CLL/SLL 환자에서 가장 흔한 이상반응(≥ 30%)은 혈소판 감소증, 설사, 피로, 근골격계 통증, 호중구 감소증, 발진, 빈혈, 멍 및 메스꺼움이었습니다.
IMBRUVICA를 투여받은 CLL/SLL 환자의 4~10%는 이상반응으로 인해 치료를 중단했습니다. 여기에는 폐렴, 출혈, 심방세동, 호중구 감소증, 관절통, 발진 및 혈소판 감소증이 포함되었습니다. 용량 감소로 이어지는 이상반응은 환자의 약 9%에서 발생했습니다.
1102 연구
이전에 치료받은 CLL/SLL 환자를 대상으로 IMBRUVICA 420mg을 1일 1회 투여한 1102 연구(N=51)에서 중간 치료 기간 15.6개월 동안 ≥ 10%의 비율로 발생한 이상반응 및 검사 결과 이상은 표 5 및 표 6에 나와 있습니다.
| 신체기관계 | 이상반응 | 전체 등급 (%) | 3등급 이상 (%) |
| 위장관 장애 | 설사 변비 메스꺼움 구내염 구토 복통 소화불량 |
59 22 20 20 18 14 12 |
4 2 2 0 2 0 0 |
| 피부 및 피하 조직 장애 | 멍 발진 점상출혈 |
51 25 16 |
2 0 0 |
| 감염 및 감 infestation | Upper respiratory tract infection Sinusitis Skin infection Pneumonia Urinary tract infection |
47 22 16 12 12 |
2 6 6 10 2 |
| 전신 장애 및 투여 부위 이상 | 피로 Pyrexia 말초 부종 Asthenia 오한 |
33 24 22 14 12 |
6 2 0 6 0 |
| 근골격계 및 결합 조직 장애 | 근골격계 통증 Arthralgia 근육 경련 |
25 24 18 |
6 0 2 |
| 호흡기계, 흉부 및 종격동 장애 | 기침 구인두 통증 Dyspnea |
22 14 12 |
0 0 0 |
| 신경계 장애 | 현기증 두통 |
20 18 |
0 2 |
| 혈관 장애 | 고혈압 | 16 | 8 |
| 대사 및 영양 장애 | 식욕 감퇴 | 16 | 2 |
| 양성, 악성, 상세불명의 신생물 | Second malignancies | 10 | 2† |
†조직구성 육종으로 인한 환자 1명 사망.
| 환자 비율(N=51) | ||
| 모든 등급 (%) | 3 또는 4등급 (%) | |
| 혈소판 감소 | 69 | 12 |
| 호중구 감소 | 53 | 26 |
| 헤모글로빈 감소 | 43 | 0 |
* IWCLL 기준 및 이상반응 별 검사실 측정치 기준
환자에서 치료 후 발생하는 4등급 혈소판감소증(8%) 및 호중구감소증(12%)이 발생했습니다.
RESONATE
아래 표 7 및 표 8에 설명된 이상반응 및 검사실 이상치는 이전에 치료받은 CLL/SLL 환자를 대상으로 한 RESONATE 연구에서 IMBRUVICA에 대한 중간값 8.6개월 노출 및 오파투무맙에 대한 중간값 5.3개월 노출을 반영합니다.
| 신체 기관계 이상반응 |
IMBRUVICA (N=195) |
Ofatumumab (N=191) |
||
| 모든 등급 (%) |
3등급 이상 (%) |
모든 등급 (%) |
3등급 이상 (%) |
|
| 위장관 장애 | ||||
| 설사 | 48 | 4 | 18 | 2 |
| 메스꺼움 | 26 | 2 | 18 | 0 |
| 구내염* | 17 | 1 | 6 | 1 |
| 변비 | 15 | 0 | 9 | 0 |
| 구토 | 14 | 0 | 6 | 1 |
| 근골격계 및 결합 조직 장애 | ||||
| 근골격계 통증* | 28 | 2 | 18 | 1 |
| 관절통 | 17 | 1 | 7 | 0 |
| 근육 경련 | 13 | 0 | 8 | 0 |
| 피부 및 피하 조직 장애 | ||||
| 발진* | 24 | 3 | 13 | 0 |
| 점상출혈 | 14 | 0 | 1 | 0 |
| 멍* | 12 | 0 | 1 | 0 |
| 전신 장애 및 투여 부위 상태 | ||||
| 발열 | 24 | 2 | 15 | 2† |
| 호흡기, 흉부 및 종격동 장애 | ||||
| 기침 | 19 | 0 | 23 | 1 |
| 호흡곤란 | 12 | 2 | 10 | 1 |
| 감염 및 감염성 질환 | ||||
| 상기도 감염 | 16 | 1 | 11 | 2† |
| Pneumonia* | 15 | 12† | 13 | 10† |
| Sinusitis* | 11 | 1 | 6 | 0 |
| 요로 감염 | 10 | 4 | 5 | 1 |
| 신경계 장애 | ||||
| 두통 | 14 | 1 | 6 | 0 |
| 현기증 | 11 | 0 | 5 | 0 |
| 손상, 중독 및 시술적 합병증 | ||||
| Contusion | 11 | 0 | 3 | 0 |
| 눈 장애 | ||||
| 시야 흐림 | 10 | 0 | 3 | 0 |
| 신체 기관계 및 개별 ADR 용어는 IMBRUVICA군에서 발생 빈도 내림차순으로 정렬되어 있습니다. * 여러 ADR 용어를 포함합니다. † 각 군에서 치명적인 결과를 초래한 폐렴 사례 3건과 오파투무맙군에서 치명적인 결과를 초래한 열과 상기도 감염 사례 1건이 포함됩니다. |
||||
| IMBRUVICA (N=195) |
Ofatumumab (N=191) |
|||
| 모든 등급 (%) |
3등급 또는 4등급 (%) |
모든 등급 (%) |
3등급 또는 4등급 (%) |
|
| 호중구 감소 | 51 | 23 | 57 | 26 |
| 혈소판 감소 | 52 | 5 | 45 | 10 |
| 헤모글로빈 감소 | 36 | 0 | 21 | 0 |
환자에서 치료 후 발생한 4등급 혈소판 감소증(IMBRUVICA군 2% vs 오파투무맙군 3%)과 호중구 감소증(IMBRUVICA군 8% vs 오파투무맙군 8%)이 발생했습니다.
RESONATE-2
아래 표 9 및 표 10에 설명된 이상 반응 및 검사실적 이상은 IMBRUVICA에 대한 노출을 반영하며, 중앙값 노출 기간은 17.4개월이었습니다. RESONATE-2에서 클로람부실에 대한 중앙값 노출 기간은 7.1개월이었습니다.
| 신체 기관 이상 반응 |
IMBRUVICA (N=135) |
클로람부실 (N=132) |
||
| 모든 등급 (%) |
3등급 이상 (%) | 모든 등급 (%) |
3등급 이상 (%) | |
| 위장관 장애 | ||||
| 설사 | 42 | 4 | 17 | 0 |
| 메스꺼움 | 22 | 1 | 39 | 1 |
| 변비 | 16 | 1 | 16 | 0 |
| 구내염* | 14 | 1 | 4 | 1 |
| 구토 | 13 | 0 | 20 | 1 |
| 복통 | 13 | 3 | 11 | 1 |
| 소화불량 | 11 | 0 | 2 | 0 |
| 근골격계 및 결합 조직 장애 | ||||
| 근골격계 통증* | 36 | 4 | 20 | 0 |
| 관절통 | 16 | 1 | 7 | 1 |
| 근육 연축 | 11 | 0 | 5 | 0 |
| 전신 장애 및 투여 부위 이상 | ||||
| 피로 | 30 | 1 | 38 | 5 |
| 말초 부종 | 19 | 1 | 9 | 0 |
| 열 | 17 | 0 | 14 | 2 |
| 호흡기, 흉부 및 종격동 장애 | ||||
| 기침 | 22 | 0 | 15 | 0 |
| 호흡곤란 | 10 | 1 | 10 | 0 |
| 피부 및 피하 조직 장애 | ||||
| 발진* | 21 | 4 | 12 | 2 |
| 멍* | 19 | 0 | 7 | 0 |
| 눈 장애 | ||||
| 안구 건조 | 17 | 0 | 5 | 0 |
| 눈물 분비 증가 | 13 | 0 | 6 | 0 |
| 시야 흐림 | 13 | 0 | 8 | 0 |
| 시력 감소 | 11 | 0 | 2 | 0 |
| 감염 및 감염성 질환 | ||||
| 상기도 감염 | 17 | 2 | 17 | 2 |
| 피부 감염* | 15 | 2 | 3 | 1 |
| 폐렴* | 14 | 8 | 7 | 4 |
| 요로 감염 | 10 | 1 | 8 | 1 |
| 혈관 장애 | ||||
| 고혈압* | 14 | 4 | 1 | 0 |
| 신경계 장애 | ||||
| 두통 | 12 | 1 | 10 | 2 |
| 어지러움 | 11 | 0 | 12 | 1 |
| 검사 | ||||
| 체중 감소 | 10 | 0 | 12 | 0 |
주어진 ADR 용어에 대해 여러 이벤트가 있는 피험자는 각 ADR 용어에 대해 한 번만 계산됩니다.
신체 기관계 및 개별 ADR 용어는 IMBRUVICA 군에서 발생 빈도 내림차순으로 정렬됩니다.
* 여러 ADR 용어를 포함합니다.
| IMBRUVICA (N=135) |
Chlorambucil (N=132) |
|||
| 모든 등급 (%) |
3 또는 4등급 (%) |
모든 등급 (%) |
3 또는 4등급 (%) |
|
| 호중구 감소 | 55 | 28 | 67 | 31 |
| 혈소판 감소 | 47 | 7 | 58 | 14 |
| 헤모글로빈 감소 | 36 | 0 | 39 | 2 |
환자에서 치료 후 발생한 4등급 혈소판 감소증(IMBRUVICA군 1% vs chlorambucil군 3%) 및 호중구 감소증(IMBRUVICA군 11% vs chlorambucil군 12%)이 발생했습니다.
HELIOS
이전에 치료받은 CLL/SLL 환자를 대상으로 한 HELIOS에서 아래 표 11에 설명된 이상반응은 중간값 14.7개월 동안 IMBRUVICA + BR에 노출된 경우와 중간값 12.8개월 동안 위약 + BR에 노출된 경우를 반영합니다.
| 신체 기관 이상반응 |
IMBRUVICA + BR (N=287) |
위약 + BR (N=287) |
||
| 모든 등급 (%) |
3등급 이상 (%) | 모든 등급 (%) |
3등급 이상 (%) | |
| 혈액 및 림프계 장애 | ||||
| Neutropenia* | 66 | 61 | 60 | 56† |
| Thrombocytopenia* | 34 | 16 | 26 | 16 |
| 위장관 장애 | ||||
| 설사 | 36 | 2 | 23 | 1 |
| 복통 | 12 | 1 | 8 | <1 |
| 피부 및 피하 조직 장애 | ||||
| Rash* | 32 | 4 | 25 | 1 |
| Bruising * | 20 | <1 | 8 | <1 |
| 근골격계 및 결합 조직 장애 | ||||
| Musculoskeletal pain* | 29 | 2 | 20 | 0 |
| 근육 경련 | 12 | <1 | 5 | 0 |
| 일반적 장애 및 투여 부위 이상 | ||||
| Pyrexia | 25 | 4 | 22 | 2 |
| 혈관 장애 | ||||
| Hemorrhage* | 19 | 2† | 9 | 1 |
| Hypertension* | 11 | 5 | 5 | 2 |
| 감염 및 감염성 질환 | ||||
| Bronchitis | 13 | 2 | 10 | 3 |
| 피부 감염* | 10 | 3 | 6 | 2 |
| 대사 및 영양 장애 | ||||
| Hyperuricemia | 10 | 2 | 6 | 0 |
IMBRUVICA군에서 신체 기관계 및 개별 ADR 용어는 빈도가 높은 순서대로 정렬됩니다.
* 여러 ADR 용어를 포함합니다.
<1은 빈도가 0% 초과 0.5% 미만인 경우 사용되었습니다.
† IMBRUVICA군에서 치명적인 결과를 초래한 출혈 사례 2건과 위약 + BR군에서 치명적인 결과를 초래한 호중구 감소증 사례 1건이 포함됩니다.
모든 등급의 심방 세동은 IMBRUVICA + BR로 치료받은 환자의 7%와 위약 + BR로 치료받은 환자의 2%에서 발생했습니다. 3등급 및 4등급 심방 세동의 빈도는 IMBRUVICA + BR로 치료받은 환자에서 3%, 위약 + BR로 치료받은 환자에서 1%였습니다.
iLLUMINATE
아래 표 12에 설명된 이상 반응은 이전에 치료받지 않은 CLL/SLL 환자를 대상으로 한 iLLUMINATE 연구에서 중앙값 기간 29.3개월 동안 IMBRUVICA + 오비누투주맙에 노출된 경우와 중앙값 기간 5.1개월 동안 클로람부실 + 오비누투주맙에 노출된 경우를 반영합니다.
| 신체 기관계 이상 반응 |
IMBRUVICA + 오비누투주맙 (N=113) |
클로람부실 + 오비누투주맙 (N=115) |
||
| 모든 등급 (%) |
3등급 이상 (%) | 모든 등급 (%) |
3등급 이상 (%) | |
| 혈액 및 림프계 장애 | ||||
| 호중구 감소증* | 48 | 39 | 64 | 48 |
| 혈소판 감소증* | 36 | 19 | 28 | 11 |
| 빈혈 | 17 | 4 | 25 | 8 |
| 피부 및 피하 조직 장애 | ||||
| 발진* | 36 | 3 | 11 | 0 |
| 타박상* | 32 | 3 | 3 | 0 |
| 위장관 장애 | ||||
| 설사 | 34 | 3 | 10 | 0 |
| 변비 | 16 | 0 | 12 | 1 |
| 메스꺼움 | 12 | 0 | 30 | 0 |
| 근골격계 및 결합 조직 장애 | ||||
| 근골격계 통증* | 33 | 1 | 23 | 3 |
| 관절통 | 22 | 1 | 10 | 0 |
| 근육 연축 | 13 | 0 | 6 | 0 |
| 호흡기계, 흉부 및 종격동 장애 | ||||
| 기침 | 27 | 1 | 12 | 0 |
| 손상, 중독 및 시술 합병증 | ||||
| 주입 관련 반응 | 25 | 2 | 58 | 8 |
| 혈관 장애 | ||||
| 출혈* | 25 | 1 | 9 | 0 |
| 고혈압* | 17 | 4 | 4 | 3 |
| 전신 장애 및 투여 부위 상태 | ||||
| 발열 | 19 | 2 | 26 | 1 |
| 피로 | 18 | 0 | 17 | 2 |
| 말초 부종 | 12 | 0 | 7 | 0 |
| 감염 및 기생충 감염 | ||||
| 폐렴* | 16 | 9 | 9 | 4† |
| 상기도 감염 |
14 | 1 | 6 | 0 |
| 피부 감염* | 13 | 1 | 3 | 0 |
| 요로 감염 | 12 | 3 | 7 | 1 |
| 비인두염 | 12 | 0 | 3 | 0 |
| 결막염 | 11 | 0 | 2 | 0 |
| 대사 및 영양 장애 | ||||
| 고요산혈증 | 13 | 1 | 0 | 0 |
| 심장 장애 | ||||
| 심방세동 | 12 | 5 | 0 | 0 |
| 정신 장애 | ||||
| 불면증 | 12 | 0 | 4 | 0 |
IMBRUVICA군에서 신체 기관계 및 개별 ADR 용어는 빈도가 내림차순으로 정렬되었습니다.
* 여러 ADR 용어를 포함합니다.
† 사망에 이른 사례 한 건을 포함합니다.
E1912
아래 표 13에 설명된 이상반응은 이전에 치료받지 않은 70세 이하의 CLL/SLL 환자를 대상으로 한 E1912에서 IMBRUVICA + 리툭시맙 투여군의 경우 34.3개월, FCR 투여군의 경우 4.7개월의 중앙값 노출 기간을 반영한 것입니다.
| 신체 기관계 이상반응 |
IMBRUVICA + 리툭시맙
(N=352) |
플루다라빈 + 시클로포스파미드 + 리툭시맙 (N=158) |
||
| 모든 등급 (%) |
3등급 이상 (%) |
모든 등급 (%) |
3등급 이상 (%) |
|
| 전신 장애 및 투여 부위 이상 | ||||
| 피로 | 80 | 2 | 78 | 3 |
| 말초 부종 | 28 | 1 | 17 | 0 |
| 열 | 27 | 1 | 27 | 1 |
| 통증 | 23 | 2 | 8 | 0 |
| 근골격계 및 결합 조직 장애 | ||||
| 근골격계 통증* | 61 | 5 | 35 | 2 |
| 관절통 | 41 | 5 | 10 | 1 |
| 위장관 장애 | ||||
| 설사 | 53 | 4 | 27 | 1 |
| 메스꺼움 | 40 | 1 | 64 | 1 |
| 구내염* | 22 | 1 | 8 | 1 |
| 복통* | 19 | 2 | 10 | 1 |
| 구토 | 18 | 2 | 28 | 0 |
| 변비 | 17 | 0 | 32 | 0 |
| 피부 및 피하 조직 장애 | ||||
| 발진* | 49 | 4 | 29 | 5 |
| 타박상* | 36 | 1 | 4 | 1 |
| 혈관 장애 | ||||
| 고혈압* | 42 | 19 | 22 | 6 |
| 출혈* | 31 | 2 | 8 | 1 |
| 신경계 장애 | ||||
| 두통 | 40 | 1 | 27 | 1 |
| 현기증 | 21 | 1 | 13 | 1 |
| Peripheral neuropathy* | 19 | 1 | 13 | 1 |
| 호흡기, 흉부 및 종격동 장애 | ||||
| 기침 | 32 | 0 | 25 | 0 |
| 호흡곤란 | 22 | 2 | 21 | 1 |
| 감염 및 감염성 질환 | ||||
| 상기도 | 29 | 1 | 19 | 2 |
| 감염 | ||||
| Skin infection* | 16 | 1 | 3 | 1 |
| 대사 및 영양 장애 | ||||
| 고요산혈증 | 19 | 1 | 4 | 0 |
| 식욕 감퇴 | 15 | 0 | 20 | 1 |
| 정신 장애 | ||||
| 불면증 | 16 | 1 | 19 | 1 |
IMBRUVICA군에서 신체 기관과 개별 ADR 용어는 발생 빈도가 높은 순서대로 정렬되어 있습니다.
* 여러 ADR 용어를 포함합니다.
| IMBRUVICA + Rituximab
(N=352) |
Fludarabine + Cyclophosphamide + Rituximab (N=158) |
|||
| 모든 등급 (%) |
3등급 또는 4등급 (%) |
모든 등급 (%) |
3등급 또는 4등급 (%) |
|
| 혈액학적 이상 호중구 감소 혈소판 감소 헤모글로빈 감소 |
53 43 26 |
30 7 0 |
70 69 51 |
44 25 2 |
| 화학적 검사 이상 크레아티닌 증가 빌리루빈 증가 AST 증가 |
38 30 25 |
1 2 3 |
17 15 23 |
1 0 <1 |
IWCLL 기준에 따른 실험실 측정치 기준입니다.
발덴스트롬 마크로글로불린혈증
아래에 설명된 데이터는 두 건의 단일군 임상시험(1118 연구 및 INNOVATE 단독요법군)과 한 건의 무작위 대조군 임상시험(INNOVATE)에서 IMBRUVICA에 노출된 WM 환자 총 169명을 대상으로 한 IMBRUVICA 노출을 반영합니다. 1118 연구에는 이전에 치료받은 적이 있는 WM 환자 63명이 IMBRUVICA 단일 제제를 투여받았습니다. INNOVATE에는 치료 경험이 없거나 이전에 치료받은 적이 있는 WM 환자 150명이 리툭시맙과 병용하여 IMBRUVICA 또는 위약을 투여받았습니다. INNOVATE 단독요법군에는 이전 리툭시맙 함유 요법의 실패 후 IMBRUVICA를 투여받은 이전에 치료받은 적이 있는 WM 환자 31명이 포함되었습니다.
1118 및 INNOVATE 연구(≥ 20%)에서 가장 흔한 이상반응은 호중구감소증, 설사, 멍, 혈소판감소증, 출혈, 근골격계 통증, 발진 및 메스꺼움이었습니다.
1118 및 INNOVATE 연구에서 IMBRUVICA를 투여받은 환자의 5%가 이상반응으로 인해 치료를 중단했습니다. 치료 중단으로 이어진 가장 흔한 이상반응은 심방세동이었습니다. 용량 감소로 이어진 이상반응은 환자의 14%에서 발생했습니다.
1118 연구 및 INNOVATE 단독요법군
아래 표 15 및 표 16에 설명된 이상반응 및 검사 이상은 1118 연구에서 11.7개월, INNOVATE 단독요법군에서 33개월의 중간값 기간 동안 IMBRUVICA 노출을 반영합니다.
| 신체기관계 | 이상반응 | 모든 등급 (%) | 3등급 이상 (%) |
| 위장관계 장애 | 설사 메스꺼움 구내염* 변비 위식도 역류질환 |
38 21 15 12 12 |
2 0 0 1 0 |
| 피부 및 피하 조직 장애 | 멍* 발진* |
28 21 |
1 1 |
| 혈관 장애 | 출혈* 고혈압* |
28 14 |
0 4 |
| 전신 장애 및 투여 부위 이상 | 피로 열 |
18 12 |
2 2 |
| 근골격계 및 결합 조직 장애 | 근골격계 통증* 근육 경련 |
21 19 |
0 0 |
| 감염 및 감염성 질환 | 상기도 감염 피부 감염* 부비동염* 폐렴* |
19 18 16 13 |
0 3 0 5 |
| 신경계 장애 | 두통 어지러움 |
14 13 |
0 0 |
| 호흡기계, 흉부 및 종격동 장애 | 기침 | 13 | 0 |
신체기관계 및 개별 ADR 우선순위 용어는 발생 빈도가 높은 순서대로 정렬되어 있습니다.
* 여러 ADR 용어를 포함합니다.
| 환자 비율(N=94) | ||
| 모든 등급 (%) | 3 또는 4등급 (%) | |
| 혈소판 감소 | 38 | 11 |
| 호중구 감소 | 43 | 16 |
| 헤모글로빈 감소 | 21 | 6 |
환자에서 치료 후 발생한 4등급 혈소판 감소증(4%) 및 호중구 감소증(7%)이 나타났습니다.
INNOVATE
아래 표 17에 설명된 이상반응은 INNOVATE에서 치료 경험이 없거나 이전에 치료를 받은 WM 환자를 대상으로 IMBRUVICA + R에 대한 중간 노출 기간 25.8개월 및 위약 + R에 대한 중간 노출 기간 15.5개월을 반영합니다.
| 신체 기관계 이상반응 |
IMBRUVICA + R (N=75) |
위약 + R (N=75) |
||
| 모든 등급 (%) |
3등급 이상 (%) |
모든 등급 (%) |
3등급 이상 (%) |
|
| 피부 및 피하 조직 장애 | ||||
| 멍* | 37 | 1 | 5 | 0 |
| 발진* | 24 | 1 | 11 | 0 |
| 근골격계 및 결합 조직 장애 | ||||
| 근골격계 통증* | 35 | 4 | 21 | 3 |
| 관절통 | 24 | 3 | 11 | 1 |
| 근육 연축 | 17 | 0 | 12 | 1 |
| 혈관 장애 | ||||
| 출혈* | 32 | 3 | 17 | 4† |
| 고혈압* | 20 | 13 | 5 | 4 |
| 위장관 장애 | ||||
| 설사 | 28 | 0 | 15 | 1 |
| 메스꺼움 | 21 | 0 | 12 | 0 |
| 소화불량 | 16 | 0 | 1 | 0 |
| 변비 | 13 | 1 | 11 | 1 |
| 감염 및 감염성 질환 | ||||
| 폐렴* | 19 | 13 | 5 | 3 |
| 피부 감염* | 17 | 3 | 3 | 0 |
| 요로 감염 | 13 | 0 | 0 | 0 |
| 기관지염 | 12 | 3 | 7 | 0 |
| 인플루엔자 | 12 | 0 | 7 | 1 |
| 바이러스성 상기도 감염 | 11 | 0 | 7 | 0 |
| 일반적 장애 및 투여 부위 상태 | ||||
| 말초 부종 | 17 | 0 | 12 | 1 |
| 호흡기, 흉부 및 종격동 장애 | ||||
| 기침 | 17 | 0 | 11 | 0 |
| 혈액 및 림프계 장애 | ||||
| Neutropenia* | 16 | 12 | 11 | 4 |
| 심장 질환 | ||||
| 심방세동 | 15 | 12 | 3 | 1 |
| 신경계 장애 | ||||
| 현기증 | 11 | 0 | 7 | 0 |
| 정신 장애 | ||||
| 불면증 | 11 | 0 | 4 | 0 |
| 대사 및 영양 장애 | ||||
| 저칼륨혈증 | 11 | 0 | 1 | 1 |
신체 기관과 개별 ADR 선호 용어는 발생 빈도 순서대로 정렬됩니다.
* 여러 ADR 용어를 포함합니다.
† 사망에 이른 사례 한 건이 포함됩니다.
IR로 치료받은 환자의 1%에서 3~4등급 주입 관련 반응이 관찰되었습니다.
만성 이식편대숙주병
연구 1129
아래에 설명된 데이터는 1차 코르티코스테로이드 치료 실패 후 cGVHD가 발생하여 추가 치료가 필요한 환자 42명을 대상으로 한 공개 임상 시험(연구 1129)에서 IMBRUVICA에 대한 노출을 반영합니다. [임상 연구 (14.3)]를 참조하십시오.
연구 1129에서 가장 흔한 이상 반응(≥ 20%)은 피로, 멍, 설사, 혈소판 감소증, 구내염, 근육 경련, 메스꺼움, 출혈, 빈혈, 폐렴이었습니다. 심방세동은 한 명의 환자(2%)에서 발생했으며 3등급이었습니다.
연구 1129에서 IMBRUVICA를 투여받은 환자의 24%가 이상 반응으로 인해 치료를 중단했습니다. 치료 중단으로 가장 흔한 이상 반응은 피로와 폐렴이었습니다. 용량 감소로 이어진 이상 반응은 환자의 26%에서 발생했습니다.
표 18과 표 19에 설명된 이상 반응과 검험실적 이상은 연구 1129에서 평균 4.4개월 동안 IMBRUVICA에 대한 노출을 반영합니다.
| 신체 기관 | 이상 반응 | 모든 등급 (%) | 3등급 이상 (%) |
| 전신 장애 및 투여 부위 이상 | 피로 열 말초 부종 |
57 17 12 |
12 5 0 |
| 피부 및 피하 조직 장애 | 멍* 발진* |
40 12 |
0 0 |
| 위장관 장애 | 설사 구내염* 메스꺼움 변비 |
36 29 26 12 |
10 2 0 0 |
| 근골격계 및 결합 조직 장애 | 근육 경련 근골격계 통증* |
29 14 |
2 5 |
| 혈관 장애 | 출혈* | 26 | 0 |
| 감염 및 감염성 질환 | 폐렴* 상기도 감염 패혈증* |
21 19 10 |
14† 0 10 |
| 신경계 장애 | 두통 | 17 | 5 |
| 손상, 중독 및 시술 합병증 | 낙상 | 17 | 0 |
| 호흡기, 흉부 및 종격동 장애 | 기침 호흡곤란 |
14 12 |
0 2 |
| 대사 및 영양 장애 | 저칼륨혈증 | 12 | 7 |
신체 기관 분류와 개별 ADR 선호 용어는 발생 빈도 순서대로 정렬됩니다.
* 여러 ADR 용어를 포함합니다.
† 사망에 이른 사례 2건이 포함됩니다.
| 환자 비율(N=42) | ||
| 모든 등급 (%) | 3등급 또는 4등급 (%) | |
| 혈소판 감소 | 33 | 0 |
| 호중구 감소 | 10 | 10 |
| 헤모글로빈 감소 | 24 | 2 |
환자의 2%에서 치료 후 발생한 4등급 호중구감소증이 나타났습니다.
iMAGINE
IMBRUVICA의 안전성은 하나 이상의 전신 요법 실패 후 cGVHD가 있는 1세에서 22세 미만의 소아 및 청소년 환자 47명을 포함한 iMAGINE 연구에서 평가되었습니다. 12세 이상의 환자는 IMBRUVICA 420mg을 1일 1회 경구 투여했으며, 1세에서 12세 미만의 환자는 IMBRUVICA 240mg/m2을 1일 1회 경구 투여했습니다. [14.3) 임상 연구 참조]. IMBRUVICA에 대한 노출 기간 중앙값은 7.1개월(범위: 0.2~25.9개월)이었습니다.
IMBRUVICA를 투여받은 환자의 64%에서 중대한 이상반응이 발생했습니다. 2명 이상의 환자에서 발생한 중대한 이상반응은 폐렴, 발열, 패혈증, 구내염이었습니다. IMBRUVICA를 투여받은 두 명의 환자에서 패혈증 및 급성 호흡곤란 증후군(ARDS)을 포함한 치명적인 이상반응이 발생했습니다.
이상반응으로 인해 IMBRUVICA를 영구적으로 중단한 환자는 23%였습니다. 2명 이상의 환자에서 영구적인 중단을 초래한 이상반응은 출혈을 포함했습니다. 이상반응으로 인해 IMBRUVICA의 용량을 감량한 환자는 19%였습니다. 2명 이상의 환자에서 용량 감량이 필요한 이상반응은 구내염을 포함했습니다.
검사실 이상을 포함하여 가장 흔한(≥ 20%) 이상반응은 빈혈, 근골격계 통증, 발열, 설사, 폐렴, 복통, 구내염, 혈소판감소증, 두통이었습니다.
표 20은 iMAGINE에서 나타난 이상반응을 요약한 것입니다.
| IMBRUVICA (N=47) |
||
| 신체 기관계 이상반응 |
모든 등급 (%) |
3등급 또는 4등급 (%) |
| 전신 장애 및 투여 부위 이상 | ||
| 발열 | 30 | 11 |
| 근골격계 및 결합 조직 장애 | ||
| 근골격계 통증* | 30 | 2 |
| 골괴사 | 11 | 9 |
| 위장관 장애 | ||
| 설사 | 28 | 2 |
| 복통* | 23 | 4 |
| 구내염* | 23 | 9 |
| 구토 | 19 | 2 |
| 메스꺼움 | 19 | 4 |
| 감염 및 감염성 질환 | ||
| 폐렴* | 23 | 13 |
| 피부 감염* | 17 | 4 |
| 패혈증* | 11 | 9† |
| 신경계 장애 | ||
| 두통 | 21 | 2 |
| 피부 및 피하 조직 장애 | ||
| 발진* | 19 | 2 |
| 가려움증 | 13 | 0 |
| 점상출혈 | 13 | 0 |
| 호흡기계, 흉곽 및 종격 장애 | ||
| 기침 | 19 | 2 |
| 혈관 장애 | ||
| 출혈* | 17 | 0 |
| 고혈압* | 11 | 4 |
| 혈액 및 림프계 장애 | ||
| 저칼륨혈증 | 15 | 6 |
| 저감마글로불린혈증* | 11 | 0 |
| 심장 질환 | ||
| 동성 빈맥 | 11 | 0 |
| 조사 | ||
| 알라닌 아미노전이효소 증가 | 11 | 2 |
전신 장기 등급 및 개별 ADR 선호 용어는 발생 빈도 순서대로 정렬됩니다.
* 여러 ADR 용어를 포함합니다.
† 사망 1건을 포함합니다.
표 21 에는 iMAGINE의 실험실 이상이 요약되어 있습니다.
| IMBRUVICA (N=47) |
||
| 모든 등급 (%) |
3~4등급 (%) |
|
| 헤모글로빈 감소 | 49 | 13 |
| 혈소판 감소 | 21 | 4 |
| 호중구 감소 | 13 | 6 |
치료 후 발생한 Grade 4 호중구 감소증이 환자의 3%에서 발생했습니다.
추가적인 중요 이상 반응
심혈관계 사건
심혈관계 사건에 대한 데이터는 IMBRUVICA를 사용한 무작위 대조 임상시험(n=2,115, IMBRUVICA 치료군 1,157명의 평균 치료 기간은 19.1개월, 대조군 958명의 평균 치료 기간은 5.3개월)을 기반으로 합니다. 모든 등급의 심실 빈맥(심실성 기외수축, 심실 부정맥, 심방 세동, 심방 조동, 심실 빈맥) 발생률은 IMBRUVICA 치료군에서 1.0%였던 반면 대조군에서는 0.4%였으며, 3등급 이상의 발생률은 IMBRUVICA 치료군에서 0.3%였던 반면 대조군에서는 0%였습니다. 모든 등급의 심방 세동 및 심방 조동 발생률은 IMBRUVICA 치료군에서 8.4%였던 반면 대조군에서는 1.6%였으며, 3등급 이상의 발생률은 IMBRUVICA 치료군에서 4.0%였던 반면 대조군에서는 0.5%였습니다. 또한 모든 등급의 심부전 발생률은 IMBRUVICA 치료군에서 1.7%였던 반면 대조군에서는 0.5%였으며, 3등급 이상의 발생률은 IMBRUVICA 치료군에서 1.2%였던 반면 대조군에서는 0.3%였습니다.
모든 등급의 허혈성 뇌혈관 사건(뇌혈관 사고, 허혈성 뇌졸중, 뇌 허혈, 일과성 허혈 발작) 발생률은 IMBRUVICA 치료군에서 1%였던 반면 대조군에서는 0.4%였으며, 3등급 이상의 발생률은 IMBRUVICA 치료군에서 0.5%였던 반면 대조군에서는 0.2%였습니다.
설사
무작위 대조 임상시험(n=2,115, IMBRUVICA 치료군 1,157명의 평균 치료 기간은 19.1개월, 대조군 958명의 평균 치료 기간은 5.3개월)에서 모든 등급의 설사는 IMBRUVICA 치료군의 43%에서 발생한 반면, 대조군에서는 19%에서 발생했습니다. 3등급 설사는 IMBRUVICA 치료군의 3%에서 발생한 반면, 대조군에서는 1%에서 발생했습니다. 설사로 인해 IMBRUVICA 치료를 중단한 환자는 1% 미만(0.3%)이었던 반면, 대조군에서는 0%였습니다.
이러한 환자 1,605명의 데이터를 기반으로 했을 때 모든 등급의 설사 발생까지의 평균 시간은 IMBRUVICA 치료군에서 21일(범위: 0~708일)이었던 반면 대조군에서는 46일(범위: 0~492일)이었으며, 3등급 설사 발생까지의 평균 시간은 IMBRUVICA 치료군에서 117일(범위: 3~414일)이었던 반면 대조군에서는 194일(범위: 11~325일)이었습니다. 설사를 보고한 환자 중 완전히 해결된 환자는 IMBRUVICA 치료군에서 85%였던 반면 대조군에서는 89%였으며, 분석 당시 해결되지 않은 것으로 보고된 환자는 IMBRUVICA 치료군에서 15%였던 반면 대조군에서는 11%였습니다. IMBRUVICA 치료군에서 증상 발생부터 해결까지의 평균 시간은 모든 등급의 설사의 경우 7일(범위: 1~655일)이었던 반면 대조군에서는 4일(범위: 1~367일)이었으며, 3등급 설사의 경우 IMBRUVICA 치료군에서 7일(범위: 1~78일)이었던 반면 대조군에서는 19일(범위: 1~56일)이었습니다.
시각 장애
무작위 대조 임상시험(n=2,115, IMBRUVICA 치료군 1,157명의 평균 치료 기간은 19.1개월, 대조군 958명의 평균 치료 기간은 5.3개월)에서 모든 등급의 시야 흐림 및 시력 감소는 IMBRUVICA 치료군의 11%(1등급 9%, 2등급 2%, 3등급 이상 없음)에서 발생한 반면, 대조군에서는 6%(1등급 5%, 2등급 및 3등급 < 1%)에서 발생했습니다.
이러한 환자 1,605명의 데이터를 기반으로 했을 때 증상 발생까지의 평균 시간은 IMBRUVICA 치료군에서 91일(범위: 0~617일)이었던 반면 대조군에서는 100일(범위: 2~477일)이었습니다. 시각 장애를 보고한 환자 중 완전히 해결된 환자는 IMBRUVICA 치료군에서 60%였던 반면 대조군에서는 71%였으며, 분석 당시 해결되지 않은 것으로 보고된 환자는 IMBRUVICA 치료군에서 40%였던 반면 대조군에서는 29%였습니다. 증상 발생부터 해결까지의 평균 시간은 IMBRUVICA 치료군에서 37일(범위: 1~457일)이었던 반면 대조군에서는 26일(범위: 1~721일)이었습니다.
6.2
시판 후 경험
IMBRUVICA의 시판 후 사용 중 다음과 같은 이상 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되므로 빈도를 확실하게 추정하거나 약물 노출과의 인과 관계를 확립하는 것이 항상 가능한 것은 아닙니다.
- 간담도 질환: 급성 및/또는 치명적인 사건을 포함한 간부전, 간경변, 약물 유발 간 손상
- 호흡기 질환: 간질성 폐 질환
- 대사 및 영양 장애: 종양 용해 증후군
- 면역 체계 장애: 아나필락시스 쇼크, 혈관 부종, 두드러기
- 피부 및 피하 조직 장애: 스티븐스-존슨 증후군(SJS), 손발톱 박리증, 판상피부염, 호중구 감소증
- 감염: B형 간염 재활성화
- 신경계 장애: 말초 신경병증
8. 특정 집단에서의 사용
8.1
임신
위험 요약
IMBRUVICA는 동물 연구 결과에 따라 태아에게 해를 끼칠 수 있습니다. 주요 선천적 기형 및 유산에 대한 약물 관련 위험을 알리기 위해 임산부에서 IMBRUVICA를 사용한 데이터는 없습니다. 동물 생식 연구에서 기관 형성 기간 동안 임상 용량 420mg의 3-20배에 해당하는 용량을 임신한 쥐와 토끼에게 이브루티닙을 투여한 결과 구조적 기형을 포함한 태아 독성이 나타났습니다 (see Data). 임산부에게 태아에 대한 잠재적 위험을 알리십시오.
모든 임신에는 선천적 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 해당 집단의 주요 선천적 기형 및 유산에 대한 추정 배경 위험은 알 수 없습니다. 미국 전체 인구에서 임상적으로 확인된 임신의 주요 선천적 기형 및 유산에 대한 추정 배경 위험은 각각 2-4% 및 15-20%입니다.
자료
동물 자료
이브루티닙은 기관 형성 기간 동안 임신한 쥐에게 10, 40, 80mg/kg/일 용량으로 경구 투여되었습니다. 80mg/kg/일 용량의 이브루티닙은 내장 기형(심장 및 주요 혈관)과 관련이 있었고 흡수 및 착상 후 손실이 증가했습니다. 쥐에서 80mg/kg/일 용량은 매일 420mg 용량을 투여받은 CLL/SLL 또는 WM 환자의 노출량의 약 20배입니다. 40mg/kg/일 이상 용량의 이브루티닙은 태아 체중 감소와 관련이 있습니다. 쥐에서 40mg/kg/일 용량은 420mg 용량을 투여받은 환자의 노출량(AUC)의 약 8배입니다.
이브루티닙은 또한 기관 형성 기간 동안 임신한 토끼에게 5, 15, 45mg/kg/일 용량으로 경구 투여되었습니다. 15mg/kg/일 이상 용량의 이브루티닙은 골격 변이(융합된 흉골)와 관련이 있었고 45mg/kg/일 용량의 이브루티닙은 흡수 및 착상 후 손실 증가와 관련이 있었습니다. 토끼에서 15mg/kg/일 용량은 420mg 용량을 투여받은 CLL/SLL 또는 WM 환자의 노출량의 약 2.8배입니다.
8.2
수유
위험 요약
모유에서 이브루티닙 또는 이의 대사산물의 존재, 모유 수유 유아에 대한 영향 또는 모유 생산에 대한 영향에 대한 정보는 없습니다. 모유 수유 유아에게 심각한 부작용이 발생할 가능성이 있으므로 IMBRUVICA로 치료하는 동안 및 마지막 용량을 투여한 후 1주일 동안은 모유 수유를 하지 않도록 여성에게 조언하십시오.
8.3
가임 여성 및 남성
IMBRUVICA는 임산부에게 투여 시 태아에게 해를 끼칠 수 있습니다 [특정 집단에서의 사용 참조(8.1)].
임신 검사
IMBRUVICA 치료를 시작하기 전에 가임 여성의 임신 여부를 확인하십시오.
피임
여성
가임 여성에게 IMBRUVICA 치료 중 및 마지막 용량 투여 후 1개월 동안 효과적인 피임법을 사용하도록 조언하십시오.
남성
가임 여성 파트너가 있는 남성에게 IMBRUVICA 치료 중 및 마지막 용량 투여 후 1개월 동안 효과적인 피임법을 사용하도록 조언하십시오.
8.4
소아 사용
만성 GVHD
IMBRUVICA의 안전성과 유효성은 1세 이상의 소아 환자에서 하나 이상의 전신 요법 실패 후 cGVHD 치료에 대해 확립되었습니다.
이 적응증에 대한 IMBRUVICA의 사용은 이전에 치료받은 cGVHD가 있는 1세 이상의 소아 환자(1세 이상 2세 미만 1명, 2세 이상 12세 미만 20명, 12세 이상 17세 미만 19명 포함)를 대상으로 한 iMAGINE 연구의 증거에 의해 뒷받침됩니다. 추가적인 지원 효능 데이터는 성인 대상 연구 1129에서 얻었습니다. [부작용(6.1), 임상 약리학(12.3), 임상 연구(14.3) 참조].
12세 이상 환자에서 IMBRUVICA의 권장 용량은 성인과 동일하며, 1세 이상 12세 미만 환자에서 권장 용량은 체표면적(BSA)을 기준으로 합니다. [용량 및 투여(2.1) 참조].
1세 미만의 소아 환자에서 이 적응증에 대한 IMBRUVICA의 안전성과 유효성은 확립되지 않았습니다.
성숙 B세포 비호지킨 림프종
화학면역요법과 병용한 IMBRUVICA의 안전성과 유효성은 이전에 치료받은 성숙 B세포 비호지킨 림프종 환자 35명(5세 이상 17세 미만의 소아 환자 26명 포함)을 대상으로 한 공개 라벨 무작위 연구(NCT02703272)를 기반으로 평가되었지만 확립되지는 않았습니다. 이 연구는 무효성으로 인해 중단되었습니다. 무작위 배정된 환자군에서 주요 출혈 및 부작용으로 인한 화학면역요법 중단은 화학면역요법 단독군에 비해 이브루티닙 + 화학면역요법군에서 더 자주 발생했습니다.
CLL/SLL, 17p 결손이 있는 CLL/SLL, WM
소아 환자에서 CLL/SLL, 17p 결손이 있는 CLL/SLL 또는 WM에 대한 IMBRUVICA의 안전성과 유효성은 확립되지 않았습니다.
8.5
노인용
B 세포 악성종양 또는 cGVHD에 대한 IMBRUVICA 임상 연구에 참여한 992명의 환자 중 62%가 65세 이상이었고 22%가 75세 이상이었습니다. [임상 연구 참조 (14.1, 14.2, 14.3)]. 연령대별 유효성의 전반적인 차이는 관찰되지 않았습니다. IMBRUVICA로 치료받은 노년층 환자에서 빈혈(모든 등급), 폐렴(3등급 이상), 혈소판감소증, 고혈압, 심방세동이 더 자주 발생했습니다. [부작용 참조 (6.1)].
8.6
간 손상
B 세포 악성종양 성인 환자
중증 간 손상(Child-Pugh 등급 C) 환자에게는 IMBRUVICA 사용을 피하십시오. Child-Pugh 기준에 따라 경증에서 중증의 간 손상이 있는 환자에서는 IMBRUVICA의 안전성이 평가되지 않았습니다.
경증 또는 중등도 간 손상(Child-Pugh 등급 A 및 B) 환자에게 IMBRUVICA를 투여할 때는 권장 용량을 줄이십시오. IMBRUVICA의 부작용에 대해 환자를 더 자주 모니터링하십시오. [용량 및 투여 참조 (2.4), 임상 약리학 (12.3)].
cGVHD 환자
총 빌리루빈 수치가 3 x ULN을 초과하는 환자에게는 IMBRUVICA 사용을 피하십시오(비간성 원인이거나 길버트 증후군으로 인한 경우 제외). 총 빌리루빈 수치가 1.5~3 x ULN인 환자에게 IMBRUVICA를 투여할 때는 권장 용량을 줄이십시오(비간성 원인이거나 길버트 증후군으로 인한 경우 제외). [용량 및 투여 참조 (2.4)].
10
과량투여
환자에서 ibrutinib 과량투여 관리에 대한 구체적인 경험은 없습니다. 한 명의 건강한 피험자가 1680 mg을 투여받은 후 가역적인 Grade 4 간 효소 증가(AST 및 ALT)를 경험했습니다. 권장 복용량을 초과하여 복용하는 환자를 면밀히 모니터링하고 적절한 지지 요법을 제공하십시오.
12
임상 약리학
12.1
작용 기전
Ibrutinib는 Bruton’s tyrosine kinase (BTK)의 소분자 억제제입니다. Ibrutinib는 BTK 활성 부위의 시스테인 잔기와 공유 결합을 형성하여 BTK 효소 활성을 억제합니다. BTK는 B 세포 항원 수용체(BCR) 및 사이토카인 수용체 경로의 신호 분자입니다. B 세포 표면 수용체를 통한 신호 전달에서 BTK의 역할은 B 세포 이동, 화학 주성 및 부착에 필요한 경로를 활성화하는 것입니다. 비임상 연구에 따르면 ibrutinib는 *in vivo*에서 악성 B 세포 증식 및 생존을 억제하고 *in vitro*에서 세포 이동 및 기질 부착을 억제하는 것으로 나타났습니다.
12.2
약력학
재발성 B 세포 림프종 환자에서 ibrutinib 용량 ≥ 2.5mg/kg/일(평균 체중 70kg의 경우 ≥ 175mg/일) 투여 후 최대 24시간 동안 말초혈 단핵 세포에서 BTK 활성 부위의 90% 이상 점유율이 관찰되었습니다.
cGVHD 성인 환자에서 권장 ibrutinib 용량으로 말초혈 단핵 세포에서 BTK 활성 부위의 93% 점유율이 관찰되었습니다. 소아 환자의 평균 BTK 점유율은 95.1~99.6%였습니다.
시험관 내 혈소판 응집
Ibrutinib는 콜라겐에 의해 유도된 혈소판 응집 억제를 보였으며, 건강한 기증자, 와파린을 복용하는 기증자 및 중증 신기능 장애가 있는 기증자의 혈액 샘플에서 IC50 값은 각각 4.6μM(2026ng/mL), 0.8μM(352ng/mL) 및 3μM(1321ng/mL)였습니다. Ibrutinib는 ADP, 아라키돈산, 리스토세틴 및 TRAP-6에 대한 혈소판 응집의 유의미한 억제를 보이지 않았습니다.
심장 전기 생리학
최대 권장 용량(1680mg)의 4배 용량을 단회 투여했을 때 IMBRUVICA는 임상적으로 관련된 정도까지 QT 간격을 연장하지 않았습니다.
12.3
약동학
B 세포 악성종양 환자에서 ibrutinib 노출은 최대 840mg(최대 승인 권장 용량의 2배)까지 용량에 따라 증가합니다. CLL/SLL 환자에서 420mg으로 관찰된 평균 정상 상태 AUC(변동 계수 %)는 708(71%)ng×시간/mL이고, WM의 경우 707(72%)ng×시간/mL이고, 이전에 치료받은 cGVHD 성인 환자의 경우 1159(50%)ng×시간/mL입니다. CYP3A 억제제를 사용하지 않은 ibrutinib의 정상 상태 농도는 420mg을 1일 여러 회 1주일 동안 투여한 후 1~1.6의 축적 비율로 달성되었습니다.
흡수
공복 상태에서 ibrutinib의 절대 생체이용률은 건강한 피험자에서 2.9%(90% CI: 2.1, 3.9)였습니다. Ibrutinib는 경구 투여 후 1~2시간의 평균 Tmax 값으로 흡수됩니다.
음식물의 영향
고지방 고칼로리 식사(800~1,000칼로리, 총 칼로리 함량의 약 50%가 지방)와 함께 IMBRUVICA를 투여한 경우 ibrutinib Cmax가 밤새 금식한 후 ibrutinib를 투여한 경우에 비해 2~4배, AUC는 약 2배 증가했습니다.
시험관 내 연구에 따르면 ibrutinib는 p-당단백질(P-gp) 또는 유방암 저항성 단백질(BCRP)의 기질이 아닙니다.
분포
*In vitro*에서 ibrutinib의 인간 혈장 단백질에 대한 가역적 결합은 97.3%였으며, 50ng/mL~1000ng/mL 범위에서 농도 의존성이 없었습니다. 분포 용적(Vd)은 683L였고, 정상 상태에서 겉보기 분포 용적(Vd,ss/F)은 약 10,000L였습니다.
제거
정맥 클리어런스는 공복 상태에서 62L/시간, 식후 상태에서 76L/시간이었습니다. 높은 초회 통과 효과와 일치하게, 겉보기 경구 클리어런스는 공복 상태에서 2000L/시간, 식후 상태에서 1000L/시간입니다. Ibrutinib의 반감기는 4~6시간입니다.
대사
대사는 ibrutinib 제거의 주요 경로입니다. 주로 사이토크롬 P450(CYP) 3A에 의해, 그리고 CYP2D6에 의해 적은 양이 여러 대사체로 대사됩니다. 활성 대사체인 PCI-45227은 ibrutinib보다 BTK에 대한 억제 활성이 약 15배 낮은 디하이드로디올 대사체입니다. 정상 상태에서 PCI-45227의 평균 대사체 대 모 약물 비율 범위는 1~2.8입니다.
배설
Ibrutinib는 주로 대사체 형태로 대변을 통해 주로 제거됩니다. 방사성 표지된 ibrutinib를 1회 경구 투여한 후 방사능의 90%가 168시간 이내에 배설되었으며, 80%는 대변으로, 10% 미만은 소변으로 배설되었습니다. 변형되지 않은 ibrutinib는 대변으로 배설된 방사성 표지 용량의 1%를 차지했으며 소변에서는 검출되지 않았으며, 배설된 용량의 나머지는 대사체였습니다.
특정 집단
연령 및 성별
연령 및 성별은 ibrutinib 약동학에 임상적으로 유의미한 영향을 미치지 않습니다.
신장애 환자
경도 및 중등도 신장애(Cockcroft-Gault 방정식으로 추정한 크레아티닌 청소율[CLcr] > 25mL/분)는 ibrutinib 노출에 영향을 미치지 않았습니다. 중증 신장애(CLcr < 25mL/분) 환자 또는 투석 환자에 대한 데이터는 없습니다.
간 장애 환자
Ibrutinib의 AUC는 정상 간 기능을 가진 피험자에 비해 경도 간 장애(Child-Pugh 등급 A) 피험자에서 2.7배, 중등도 간 장애(Child-Pugh 등급 B) 피험자에서 8.2배, 중증 간 장애(Child-Pugh 등급 C) 피험자에서 9.8배 증가했습니다. Ibrutinib의 Cmax는 정상 간 기능을 가진 피험자에 비해 경도 간 장애에서 5.2배, 중등도 간 장애에서 8.8배, 중증 간 장애에서 7배 증가했습니다 *[특정 집단에서의 사용(8.6) 참조].
소아 환자
1일 1회 ibrutinib 240mg/m2(≥ 1세~< 12세 환자) 또는 1일 1회 420mg(≥ 12세 환자)으로 치료받은 cGVHD 소아 환자에서 ≥ 1세~< 12세 환자의 기하 평균(CV%) 정상 상태 AUC 및 Cmax는 각각 467(102%)ng×시간/mL 및 65.7(96%)ng/mL이고, ≥ 12세~< 17세 환자의 경우 각각 966(78%)ng×시간/mL 및 149(79%)ng/mL입니다.
약물 상호 작용 연구
임상 연구 및 모델 정보 접근 방식
이브루티닙에 대한 CYP3A 억제제의 영향: 케토코나졸(강력한 CYP3A 억제제)을 여러 차례 투여하면 이브루티닙의 Cmax가 29배, AUC는 24배 증가했습니다. 보리코나졸(강력한 CYP3A 억제제)을 여러 차례 투여하면 이브루티닙의 항정 상태 Cmax가 6.7배, AUC는 5.7배 증가했습니다. 식후 상태에서 시뮬레이션한 결과, 포사코나졸(강력한 CYP3A 억제제)은 이브루티닙의 AUC를 3배에서 10배까지 증가시킬 수 있는 것으로 나타났습니다.
에리스로마이신(중간 정도의 CYP3A 억제제)을 여러 차례 투여하면 이브루티닙의 항정 상태 Cmax가 3.4배, AUC는 3배 증가했습니다.
이브루티닙에 대한 CYP3A 유도제의 영향: 리팜핀(강력한 CYP3A 유도제)을 병용 투여하면 이브루티닙의 Cmax가 13배 이상, AUC는 10배 이상 감소했습니다. 시뮬레이션 결과, 에파비렌즈(중간 정도의 CYP3A 유도제)는 이브루티닙의 AUC를 3배 감소시킬 수 있는 것으로 나타났습니다.
체외 연구
CYP 기질에 대한 이브루티닙의 영향: 체외 연구 결과에 따르면, 이브루티닙과 PCI-45227은 임상 용량에서 CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6 또는 3A를 억제할 가능성이 낮습니다. 이브루티닙과 PCI-45227 모두 임상 용량에서 CYP1A2, CYP2B6 또는 CYP3A를 유도할 가능성이 낮습니다.
수송체 기질에 대한 이브루티닙의 영향: 체외 연구 결과에 따르면, 이브루티닙은 임상 용량에서 BCRP 및 P-gp 수송을 억제할 수 있습니다. 경구용 P-gp 또는 BCRP 기질(예: 디곡신, 메토트렉세이트)을 IMBRUVICA와 병용 투여하면 이러한 기질의 농도가 증가할 수 있습니다.
13
비임상 독성학
13.1
발암성, 돌연변이 유발성, 생식능력 손상
Ibrutinib는 최대 2000mg/kg/day까지 경구 투여 시 6개월 rasH2 마우스 연구에서 발암성을 나타내지 않았으며, 이는 420mg을 매일 투여한 사람에서의 노출보다 약 32배(수컷)에서 52배(암컷) 더 높은 노출을 가져왔습니다. [5.6 경고 및 주의사항 참조].
Ibrutinib는 박테리아 돌연변이 유발성(Ames) 분석에서 돌연변이 유발성을 나타내지 않았고, 포유류(CHO) 세포의 염색체 이상 분석에서 염색체 이상 유발성을 나타내지 않았으며, 최대 2000mg/kg까지 용량에서 마우스의 생체 내 골수 소핵 분석에서 염색체 이상 유발성을 나타내지 않았습니다.
랫트에게 교배 전 4주 동안과 수컷의 경우 교배 중, 암컷의 경우 교배 전 2주 동안과 교배 중에 ibrutinib를 매일 경구 투여했습니다. 암컷 랫트의 경우 임신 7일(GD)까지 투여를 계속했고, 수컷 랫트의 경우 연구 종료 시까지 투여를 계속했습니다. 최대 용량인 100mg/kg/day(HED 16mg/kg)까지 수컷 또는 암컷 랫트에서 생식능력 또는 생식 능력에 대한 영향이 관찰되지 않았습니다.
14
임상 연구
14.1
만성 림프구성 백혈병 / 소림프구성 림프종
IMBRUVICA의 CLL/SLL 환자에 대한 안전성 및 유효성은 한 건의 비대조 시험과 다섯 건의 무작위 대조 시험에서 입증되었습니다.
연구 1102
공개 라벨, 다기관 시험인 연구 1102(NCT01105247)는 이전에 치료받은 CLL 환자 48명을 대상으로 수행되었습니다. IMBRUVICA는 질병 진행 또는 허용 불가능한 독성이 나타날 때까지 1일 1회 420mg을 경구 투여했습니다. ORR 및 DOR은 독립 검토 위원회에서 CLL 국제 워크숍 기준의 수정된 버전을 사용하여 평가했습니다.
평균 연령은 67세(범위: 37~82세)였고, 71%가 남성이었으며, 94%가 백인이었습니다. 모든 환자의 기준 ECOG 수행 상태는 0 또는 1이었습니다. 진단 후 평균 시간은 80개월이었고 이전 치료 횟수의 평균은 4회(범위: 1~12회)였습니다. 기준 시점에서 대상의 46%에서 하나 이상의 종양 크기가 5cm 이상이었습니다.
ORR은 58.3%(95% CI: 43.2%, 72.4%)였고, 모두 부분 반응이었습니다. 완전 반응을 달성한 환자는 없었습니다. DOR은 5.6~24.2+개월이었습니다. DOR 중앙값에 도달하지 못했습니다.
RESONATE
무작위 배정, 다기관, 공개 라벨, 3상 시험인 RESONATE 연구(NCT01578707)는 이전에 치료받은 CLL 또는 SLL 환자를 대상으로 IMBRUVICA와 오파투무맙을 비교하여 수행되었습니다. 환자(n=391)는 질병 진행 또는 허용 불가능한 독성이 나타날 때까지 1일 1회 IMBRUVICA 420mg을 투여받거나, 초기 용량 300mg의 오파투무맙을 투여받은 후 1주일 후 7회 용량 동안 매주 2000mg을 투여받고 이후 4회 용량 동안 4주마다 투여받도록 1:1로 무작위 배정되었습니다. 오파투무맙으로 무작위 배정된 57명의 환자는 진행 후 IMBRUVICA를 투여받기 위해 교차 연구에 참여했습니다.
평균 연령은 67세(범위: 30~88세)였고, 68%가 남성이었으며, 90%가 백인이었습니다. 모든 환자의 기준 ECOG 수행 상태는 0 또는 1이었습니다. 이 시험에는 CLL 환자 373명과 SLL 환자 18명이 등록되었습니다. 진단 후 평균 시간은 91개월이었고 이전 치료 횟수의 평균은 2회(범위: 1~13회)였습니다. 기준 시점에서 환자의 58%에서 하나 이상의 종양 크기가 5cm 이상이었습니다. 환자의 32%에게서 17p 결손이 나타났습니다.
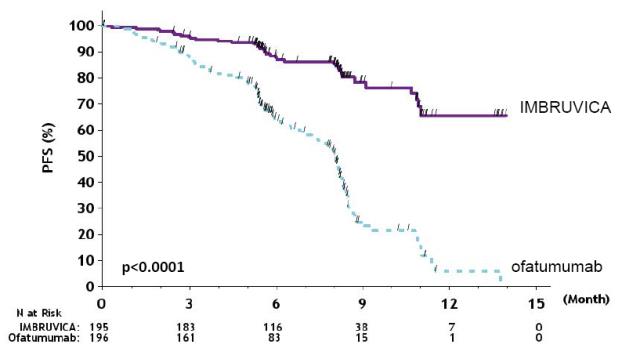
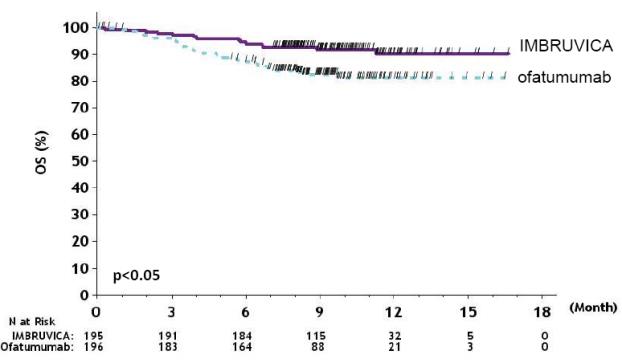
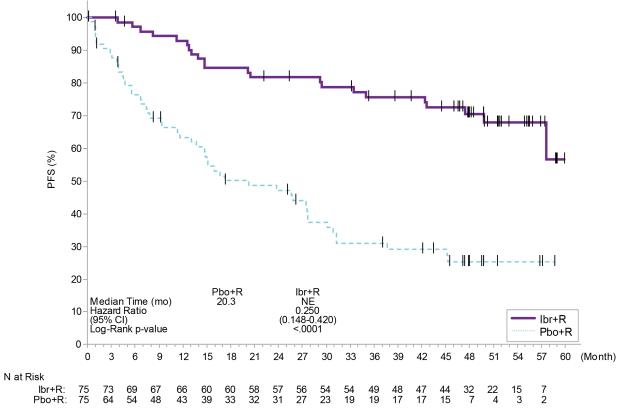
RESONATE의 유효성 결과는 표 22에 나와 있고, IWCLL 기준에 따라 IRC에서 평가한 PFS 및 OS에 대한 카플란-마이어 곡선은 각각 그림 1과 그림 2에 나와 있습니다.
| 평가 변수 | IMBRUVICA N=195 |
오파투무맙 N=196 |
| 무진행–생존b | ||
| 이상 반응 수 (%) | 35 (17.9) | 111 (56.6) |
| 질병 진행 | 26 | 93 |
| 사망 사례 | 9 | 18 |
| 중앙값(95% CI), 개월 | NE | 8.1 (7.2, 8.3) |
| HR (95% CI) | 0.22 (0.15, 0.32) | |
| 전체 생존a | ||
| 사망자 수 (%) | 16 (8.2) | 33 (16.8) |
| HR (95% CI) | 0.43 (0.24, 0.79) | |
| 전체 반응률b | 42.6% | 4.1% |
a
두 군 모두에서 중앙 OS를 평가할 수 없습니다.
b
IRC 평가. 모든 부분 반응 달성; 완전 반응을 달성한 환자는 없었습니다.
CI = 신뢰 구간, HR = 위험 비율, NE = 평가 불가능.
그림 1: RESONATE에서 CLL/SLL 환자의 무진행 생존율(ITT 모집단)의 카플란-마이어 곡선
그림 2: RESONATE에서 CLL/SLL 환자의 전체 생존율(ITT 모집단)의 카플란-마이어 곡선
63개월 추적 관찰
63개월의 전체 추적 관찰 기간 동안 IWCLL 기준에 따라 평가한 연구자 평가 PFS 중앙값은 IMBRUVICA군에서 44.1개월[95% CI (38.5, 56.9)]이었고 오파투무맙군에서는 8.1개월[95% CI (7.8, 8.3)]이었습니다. 연구자들이 평가한 전체 반응률은 IMBRUVICA군에서 87.2%, 오파투무맙군에서 22.4%였습니다.
RESONATE의 17p 결손이 있는 CLL/SLL(del 17p CLL/SLL)
RESONATE에는 del 17p CLL/SLL 환자 127명이 포함되었습니다. 평균 연령은 67세(범위 30~84세)였고, 62%는 남성이었고 88%는 백인이었습니다. 모든 환자의 기준 ECOG 수행 상태는 0 또는 1이었습니다. PFS 및 ORR은 IRC에 의해 평가되었습니다. del 17p CLL/SLL에 대한 효능 결과는 표 23에 나와 있습니다.
| 평가 변수 | IMBRUVICA N=63 |
오파투무맙 N=64 |
| 무진행 생존율a | ||
| 이벤트 수(%) | 16 (25.4) | 38 (59.4) |
| 질병 진행 | 12 | 31 |
| 사망 사건 | 4 | 7 |
| 중앙값(95% CI), 개월 | NE | 5.8 (5.3, 7.9) |
| HR (95% CI) | 0.25 (0.14, 0.45) | |
| 전체 반응률a | 47.6% | 4.7% |
a
IRC 평가. 모든 부분 반응 달성, 환자 중 누구도 완전 반응에 도달하지 못함.
CI = 신뢰 구간, HR = 위험 비율, NE = 평가 불가능.
63개월 추적 관찰
전체 추적 관찰 기간 63개월 동안 IWCLL 기준에 따라 del 17p가 있는 환자의 연구자 평가 PFS 중앙값은 IMBRUVICA군에서 40.6개월[95% CI (25.4, 44.6)]이었고 오파투무맙군에서는 6.2개월[95% CI (4.6, 8.1)]이었습니다. del 17p가 있는 환자의 연구자 평가 전체 반응률은 IMBRUVICA군에서 88.9%, 오파투무맙군에서 18.8%였습니다.
RESONATE-2
RESONATE-2 연구는 치료 경험이 없는 CLL 또는 SLL 환자(65세 이상)를 대상으로 IMBRUVICA와 클로람부실을 비교한 무작위 배정, 다기관, 공개 라벨, 3상 연구입니다(NCT01722487). 환자(n = 269)는 질병 진행 또는 허용할 수 없는 독성이 나타날 때까지 IMBRUVICA 420mg을 매일 투여받는 군 또는 각 28일 주기의 1일차와 15일차에 클로람부실을 0.5mg/kg의 시작 용량으로 최대 12주기 동안 투여받는 군(내약성에 따라 최대 0.8mg/kg까지 환자 내 용량 증량 허용)으로 1:1 무작위 배정되었습니다.
평균 연령은 73세(범위: 65~90세)였으며, 63%가 남성이었고 91%가 백인이었습니다. 환자의 91%가 기준 ECOG 수행 상태가 0 또는 1이었고 9%가 2였습니다. 이 임상시험에는 CLL 환자 249명과 SLL 환자 20명이 등록되었습니다. 기준에서 환자의 20%에게서 11q 결손이 나타났습니다. CLL 치료를 시작하게 된 가장 흔한 이유는 다음과 같습니다. 빈혈 및/또는 혈소판 감소증으로 나타나는 진행성 골수 부전(38%), 진행성 또는 증상성 림프절병증(37%), 진행성 또는 증상성 비장비대(30%), 피로(27%), 식은땀(25%).
중앙값 28.1개월의 추적 관찰 결과, 관찰된 사망 사례는 32건이었습니다[IMBRUVICA 치료군 11건(8.1%) 및 클로람부실 치료군 21건(15.8%)]. 클로람부실에서 IMBRUVICA로 전환한 환자가 41%였던 점을 감안했을 때, ITT 환자 모집단의 전체 생존 분석 결과 통계적으로 유의미한 HR 0.44[95% CI (0.21, 0.92)]가 나타났고, IMBRUVICA군과 클로람부실군의 2년 생존율 추정치는 각각 94.7%[95% CI (89.1, 97.4)] 및 84.3%[95% CI (76.7, 89.6)]였습니다.
RESONATE-2의 유효성 결과는 24 표에 나와 있으며, IWCLL 기준에 따라 IRC에서 평가한 PFS에 대한 카플란-마이어 곡선은 3 그림에 나와 있습니다.
| 평가 변수 | IMBRUVICA N=136 |
클로람부실 N=133 |
| 무진행–생존a | ||
| 사례 수(%) | 15 (11.0) | 64 (48.1) |
| 질병 진행 | 12 | 57 |
| 사망 사례 | 3 | 7 |
| 중앙값(95% CI), 개월 | NE | 18.9 (14.1, 22.0) |
| HRb (95% CI) | 0.16 (0.09, 0.28) | |
| 전체 반응률a (CR + PR) | 82.4% | 35.3% |
| P-값 | <0.0001 | |
a
IRC 평가; IMBRUVICA 군의 피험자 5명(3.7%)과 Chlorambucil 군의 피험자 2명(1.5%)이 완전 반응에 도달했습니다.
b
HR = 위험 비율, NE = 평가 불가
그림 3: RESONATE-2의 CLL/SLL 환자에서 무진행 생존의 카플란-마이어 곡선(ITT 모집단)
55개월 추적 관찰
55개월의 전체 추적 관찰 기간 동안 IMBRUVICA 군에서 PFS 중앙값에 도달하지 못했습니다.
HELIOS
이전에 치료를 받은 CLL 또는 SLL 환자를 대상으로 IMBRUVICA와 벤다무스틴 및 리툭시맙(BR) 병용 요법을 무작위 배정, 이중맹검, 위약 대조 방식으로 평가한 3상 연구인 HELIOS 연구(NCT01611090)가 수행되었습니다. 환자(n = 578)는 질병 진행 또는 허용 불가능한 독성이 발생할 때까지 IMBRUVICA 420mg을 매일 1회 투여하거나 위약을 BR과 병용하여 1:1로 무작위 배정되었습니다. 모든 환자는 최대 6회의 28일 주기 동안 BR을 투여받았습니다. 벤다무스틴은 주기 1, 2일 및 3일째에 30분에 걸쳐 70mg/m2을 정맥 내로 주입하고 주기 2~6, 1일 및 2일째에 최대 6회 주기 동안 투여했으며 모든 환자는 기준 시점에서 CLcr ≥ 40mL/min이었습니다. 리툭시맙은 첫 번째 주기 1일째에 375mg/m2 용량으로 투여했고 2~6주기 1일째에 500mg/m2 용량으로 투여했습니다.
평균 연령은 64세(범위, 31~86세)였으며 66%는 남성이었고 91%는 백인이었습니다. 모든 환자의 기준 시점 ECOG 수행 상태는 0 또는 1이었습니다. 진단 후 평균 시간은 5.9년이었고 이전 치료 횟수의 중앙값은 2회(범위, 1~11회 치료)였습니다. 기준 시점에서 환자의 56%에서 하나 이상의 종양이 > 5cm였고 26%는 del11q를 보였습니다.
HELIOS에 대한 유효성 결과는 표 25에 나와 있으며 PFS에 대한 카플란-마이어 곡선은 그림 4에 나와 있습니다.
| 평가 변수 | IMBRUVICA + BR N=289 |
위약 + BR N=289 |
| 무진행–생존a | ||
| 이벤트 수 (%) | 56 (19.4) | 183 (63.3) |
| 중앙값(95% CI), 개월 | NE | 13.3 (11.3, 13.9) |
| HR (95% CI) | 0.20 (0.15, 0.28) | |
| 전체 반응률a | 82.7% | 67.8% |
a
IRC 평가, IMBRUVICA + BR군의 피험자 24명(8.3%)과 위약 + BR군의 피험자 6명(2.1%)이 완전 반응에 도달했습니다.
BR = 벤다무스틴 및 리툭시맙, CI = 신뢰 구간, HR = 위험 비율, NE = 평가 불가능
그림 4: HELIOS의 CLL/SLL 환자에서 무진행 생존의 카플란-마이어 곡선(ITT 모집단)
iLLUMINATE
무작위배정, 다기관, 3상 연구인 iLLUMINATE 연구(NCT02264574)는 오비누투주맙과 병용한 IMBRUVICA와 클로람부실과 병용한 IMBRUVICA를 치료받지 않은 CLL 또는 SLL 환자를 대상으로 수행되었습니다. 환자는 65세 이상이거나, <65세이고 동반 질환이 있거나, 크레아티닌 청소율 <70mL/분으로 측정했을 때 신장 기능이 저하되었거나, del 17p/TP53 돌연변이가 있는 환자였습니다. 환자(n = 229)를 1:1로 무작위 배정하여 질병 진행 또는 허용 불가능한 독성이 나타날 때까지 IMBRUVICA 420mg을 매일 투여하거나, 28일 주기로 6주기 동안 주기 1일과 15일에 0.5mg/kg 용량의 클로람부실을 투여했습니다. 두 군 모두 첫 번째 주기 1일, 8일, 15일에 1,000mg의 오비누투주맙을 투여받았고, 그 후 5회의 후속 주기 첫날에 치료를 받았습니다(총 6회 주기, 각 28일). 오비누투주맙의 첫 번째 용량은 1일차(100mg)와 2일차(900mg)로 나누어 투여했습니다.
평균 연령은 71세(범위, 40~87세)였고, 64%가 남성이었으며, 96%가 백인이었습니다. 모든 환자의 기준 ECOG 수행 상태는 0(48%) 또는 1-2(52%)였습니다. 이 임상시험에는 CLL 환자 214명과 SLL 환자 15명이 등록했습니다. 기준선에서 환자의 65%가 고위험 인자[del 17p/TP53 돌연변이(18%), del 11q(15%) 또는 돌연변이되지 않은 면역글로불린 중쇄 가변 영역(돌연변이되지 않은 IGHV)(54%)]를 가진 CLL/SLL를 가지고 있었습니다. CLL 치료를 시작한 가장 흔한 이유는 림프절병증(38%), 식은땀(34%), 진행성 골수 부전(31%), 피로(29%), 비장 비대(25%), 진행성 림프구 증가증(21%)이었습니다.
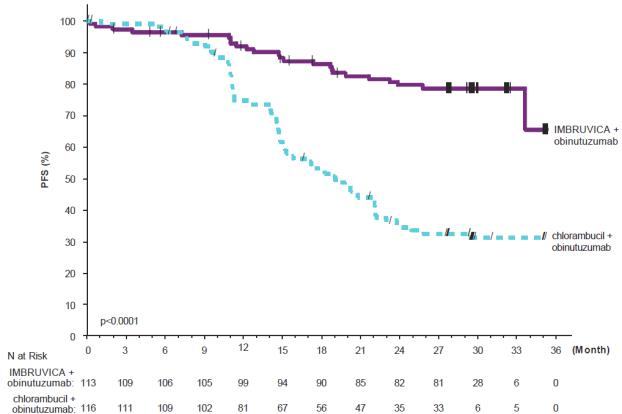
31개월의 중간 연구 추적 기간 동안 IWCLL 기준에 따른 IRC에서 평가한 iLLUMINATE의 효능 결과는 표 26에 나와 있고, PFS에 대한 카플란-마이어 곡선은 그림 5에 나와 있습니다.
| 평가변수 | IMBRUVICA + 오비누투주맙 N=113 |
클로람부실 + 오비누투주맙 N=116 |
| 무진행 생존a | ||
| 이상반응 수(%) | 24 (21) | 74 (64) |
| 질병 진행 | 11 | 64 |
| 사망 사례 | 13 | 10 |
| 평균(95% CI), 개월 | NE | 19.0 (15.1, 22.1) |
| HR (95% CI) | 0.23 (0.15, 0.37) | |
| P-값b | <0.0001 | |
| 전체 반응률(%)a | 88.5 | 73.3 |
| CRc (%) | 19.5 | 7.8 |
| PRd (%) | 69.0 | 65.5 |
a IRC-평가.
b P-값은 계층화되지 않은 로그 순위 검정에서 가져왔습니다.
c 골수 회복이 불완전한 완전 반응(CRi)을 보인 IMBRUVICA + 오비누투주맙 군의 환자 1명 포함
d PR = nPR +PR.
HR = 위험 비율, NE = 평가 불가.
그림 5: iLLUMINATE 연구의 CLL/SLL 환자에서 무진행 생존율의 카플란-마이어 곡선(ITT 집단)
고위험 CLL/SLL 집단(del 17p/TP53 돌연변이, del 11q 또는 돌연변이되지 않은 IGHV)에서 PFS HR은 0.15였습니다[95% CI (0.09, 0.27)].
E1912
E1912 연구는 전신 치료가 필요한 이전에 치료받지 않은 CLL 또는 SLL 성인 환자 70세 이하를 대상으로 IMBRUVICA와 리툭시맙 병용 요법을 표준 플루다라빈, 사이클로포스파미드, 리툭시맙(FCR) 화학 면역 요법과 비교한 무작위 배정, 다기관, 3상 연구였습니다(NCT02048813). 모든 환자의 기준선에서 CLcr이 40mL/min 이상이었습니다. 17p 결손이 있는 환자는 제외되었습니다. 환자(n =529)는 IMBRUVICA + 리툭시맙 또는 FCR을 투여받도록 2:1로 무작위 배정되었습니다. IMBRUVICA는 질병 진행이나 허용할 수 없는 독성이 나타날 때까지 매일 420mg을 투여했습니다. 플루다라빈은 25mg/m2 용량으로, 사이클로포스파미드는 250mg/m2 용량으로 1~6주기의 1, 2, 3일에 투여했습니다. 리툭시맙은 IMBRUVICA + 리툭시맙 군에서는 2주기에, FCR 군에서는 1주기에 시작했으며, 첫 번째 주기의 1일에는 50mg/m2, 첫 번째 주기의 2일에는 325mg/m2, 이후 5회 주기의 1일에는 500mg/m2을 투여하여 총 6회 주기를 진행했습니다. 각 주기는 28일이었습니다.
평균 연령은 58세(범위: 28~70세)였고, 67%는 남성이었으며, 90%는 백인이었고, 98%는 ECOG 수행 상태가 0~1이었습니다. 기준선에서 환자의 43%는 Rai 병기 3기 또는 4기였고 환자의 59%는 고위험 인자[TP53 돌연변이(6%), del11q(22%) 또는 돌연변이되지 않은 IGHV(53%)]를 가지고 있었습니다.
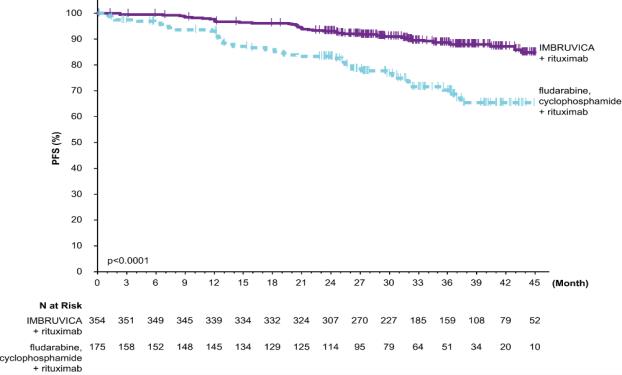
37개월의 연구 중간 추적 관찰 기간 동안 E1912의 효능 결과는 표 27에 나와 있습니다. IWCLL 기준에 따라 평가한 PFS에 대한 카플란-마이어 곡선은 그림 6에 나와 있습니다.
| 평가 변수 | IMBRUVICA + R N=354 |
FCR N=175 |
| 무진행–생존율 | ||
| 사건 수(%) | 41 (12) | 44 (25) |
| 질병 진행 | 39 | 38 |
| 사망 사건 | 2 | 6 |
| 중앙값(95% CI), 개월 | NE (49.4, NE) | NE (47.1, NE) |
| HR (95% CI) | 0.34 (0.22, 0.52) | |
| P-값a | <0.0001 | |
a P-value는 분류되지 않은 로그-랭크 검정에서 나온 값입니다.
FCR = 플루다라빈, 사이클로포스파미드, 리툭시맙; HR = 위험 비율; R = 리툭시맙; NE = 평가 불가.
그림 6: E1912에서 CLL/SLL 환자의 무진행 생존율에 대한 Kaplan-Meier 곡선 (ITT 집단)
연구 시작 후 평균 추적 기간이 49개월일 때, 전체 생존 기간의 중앙값은 도달하지 않았으며 총 23건의 사망이 있었습니다: IMBRUVICA와 리툭시맙 병용군 11건 (3%), FCR 치료군 12건 (7%).
림프구증가증
IMBRUVICA 단독 요법 시작 시, CLL 연구에서 환자의 66%에서 림프구 수가 증가했습니다 (기준치 대비 50% 이상 증가 및 절대 림프구 수 5,000/mcL 이상). 림프구증가증은 IMBRUVICA 치료 시작 후 첫 달에 발생하며 중앙값 14주 (범위, 0.1~104주)에 해결됩니다. IMBRUVICA를 병용 투여할 경우, IMBRUVICA + BR과 위약 + BR에서 림프구증가증은 각각 7%, IMBRUVICA + 오비누투주맙과 클로람부실 + 오비누투주맙에서는 1%였습니다.
14.2
발덴스트롬 마크로글로불린혈증
IMBRUVICA의 안전성과 유효성은 WM 환자를 대상으로 한 두 개의 단일군 시험과 하나의 무작위 대조 시험에서 입증되었습니다.
연구 1118 및 INNOVATE 단독 요법 팔
연구 1118 (NCT01614821), 개방형, 다기관, 단일군 시험은 WM을 앓고 있는 기존 치료 받은 환자 63명을 대상으로 실시되었습니다. IMBRUVICA는 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 매일 420 mg으로 경구 투여되었습니다. 반응은 조사자와 IRC가 발덴스트롬 마크로글로불린혈증에 대한 국제 워크숍에서 채택한 기준을 사용하여 평가되었습니다.
평균 연령은 63세 (범위, 44~86세), 남성이 76%, 백인이 95%였습니다. 모든 환자는 기저 ECOG 성능 상태가 0 또는 1이었습니다. 진단 후 평균 시간은 74개월이었고, 이전 치료의 중앙값은 2회 (범위, 1~11회 치료)였습니다. 기저 시점에서 중앙 혈청 IgM 값은 3.5 g/dL (범위, 0.7~8.4 g/dL)이었습니다.
IRC에 따라 부분 반응 이상으로 정의된 반응은 표 28에 나와 있습니다.
| 총계 (N=63) | |
| 반응률 (CR+VGPR+PR), (%) | 61.9 |
| 95% CI (%) | (48.8, 73.9) |
| 완전 반응 (CR) | 0 |
| 매우 좋은 부분 반응 (VGPR), (%) | 11.1 |
| 부분 반응 (PR), (%) | 50.8 |
| 반응 지속 기간의 중앙값, 개월 (범위) | NE (2.8+, 18.8+) |
| CI = 신뢰 구간; NE = 평가 불가. | |
반응을 보이기까지의 중간값은 1.2개월이었습니다(범위, 0.7~13.4개월).
INNOVATE 단독 요법군에는 이전에 리툭시맙 함유 요법으로 치료받았지만 실패하고 단일 제제 IMBRUVICA를 투여받은 WM 환자 31명이 포함되었습니다. 중간 연령은 67세(범위, 47~90세)였습니다. 환자의 81%가 ECOG 기준 성능 상태가 0 또는 1이었고, 19%가 ECOG 기준 성능 상태가 2였습니다. 이전 치료 횟수의 중간값은 4회(범위, 1~7회)였습니다. 61개월의 전체 추적 관찰 기간 동안 IRC 평가에 따라 INNOVATE 단독 요법군에서 관찰된 반응률은 77%(CR 0%, VGPR 29%, PR 48%)였습니다. 반응 지속 기간의 중간값은 33개월(범위, 2.4~60.2+개월)이었습니다.
INNOVATE
INNOVATE 연구는 치료 경험이 없거나 이전에 치료를 받은 WM 환자를 대상으로 IMBRUVICA 또는 위약을 리툭시맙과 병용한 무작위 배정, 이중맹검, 위약 대조, 3상 연구(NCT02165397)입니다. 환자(n = 150)를 IMBRUVICA 420mg을 1일 1회 또는 위약을 리툭시맙과 병용하여 질병 진행이나 허용할 수 없는 독성이 나타날 때까지 투여받도록 1:1로 무작위 배정했습니다. 리툭시맙은 4주 연속(1~4주) 동안 375mg/m2 용량으로 매주 투여한 후 4주 연속(17~20주) 동안 리툭시맙 두 번째 주기를 매주 투여했습니다. 주요 유효성 결과 측정값은 IRC에서 평가한 무진행 생존 기간(PFS)이며, 추가 유효성 측정값은 반응률입니다.
중간 연령은 69세(범위, 36~89세)였으며, 66%가 남성이었고 79%가 백인이었습니다. 환자의 93%가 ECOG 기준 성능 상태가 0 또는 1이었고, 환자의 7%가 ECOG 기준 성능 상태가 2였습니다. 환자의 45%는 치료 경험이 없었고, 55%는 이전에 치료를 받았습니다. 이전에 치료를 받은 환자의 이전 치료 횟수의 중간값은 2회(범위, 1~6회)였습니다. 기준 시 혈청 IgM 값의 중간값은 3.2g/dL(범위, 0.6~8.3g/dL)였으며, MYD88 L265P 돌연변이는 환자의 77%에서 나타났고, 13%에서는 나타나지 않았으며, 9%는 돌연변이 상태를 평가할 수 없었습니다.
탐색적 분석 결과 IMBRUVICA + R군 환자의 65%와 위약 + R군 환자의 39%에서 지속적인 헤모글로빈 개선(수혈이나 성장 인자 지원 없이 최소 8주 동안 기준치보다 ≥ 2g/dL 증가한 것으로 정의)이 나타났습니다.
전체 추적 관찰 기간이 63개월인 경우 INNOVATE에 대한 최종 분석 시 IRC에서 평가한 유효성 결과는 표 29에 나와 있으며, PFS에 대한 카플란-마이어 곡선은 그림 7에 나와 있습니다.
| 평가 항목 | IMBRUVICA + R N=75 |
위약 + R N=75 |
| 무진행–생존 | ||
| 사건 수(%) | 22 (29) | 50 (67) |
| 중간값(95% CI), 개월 | NE (57.7, NE) | 20.3 (13.0, 27.6) |
| HR(95% CI) | 0.25 (0.15, 0.42) | |
| P값a | <0.0001 | |
| 반응률(CR+VGPR+PR)b | 76% | 31% |
| 95% CI (%) | (65, 85) | (21, 42) |
| 완전 반응(CR) | 1% | 1% |
| 매우 우수한 부분 반응(VGPR) | 29% | 4% |
| 부분 반응(PR) | 45% | 25% |
| 반응 지속 기간의 중간값, 개월(범위) | NE (1.9+, 58.9+) | NE (4.6+, 49.7+) |
CI = confidence interval; HR = hazard ratio; NE = not evaluable; R = rituximab.
a P-value는 계층화 로그 순위 검정에서 비롯됩니다.
b 반응률과 관련된 P-값은 <0.0001입니다.
그림 7: INNOVATE 연구의 WM 환자에서 무진행 생존율의 카플란-마이어 곡선(ITT 집단)
두 치료군 모두에서 전체 생존 기간의 중앙값에 도달하지 못했습니다. 63개월의 전체 추적 관찰 기간 동안 IMBRUVICA + R 치료군의 환자 9명(12%)과 위약 + R 치료군의 환자 10명(13.3%)이 사망했습니다. 위약 + R 치료군에 무작위 배정된 환자의 47%가 IMBRUVICA를 투여받기 위해 교차했습니다.
14.3
만성 이식편대숙주병
연구 1129
1차 코르티코스테로이드 치료에 실패하고 추가 치료가 필요한 cGVHD 환자 42명을 대상으로 한 공개형, 다기관, 단일군 시험인 연구 1129(NCT02195869)에서 IMBRUVICA의 안전성과 유효성을 평가했습니다. IMBRUVICA는 1일 1회 420mg을 경구 투여했습니다. 반응은 2014년 NIH 컨센서스 패널 반응 기준에 맞춰 두 가지 수정된 2005년 미국 국립보건원(NIH) 컨센서스 패널 반응 기준을 사용하여 연구자가 평가했습니다.
평균 연령은 56세(범위: 19~74세)였으며, 52%가 남성이었고 93%가 백인이었습니다. 이식으로 이어진 가장 흔한 기저 악성 종양은 급성 림프구성 백혈병, 급성 골수성 백혈병, CLL이었습니다. cGVHD 진단 후 평균 시간은 14개월이었고, 이전 cGVHD 치료 횟수의 중앙값은 2회(범위: 1~3회 치료)였으며, 환자의 60%가 카르노프스키 수행 상태 점수 ≤ 80점이었습니다. 대부분의 환자(88%)는 기준 시점에 최소 2개의 장기가 관련되었으며, 가장 일반적으로 관련된 장기는 구강(86%), 피부(81%), 위장관(33%)이었습니다. 기준 시점에서 일일 코르티코스테로이드 용량(프레드니손 또는 프레드니손 등가물)의 중앙값은 0.3mg/kg/일이었으며, 환자의 52%는 기준 시점에 전신 코르티코스테로이드 외에도 지속적으로 면역억제제를 투여받고 있었습니다. 감염 예방은 기관 지침에 따라 관리되었으며, 환자의 79%는 설폰아미드와 트리메토프림 병용 요법을 받았고 64%는 트리아졸 유도체를 투여받았습니다.
유효성 결과는 표 30에 나와 있습니다.
| 전체 (N=42) | |
| ORR | 28 (67%) |
| 95% CI | (51%, 80%) |
| 완전 반응 (CR) | 9 (21%) |
| 부분 반응 (PR) | 19 (45%) |
| 지속적 반응률b | 20 (48%) |
| CI = 신뢰 구간. a 두 가지 수정된 2005년 NIH 반응 기준(비 cGVHD 이상이 있는 장기에 대해 “평가 불가” 추가, 장기 점수 변화 0~1은 질병 진행으로 간주하지 않음)에 근거한 연구자 평가 b 지속적 반응률은 최소 20주 동안 지속된 CR 또는 PR에 도달한 환자의 비율로 정의됩니다. |
|
첫 번째 예정된 반응 평가와 동시에 나타나는 반응을 보이기까지의 중간 시간은 12.3주였습니다(범위, 4.1~42.1주). 반응은 cGVHD(피부, 구강, 위장관, 간)와 관련된 모든 기관에서 나타났습니다.
ORR 결과는 환자 보고 증상 불편의 탐색적 분석에 의해 뒷받침되었으며, 이는 최소 2회 연속 방문에서 환자의 24%(10/42)에서 Lee 증상 척도 전체 요약 점수가 최소 7점 감소한 것으로 나타났습니다.
iMAGINE
NIH 합의 기준에 정의된 바와 같이 중등도 또는 중증 cGVHD를 앓고 있는 1세 이상 22세 미만의 소아 및 청소년 환자를 위한 IMBRUVICA의 안전성 및 유효성이 개방형, 다기관, 단일군 시험인 iMAGINE(NCT03790332)에서 평가되었습니다. 이 연구에는 한 가지 이상의 이전 전신 요법 실패 후 추가 요법이 필요한 47명의 환자가 포함되었습니다. 모든 환자의 혈소판 수치는 ≥ 30 x 109/L, 절대 호중구 수는 ≥ 1.0 x 109/L, AST 또는 ALT는 ≤ 3 x ULN, 총 빌리루빈 수치는 ≤ 1.5 x ULN, 예상 크레아티닌 청소율은 ≥ 30mL/min였습니다. 단일 기관 비뇨생식기 관련 증상만 cGVHD의 증상으로 나타난 환자는 제외되었습니다.
12세 이상의 환자는 IMBRUVICA 420mg을 1일 1회 경구 투여받았으며, 1세 이상 12세 미만의 환자는 IMBRUVICA 240mg/m2을 1일 1회 경구 투여받았습니다. cGVHD에 대한 지지 요법과의 병용 치료가 허용되었습니다. 연구 중 새로운 전신 cGVHD 요법의 시작은 허용되지 않았습니다.
평균 연령은 13세(범위, 1~19세)였습니다. 47명의 환자 중 70%가 남성이었고 36%가 백인, 9%가 흑인 또는 아프리카계 미국인, 55%가 기타 또는 보고되지 않은 인종이었습니다. cGVHD 진단 후 평균 시간은 16.1개월이었고 이전 cGVHD 치료 횟수의 중앙값은 2회(범위, 1~12회)였습니다. 환자 대부분(87%)이 기준 시점에 최소 2개의 기관이 관련되어 있었고, 환자의 49%에서 기준 시점에 폐 관련 증상이 나타났습니다. 환자의 26%에서 Karnofsky/Lansky 수행 상태 점수가 <80점이었습니다. 기준 시점에서 1일 코르티코스테로이드 평균 용량(프레드니손 또는 프레드니손 등가물)은 0.47mg/kg/일이었고, 환자의 61%(31명 중 19명)가 기준 시점에 전신 코르티코스테로이드 외에 지속적인 면역억제제를 투여받고 있었습니다. 감염 예방은 기관 지침에 따라 관리되었으며, 환자의 72%가 설폰아미드와 트리메토프림 병용 요법을 받았고 70%가 전신 항진균제를 투여받았습니다.
IMBRUVICA의 유효성은 25주차까지의 전체 반응률(ORR)을 기준으로 확립되었으며, 여기서 전체 반응에는 2014년 미국 국립 보건원(NIH) 합의 개발 프로젝트 반응 기준에 따른 완전 반응 또는 부분 반응이 포함되었습니다. 유효성 결과는 표 31에 나와 있습니다.
| 전체 (N=47) | |
| 25주차까지의 ORR | 28 (60%) |
| 95% CI (%) | (44, 74) |
| 완전 반응(CR) | 2 (4%) |
| 부분 반응(PR) | 26 (55%) |
| 반응 기간의 중간값(월)(95% CI)b | 5.3 (2.8, 8.8) |
CI = 신뢰 구간, ORR = 전체 반응률
a 2014년 NIH 합의 개발 프로젝트 반응 기준에 근거한 평가.
b 첫 번째 반응부터 진행, 사망 또는 cGVHD에 대한 새로운 전신 요법까지 계산하여 연구의 모든 반응자를 기준으로 함.
첫 번째 반응을 보이기까지의 중간 시간은 0.9개월(범위, 0.9~6.1개월)이었습니다. 첫 번째 반응부터 사망 또는 cGVHD에 대한 새로운 전신 요법까지의 중간 시간은 14.8개월(95% CI: 4.6, 평가 불가)이었습니다.
ORR 결과는 환자 보고 증상 불편의 탐색적 분석에 의해 뒷받침되었으며, 이는 25주차까지 12세 이상 환자의 50%(26명 중 13명)에서 Lee 증상 척도 전체 요약 점수가 최소 7점 감소한 것으로 나타났습니다.
17
환자 상담 정보
환자와 보호자에게 FDA 승인 환자 라벨(환자 정보 및 사용 지침)을 읽도록 권고하십시오.
출혈:
환자에게 출혈 가능성을 알리고 징후나 증상(심한 두통, 혈변 또는 혈뇨, 출혈 지속 또는 제어 불가)이 나타나면 보고하도록 하십시오. 의료 또는 치과 시술을 위해 IMBRUVICA 복용을 중단해야 할 수 있음을 환자에게 알리십시오. [경고 및 주의사항(5.1) 참조].
감염:
환자에게 심각한 감염 가능성을 알리고 감염을 시사하는 징후나 증상(발열, 오한, 쇠약, 혼동)이 나타나면 보고하도록 하십시오. [경고 및 주의사항(5.2) 참조].
심장 부정맥, 심부전 및 급사:
환자에게 불규칙적인 심장 박동, 심부전 및 급사 가능성을 알리십시오.
환자에게 심계항진, 어지러움, 현기증, 실신, 숨 가쁨, 흉부 불편 또는 부종의 징후가 나타나면 보고하도록 상담하십시오. [경고 및 주의사항(5.3) 참조].
고혈압:
IMBRUVICA를 복용하는 환자에게 고혈압이 발생했으며, 고혈압 치료제로 치료해야 할 수 있음을 환자에게 알리십시오. [경고 및 주의사항(5.4) 참조].
두 번째 원발 악성 종양:
IMBRUVICA로 치료받은 환자에게 피부암 및 기타 암종을 포함한 다른 악성 종양이 발생했음을 환자에게 알리십시오. [경고 및 주의사항(5.6) 참조].
약물 유발 간 손상을 포함한 간독성:
IMBRUVICA 치료 중에 약물 유발 간 손상 및 간 기능 검사 이상을 포함한 간 문제가 발생할 수 있음을 환자에게 알리십시오. 복부 불편, 짙은 소변 또는 황달이 나타나면 즉시 의료 서비스 제공자에게 연락하도록 환자에게 조언하십시오. [경고 및 주의사항(5.7) 참조].
종양 용해 증후군:
환자에게 종양 용해 증후군의 잠재적 위험을 알리고 이러한 사건과 관련된 징후와 증상이 나타나면 의료 서비스 제공자에게 보고하여 평가를 받도록 하십시오. [경고 및 주의사항(5.8) 참조].
태아 독성:
여성에게 태아에 대한 잠재적 위험을 알리십시오. 임신이 확인되었거나 의심되는 경우 의료 서비스 제공자에게 알리도록 가임 여성에게 조언하십시오. [경고 및 주의사항(5.9), 특정 환자군에서의 사용(8.1) 참조].
가임 여성에게 IMBRUVICA 치료 중 및 마지막 복용 후 1개월 동안 효과적인 피임법을 사용하도록 조언하십시오. [특정 환자군에서의 사용(8.3)] 참조.
가임 여성 파트너를 둔 남성에게 IMBRUVICA 치료 중 및 마지막 복용 후 1개월 동안 효과적인 피임법을 사용하도록 조언하십시오. [특정 환자군에서의 사용(8.3), 비임상 독성학(13.1) 참조].
수유:
여성에게 IMBRUVICA 치료 중 및 마지막 복용 후 1주일 동안 모유 수유를 하지 말도록 조언하십시오. [특정 환자군에서의 사용(8.2) 참조].
기타 중요 정보:
환자에게 의사의 지시에 따라 IMBRUVICA를 1일 1회 경구 복용하고, 경구 복용량(캡슐 또는 정제)은 캡슐을 열거나 쪼개거나 씹거나 정제를 자르거나 부수거나 씹지 말고 매일 거의 같은 시간에 물 한 잔과 함께 통째로 삼켜야 함을 알리십시오. [용량 및 투여(2.1) 참조].
IMBRUVICA 1일 복용량을 놓친 경우 가능한 한 빨리 같은 날 복용하고 다음 날부터 정상적인 일정으로 복귀해야 함을 환자에게 알리십시오. 환자는 놓친 복용량을 보충하기 위해 추가 용량을 복용해서는 안 됩니다. [용량 및 투여(2.1) 참조].
IMBRUVICA 경구 현탁액의 경우 올바른 준비, 투여, 보관 및 폐기에 대한 사용 지침을 읽고 따르도록 환자 또는 보호자에게 지시하십시오. [용량 및 투여(2.1) 참조].
IMBRUVICA와 관련된 일반적인 부작용을 환자에게 알리십시오. [부작용(6) 참조]. 환자에게 환자 정보에 있는 부작용의 전체 목록을 알리십시오.
환자에게 처방약, 일반의약품, 비타민 및 약초 제품을 포함하여 병용하는 모든 약물을 의료 서비스 제공자에게 알리도록 조언하십시오. [약물 상호 작용(7) 참조].
환자에게 설사가 나타날 수 있으며 설사가 지속되면 의사에게 연락해야 함을 알리십시오. 환자에게 적절한 수분 공급을 유지하도록 조언하십시오. [부작용(6.1) 참조].
유통 및 판매:
Pharmacyclics LLC
South San Francisco, CA 94080 USA
및
판매:
Janssen Biotech, Inc.
Horsham, PA 19044 USA
특허 http://www.imbruvica.com
IMBRUVICA®는 Pharmacyclics LLC가 소유한 등록 상표입니다.
© Pharmacyclics LLC 2024
© Janssen Biotech, Inc. 2024
20085244
환자용 설명서
| 환자 정보 |
||||
| IMBRUVICA (임브루비카) (ibrutinib) 캡슐 |
IMBRUVICA (임브루비카) (ibrutinib) 정제 |
IMBRUVICA (임브루비카) (ibrutinib) 경구용 현탁액 |
||
| IMBRUVICA란 무엇입니까? IMBRUVICA는 다음을 치료하는 데 사용되는 처방약입니다.
IMBRUVICA가 만 1세 미만의 소아에게 안전하고 효과적인지는 알려져 있지 않습니다. |
||||
IMBRUVICA를 복용하기 전에, 다음을 포함한 모든 질환을 의료 서비스 제공자에게 알리십시오.
처방전 및 일반 의약품, 비타민, 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 서비스 제공자에게 알리십시오. IMBRUVICA를 특정 다른 약물과 함께 복용하면 IMBRUVICA의 작용 방식에 영향을 미치고 부작용을 일으킬 수 있습니다. |
||||
IMBRUVICA를 어떻게 복용하거나 투여해야 합니까?
IMBRUVICA는 캡슐, 정제, 경구용 현탁액으로 제공됩니다.
|
||||
| IMBRUVICA를 복용하는 동안 무엇을 피해야 합니까? IMBRUVICA로 치료하는 동안 자몽 주스를 마시거나 자몽을 먹거나 세비야 오렌지(종종 마멀레이드에 사용됨)를 먹어서는 안 됩니다. 이러한 제품은 혈액 내 IMBRUVICA의 양을 증가시킬 수 있습니다. |
||||
| IMBRUVICA의 가능한 부작용은 무엇입니까? IMBRUVICA는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
|
||||
|
|
|||
|
||||
|
|
|
||
이러한 증상이 나타나면 담당 의료 전문가가 심장을 확인하기 위해 검사를 수행하고 IMBRUVICA 용량을 변경할 수 있습니다.
B 세포 악성 종양(CLL/SLL 및 WM)이 있는 성인에서 IMBRUVICA의 가장 흔한 부작용은 다음과 같습니다. |
||||
|
|
|
||
|
|
|
||
|
|
|
||
| cGVHD가 있는 성인 또는 만 1세 이상 어린이에서 IMBRUVICA의 가장 흔한 부작용은 다음과 같습니다. | ||||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|||
| 설사는 IMBRUVICA를 복용하는 사람들에게 흔한 부작용입니다. IMBRUVICA로 치료하는 동안 수분을 충분히 섭취하여 설사로 인한 과도한 수분 손실(탈수증) 위험을 줄이십시오. 설사가 멈추지 않으면 담당 의료 전문가에게 알리십시오. 이것이 IMBRUVICA의 가능한 모든 부작용은 아닙니다. 부작용에 대한 의료적 조언은 의사에게 문의하십시오. 부작용은 FDA(1-800-FDA-1088)에 보고할 수 있습니다. |
||||
IMBRUVICA는 어떻게 보관해야 합니까?
IMBRUVICA와 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오. |
||||
| IMBRUVICA의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 환자 정보 전단지에 나열된 것 이외의 목적으로 처방되기도 합니다. 처방되지 않은 질환에 IMBRUVICA를 사용하지 마십시오. 다른 사람에게 IMBRUVICA를 투여하지 마십시오. 같은 증상이 있더라도 해를 입을 수 있습니다. 약사 또는 담당 의료 전문가에게 의료 전문가를 위해 작성된 IMBRUVICA에 대한 정보를 요청할 수 있습니다. |
||||
| IMBRUVICA의 성분은 무엇인가요? 활성 성분: 이부티닙 비활성 성분: IMBRUVICA 캡슐: 크로스카멜로스 나트륨, 스테아린산 마그네슘, 미세결정셀룰로오스, 그리고 라우릴황산나트륨. 70 mg 캡슐 쉘은 젤라틴, 이산화티타늄, 황색산화철, 그리고 검은 잉크를 포함합니다. 140 mg 캡슐 쉘은 젤라틴, 이산화티타늄, 그리고 검은 잉크를 포함합니다. IMBRUVICA 정제: 콜로이달 이산화규소, 크로스카멜로스 나트륨, 락토스 일수화물, 스테아린산 마그네슘, 미세결정셀룰로오스, 포비돈, 그리고 라우릴황산나트륨. 각 정제의 필름 코팅은 페로소페릭 옥사이드(140 mg, 280 mg, 420 mg 정제), 폴리비닐 알코올, 폴리에틸렌 글리콜, 적색산화철(280 mg 정제), 탈크, 이산화티타늄, 그리고 황색산화철(140 mg 및 420 mg 정제)을 포함합니다. IMBRUVICA 경구 현탁액: 벤질 알코올, 구연산 일수화물, 이수화인산이나트륨, 하이프로멜로오스, 미세결정셀룰로오스 및 카르복시메틸셀룰로오스 나트륨, 정제수, 그리고 슈크랄로스. 유통 및 마케팅: Pharmacyclics LLC 사우스 샌프란시스코, CA 94080 미국 마케팅: Janssen Biotech, Inc. 호샴, PA 19044 미국 © Pharmacyclics LLC 2024 © Janssen Biotech, Inc. 2024 20085244 자세한 정보는 www.imbruvica.com을 방문하거나 1-877-877-3536으로 전화하세요. |
||||
이 환자 정보는 미국 식품의약국(FDA)에 의해 승인되었습니다. 개정: 5/2024
사용 설명서
사용 지침
IMBRUVICA (임-브루-비-카)
(ibrutinib)
경구용 현탁액
이 사용 지침에는 IMBRUVICA 경구용 현탁액의 복용량을 준비하고 복용하거나 투여하는 방법에 대한 정보가 들어 있습니다.
IMBRUVICA를 복용하거나 투여하기 전과 매번 리필을 받을 때마다 이 사용 지침을 읽으십시오. 새로운 정보가 있을 수 있습니다.
본 사용 지침은 귀하 또는 귀하의 자녀의 질병 또는 치료에 대해 의료 서비스 제공자와 상담하는 것을 대신할 수 없습니다.
IMBRUVICA를 올바르게 복용하거나 투여하는 방법에 대한 도움이 필요하거나 질문이 있는 경우 의료 서비스 제공자에게 문의하거나 1-877-877-3536번으로 전화하십시오.
IMBRUVICA를 복용하거나 투여하기 전에 알아야 할 중요한 정보.
-
IMBRUVICA는 경구용으로만 사용됩니다.
- 의료 서비스 제공자가 지시한 대로 정확하게 IMBRUVICA를 복용하거나 투여하십시오.
- IMBRUVICA 복용량을 놓인 경우, 같은 날 가능한 한 빨리 복용하거나 투여할 수 있습니다. 하루에 처방된 복용량을 초과하여 복용하거나 투여하지 마십시오.
 |
귀하 또는 귀하의 자녀가 IMBRUVICA를 너무 많이 복용한 경우, 의료 서비스 제공자에게 연락하여 도움을 받으십시오. |
- 나중에 사용할 수 있도록 이 지침을 보관하십시오.
각 IMBRUVICA 상자에는 다음이 들어 있습니다(그림 A 참조).
- 미리 삽입된 병 어댑터(이 사용 지침에서는 ‘어댑터’라고 함)가 있는 IMBRUVICA 1병(이 사용 지침에서는 ‘병’이라고 함). 병 어댑터를 제거하지 마십시오.
- 0.1mL 단위로 측정하는 재사용 가능한 3mL 경구용 투약 주사기 2개(이 사용 지침에서는 ‘주사기’라고 함).
 |
IMBRUVICA와 함께 제공된 주사기만 사용하십시오. 다른 환자에게 사용하거나 다른 의약품과 함께 주사기를 사용하지 마십시오. |
 |
주사기의 눈금을 읽을 수 없는 경우 폐기하고 1-877-877-3536번으로 전화하여 새 주사기를 받으십시오. |
IMBRUVICA 복용량 준비 및 복용 또는 투여
1단계: 소모품을 모아 확인합니다.
|
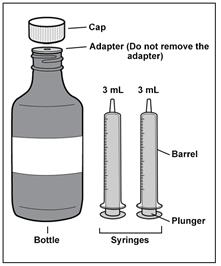 그림 A |
||
 |
상자와 병에 인쇄된 “EXP” 날짜 이후에는 IMBRUVICA를 사용하지 마십시오. | ||
 |
IMBRUVICA 상자 봉인이 훼손된 것처럼 보이면 사용하지 마십시오. | ||
2단계: 폐기 날짜를 기록하거나 확인합니다.
|
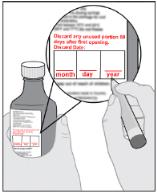 그림 B |
||
 |
병에 기록된 폐기 날짜 이후에는 IMBRUVICA를 사용하지 마십시오. | ||
3단계: 병을 흔듭니다.
|
 그림 C |
||
4단계: 병에서 뚜껑을 제거합니다.
병 어댑터는 제거하지 마십시오. |
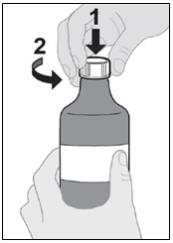 그림 D |
||
5단계: 주사기를 병에 연결합니다.
|
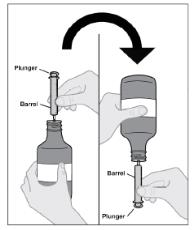 그림 E |
||
6단계: 주사기를 채웁니다.
|
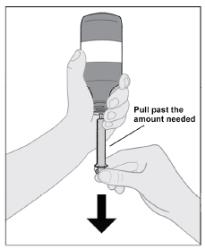 그림 F |
||
7단계: 기포를 제거하고 처방된 용량(mL)으로 조정합니다.
|
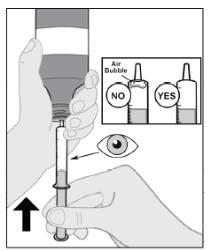 그림 G |
||
 |
정확한 용량을 투여하려면 기포를 제거해야 합니다. | ||
| 참고: 기포가 남아 있으면 6단계와 7단계를 반복합니다. | |||
8단계: 병에서 주사기를 꺼냅니다.
|
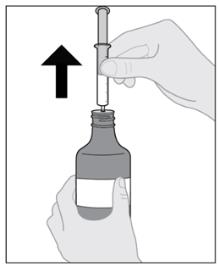 그림 H |
||
 |
복용 또는 투여할 준비가 되기 전에 실수로 약이 쏟아지는 것을 방지하기 위해 주사기의 플런저를 만지지 마십시오. | ||
| 참고: 전체 용량을 복용하거나 투여하기 위해 주사기가 1개 이상 필요한 경우, 두 번째 주사기로 5~8단계를 반복하여 처방된 용량을 채웁니다. | |||
9단계: IMBRUVICA를 복용하거나 투여합니다.
참고: IMBRUVICA는 병에서 꺼낸 후 가능한 한 빨리 복용하거나 투여해야 합니다. |
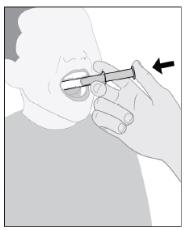 그림 I |
||
10단계: 병의 뚜껑을 닫습니다.
|
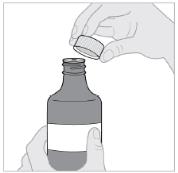 그림 J |
||
11단계: 주사기를 헹굽니다.
|
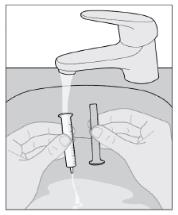 그림 K |
||
 |
주사기를 비누로 세척하거나 식기 세척기로 세척하지 마십시오. | ||
자세한 내용은 뒷면을 참조하십시오.
IMBRUVICA 경구 현탁액 보관 방법
- 병을 섭씨 2~25도(화씨 36~77도) 사이에서 보관합니다.
 |
냉동하지 마십시오. |
- IMBRUVICA 경구 현탁액은 어린이 보호 뚜껑이 있는 병에 들어 있습니다.
- IMBRUVICA 및 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오.
IMBRUVICA 폐기 방법
 |
병을 처음 연 후 60일 이내에 사용하지 않은 약은 버립니다. 동시에 사용했거나 사용하지 않은 주사기도 버립니다. |
- 약사에게 약을 올바르게 폐기하는 방법을 문의하십시오.
- 주사기를 폐기하려면 헹구고 일반 쓰레기에 버립니다.
이 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
유통 및 판매원:
Pharmacyclics LLC
South San Francisco, CA 94080 USA
및
판매원:
Janssen Biotech, Inc.
Horsham, PA 19044 USA
특허 http://www.imbruvica.com
IMBRUVICA®는 Pharmacyclics LLC의 등록 상표입니다.
© 2024 Pharmacyclics LLC
© 2024 Janssen Biotech, Inc.
20080493
개정일: 2024년 2월