의약품 제조업체: Pfizer Laboratories Div Pfizer Inc (Updated: 2023-11-20)
처방 정보 강조사항
XALKORI® (크리조티닙) 캡슐, 경구용
XALKORI® (크리조티닙) 경구 펠릿
미국 최초 승인: 2011년
최근 주요 변경 사항
|
용량 및 투여 방법 (2) |
2023년 9월 |
표시 및 사용
XALKORI는 다음을 치료하기 위해 사용되는 키나아제 억제제로,
- •
- FDA 승인 검사로 확인된 알라니브릿린 (ALK) 또는 ROS1 양성인 전이성 비소세포 폐암(NSCLC) 환자 성인. (1.1, 2.1)
- •
- ALK 양성인 재발 또는 내성을 보이는 1세 이상의 소아 환자 및 젊은 성인에서 재발 또는 내성을 보이는 전신성 알라니브릿린 양성 대세포 림프종(ALCL). (1.2, 2.3)
- o
- 사용 제한: XALKORI의 안전성과 효능은 재발 또는 내성을 보이는 전신성 ALK 양성 ALCL 환자 중 고령 환자에서는 입증되지 않았습니다.
- •
- ALK 양성인 절제 불가능한, 재발 또는 내성을 보이는 염증성 근섬유성 종양(IMT) 환자 성인 및 1세 이상의 소아. (1.3, 2.3)
용량 및 투여 방법
금기 사항
없음. (4)
경고 및 주의 사항
- •
- 간독성: 치명적인 간독성이 발생할 수 있습니다. 주기적인 간 기능 검사로 모니터링하십시오. 일시적으로 중단하거나 용량을 감량하거나 영구적으로 XALKORI를 중단하십시오. (2.2, 2.6, 5.1)
- •
- 조직 간질성 폐질환 (ILD)/기관지염: ILD/기관지염이 있는 환자에서는 영구적으로 중단하십시오. (2.6, 5.2)
- •
- QT 간격 연장: QTc 간격 연장의 위험이 있는 환자에서는 심전도 및 전해질을 모니터링하십시오. 일시적으로 중단하거나 용량을 감량하거나 영구적으로 XALKORI를 중단하십시오. (2.6, 5.3)
- •
- Bradycardia: XALKORI는 느린 심박수를 유발할 수 있습니다. 심박수와 혈압을 정기적으로 모니터링하십시오. 일시적으로 중단하거나 용량을 감량하거나 영구적으로 XALKORI를 중단하십시오. (2.6, 5.4)
- •
- 심각한 시력 손상: XALKORI는 심각한 시력 변화를 유발할 수 있습니다. 치료 동안 안구 독성을 모니터링하고 평가하십시오. 심각한 시력 손상이 있는 환자에서 XALKORI를 중단하십시오. (2.2, 2.6, 5.5)
- •
- ALK 양성 ALCL 또는 IMT 소아 및 젊은 성인 환자의 위장관 독성: XALKORI는 심한 메스꺼움, 구토, 설사 및 구내염을 유발할 수 있습니다. 표준 항메스꺼움제 및 항설사제를 제공하십시오. 일시적으로 중단하거나 용량을 감량하거나 영구적으로 XALKORI를 중단하십시오. (2.6, 5.6)
- •
- 배아-태아 독성: 태아에 유해할 수 있습니다. 생식 가능한 여성에게 태아에 대한 잠재적 위험과 효과적인 피임 사용을 알립니다. (5.7, 8.1, 8.3)
부작용
NSCLC 성인 환자에서 가장 흔한 부작용(≥25%)은 시력 장애, 메스꺼움, 설사, 구토, 부종, 변비, 전이효소 상승, 피로, 식욕 감소, 상부 호흡기 감염, 어지러움 및 신경병증입니다. (6.1)
ALCL 환자에서 가장 흔한 부작용(≥35%)은 설사, 구토, 메스꺼움, 시력 장애, 두통, 근골격 통증, 구내염, 피로, 식욕 감소, 발열, 복통, 기침 및 가려움증입니다. 3-4급의 실험실적 이상 (≥15%)은 중성구감소증, 림프구감소증 및 혈소판감소증입니다. (6.1)
IMT 성인 환자에서 가장 흔한 부작용(≥35%)은 시력 장애, 메스꺼움 및 부종입니다. (6.1)
IMT 소아 환자에서 가장 흔한 부작용(≥35%)은 구토, 메스꺼움, 설사, 복통, 발진, 시력 장애, 상부 호흡기 감염, 기침, 발열, 근골격 통증, 피로, 부종, 변비 및 두통입니다. (6.1)
의심되는 부작용을 신고하려면 Pfizer Inc. (1-800-438-1985) 또는 FDA (1-800-FDA-1088 또는 www.fda.gov/medwatch)에 연락하십시오.
약물 상호작용
환자 상담 정보 및 약물 안내서는 17을 참조하십시오.
개정일: 2023년 9월
목차
전체 처방 정보: 목차*
1 적응증 및 사용법
1.1 ALK 또는 ROS1 양성인 전이성 비소세포폐암
1.2 재발성 또는 불응성의 전신 ALK 양성 역형성 거대세포 림프종
1.3 절제 불가능, 재발성 또는 불응성 ALK 양성 염증성 근섬유모세포종
2 용법 및 용량
2.1 환자 선택
2.2 XALKORI 치료 중 권장되는 검사
2.3 권장 용량
2.4 투여 방법
2.5 ALCL이 있는 소아 및 청소년 환자 또는 IMT가 있는 소아 환자에 대한 병용 요법
2.6 이상반응에 대한 용량 조절
2.7 중등도 및 중증 간장애에 대한 용량 조절
2.8 중증 신장애에 대한 용량 조절
2.9 강력한 CYP3A 억제제와 병용 시 용량 조절
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 간독성
5.2 간질성 폐질환/폐렴
5.3 QT 간격 연장
5.4 서맥
5.5 중증 시력 상실
5.6 ALCL이 있는 소아 및 청소년 환자 또는 IMT가 있는 소아 환자에서의 위장관 독성
5.7 태아 독성
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물상호작용
7.1 다른 약물이 XALKORI에 미치는 영향
7.2 XALKORI가 다른 약물에 미치는 영향
7.3 QT 간격을 연장시키는 약물
7.4 서맥을 유발하는 약물
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.3 가임기 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 간장애
8.7 신장애
11 제품설명
12 임상약리
12.1 작용기전
12.2 약력학
12.3 약동학
13 비임상 독성
13.1 발암성, 변이원성, 수태능 장애
14 임상 연구
14.1 ALK 또는 ROS1 양성인 전이성 비소세포폐암
14.2 재발성 또는 불응성의 전신 ALK 양성 역형성 거대세포 림프종
14.3 절제 불가능, 재발성 또는 불응성 ALK 양성 염증성 근섬유모세포종
16 공급/보관 및 취급 방법
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 사용법
1.1 ALK 또는 ROS1 양성 전이성 비소세포폐암
XALKORI는 FDA 승인 검사에 의해 anaplastic lymphoma kinase (ALK) 또는 ROS1 양성으로 확인된 전이성 비소세포폐암(NSCLC) 성인 환자의 치료에 사용된다[용법 용량 (2.1) 참조].
1.2 재발성 또는 불응성, 전신 ALK 양성 역형성 대세포 림프종
XALKORI는 ALK 양성인 재발성 또는 불응성, 전신 역형성 대세포 림프종(ALCL)이 있는 1세 이상의 소아 환자 및 청소년의 치료에 사용된다.
1.3 절제 불가능, 재발성 또는 불응성 ALK 양성 염증성 근섬유아세포종
XALKORI는 ALK 양성인 절제 불가능, 재발성 또는 불응성 염증성 근섬유아세포종(IMT)이 있는 1세 이상의 성인 및 소아 환자의 치료에 사용된다.
2 DOSAGE AND ADMINISTRATION
2.1 환자 선택
XALKORI를 전이성 NSCLC 치료제로 선택할 때는 종양 조직에서 ALK 또는 ROS1 양성 여부를 확인해야 합니다 [임상 연구 (14.1, 14.2, 14.3) 참조].
NSCLC에서 ALK 및 ROS1 재배열 검출을 위한 FDA 승인 검사에 관한 정보는 http://www.fda.gov/companiondiagnostics에서 확인할 수 있습니다.
2.2 XALKORI 치료 중 권장 검사
- •
- 치료 첫 2개월 동안은 2주마다, 그 후에는 매달, 그리고 임상적으로 필요한 경우 알라닌 아미노전이효소(ALT), 아스파르테이트 아미노전이효소(AST) 및 총 빌리루빈을 포함한 간기능 검사를 실시하고, 트랜스아미나제, 알칼리인산분해효소 또는 총 빌리루빈 상승이 있는 환자에서는 더 자주 반복 검사를 실시합니다[경고 및 주의사항 (5.1) 참조].
- •
- 치료 첫 1개월 동안은 매주, 이후에는 최소 매달 전혈구 검사를 실시하되, 3급 또는 4급 이상 이상, 발열 또는 감염이 있을 경우 보다 자주 모니터링합니다[이상반응 (6.1) 참조].
- •
- ALCL 또는 IMT를 가진 소아 및 청소년 환자의 경우, XALKORI 치료 시작 1개월 이내에 기저선 안과 검사(망막 검사 포함)를 실시하고, 이후 3개월마다 추적 검사를 실시합니다[경고 및 주의사항 (5.5) 참조].
2.3 권장 용량
XALKORI의 권장 용량은 표 1과 같습니다.
|
적응증 |
XALKORI 권장 용량 |
|
ALK 또는 ROS1 양성 전이성 NSCLC |
성인: |
|
재발 또는 불응성, 전신 ALK 양성 ALCL |
소아 및 청소년: |
|
절제 불가능, 재발성 또는 불응성 ALK 양성 IMT |
성인: |
|
소아: |
|
ALK 또는 ROS1 양성 전이성 NSCLC 성인 환자에 대한 권장 용량
- •
- ALK 또는 ROS1 양성 전이성 NSCLC 성인 환자에 대한 XALKORI 캡슐의 권장 용량은 250mg을 1일 2회 경구 투여하며, 식사 여부와 무관합니다. 질병이 진행되거나 용납할 수 없는 독성이 발생할 때까지 투여를 지속합니다.
- •
- 캡슐 삼키기 어려운 성인 환자의 경우 XALKORI 펠릿 250mg(50mg x 2 + 150mg x 1)을 1일 2회 경구 투여하며, 식사 여부와 무관합니다. 질병이 진행되거나 용납할 수 없는 독성이 발생할 때까지 투여를 지속합니다.
ALK 양성 ALCL을 가진 소아 및 청소년 환자에 대한 권장 용량
- •
- 재발 또는 불응성, 전신 ALK 양성 ALCL을 가진 1세 이상 소아 및 청소년 환자에 대한 권장 용량은 체표면적(BSA)에 따라 달라지며 표 2를 참조합니다.
- •
- XALKORI 캡슐 또는 펠릿을 1일 2회 경구 투여하며, 식사 여부와 무관합니다. 질병이 진행되거나 용납할 수 없는 독성이 발생할 때까지 투여를 지속합니다.
표 2는 XALKORI 캡슐 또는 펠릿 투여 시 체표면적(BSA)에 따른 용량을 제공합니다.
|
|||
|
체표면적(BSA) |
280 mg/m2를 달성하기 위한 권장 XALKORI 용량 1일 2회 |
투여할 XALKORI 펠릿 용량 조합* |
투여할 XALKORI 캡슐 용량 조합 |
|
0.38 ~ 0.46 m2 |
120 mg 1일 2회 |
20 mg 1정 + 50 mg 2정 |
— |
|
0.47 ~ 0.51 m2 |
140 mg 1일 2회 |
20 mg 2정 + 50 mg 2정 |
— |
|
0.52 ~ 0.61 m2 |
150 mg 1일 2회 |
150 mg 1정 |
— |
|
0.62 ~ 0.80 m2 |
200 mg 1일 2회 |
50 mg 1정 + 150 mg 1정 |
— |
|
0.81 ~ 0.97 m2 |
250 mg 1일 2회 |
50 mg 2정 + 150 mg 1정 |
— |
|
0.98 ~ 1.16 m2 |
300 mg 1일 2회 |
150 mg 2정 |
— |
|
1.17 ~ 1.33 m2 |
350 mg 1일 2회 |
50 mg 1정 + 150 mg 2정 |
— |
|
1.34 ~ 1.51 m2 |
400 mg 1일 2회 |
50 mg 2정 + 150 mg 2정 |
200 mg 2정 |
|
1.52 ~ 1.69 m2 |
450 mg 1일 2회 |
150 mg 3정 |
200 mg 1정 + 250 mg 1정 |
|
1.7 m2 이상 |
500 mg 1일 2회 |
50 mg 1정 + 150 mg 3정 |
250 mg 2정 |
ALK 양성 IMT 환자에 대한 권장 용량
- •
- 절제 불가능, 재발성 또는 불응성 ALK 양성 IMT 환자의 권장 용량은 표 1과 같습니다.
- •
- 1세 이상의 소아 환자에서 절제 불가능, 재발성 또는 불응성 ALK 양성 IMT의 권장 용량은 체표면적에 따라 표 3과 같습니다.
- •
- XALKORI 캡슐 또는 펠렛을 식사 여부와 관계없이 1일 2회 경구 투여하며, 질병이 진행되거나 허용할 수 없는 독성이 발생할 때까지 투여합니다.
표 3은 XALKORI 캡슐 또는 펠렛의 체표면적 기반 용량을 제공합니다.
|
|||
|
체표면적 (BSA) |
280 mg/m2를 얻기 위한 권장 XALKORI 용량 하루 2회 |
투여할 XALKORI 펠렛 용량 강도의 조합* |
투여할 XALKORI 캡슐 용량 강도의 조합 |
|
0.38 ~ 0.46 m2 |
120 mg 하루 2회 |
1 x 20 mg + 2 x 50 mg |
— |
|
0.47 ~ 0.51 m2 |
140 mg 하루 2회 |
2 x 20 mg + 2 x 50 mg |
— |
|
0.52 ~ 0.61 m2 |
150 mg 하루 2회 |
1 x 150 mg |
— |
|
0.62 ~ 0.80 m2 |
200 mg 하루 2회 |
1 x 50 mg + 1 x 150 mg |
— |
|
0.81 ~ 0.97 m2 |
250 mg 하루 2회 |
2 x 50 mg + 1 x 150 mg |
— |
|
0.98 ~ 1.16 m2 |
300 mg 하루 2회 |
2 x 150 mg |
— |
|
1.17 ~ 1.33 m2 |
350 mg 하루 2회 |
1 x 50 mg + 2 x 150 mg |
— |
|
1.34 ~ 1.51 m2 |
400 mg 하루 2회 |
2 x 50 mg + 2 x 150 mg |
2 x 200 mg |
|
1.52 ~ 1.69 m2 |
450 mg 하루 2회 |
150 mg 3회 분복 |
200 mg 1회 + 250 mg 1회 |
|
1.7 m2 이상 |
500 mg 1일 2회 복용 |
50 mg 1회 + 150 mg 3회 |
250 mg 2회 복용 |
2.4 투여방법
- •
- XALKORI 캡슐 또는 펠렛을 식사 여부와 상관없이 하루 2회 경구 투여하십시오.
- •
- XALKORI 캡슐 또는 펠렛 복용을 잊은 경우, 다음 복용 시간까지 6시간 이상 남았다면 잊은 복용분을 보충하십시오.
- •
- XALKORI 캡슐 또는 펠렛 복용 후 구토가 있었다면 추가로 복용하지 마시고 정해진 다음 복용 시간에 복용하십시오.
XALKORI 캡슐
- •
- XALKORI 캡슐을 식사 여부와 상관없이 하루 2회 통째로 삼키십시오.
- •
- XALKORI 캡슐을 씹거나, 부수거나, 쪼개지 마십시오.
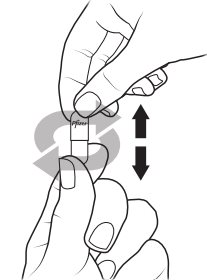
XALKORI 펠렛
- •
- XALKORI 펠렛은 캡슐 속에 들어있습니다.
- •
- XALKORI 펠렛을 씹거나 부수지 마십시오.
- •
- 캡슐 속의 XALKORI 펠렛을 통째로 삼키지 마십시오.
- •
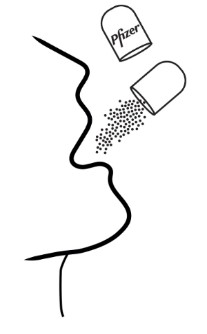
- XALKORI 펠렛은 두 가지 방식으로 투여할 수 있습니다:
- 1.
- XALKORI 펠렛이 들어있는 캡슐을 열고 직접 환자의 입안에 내용물을 비웁니다.
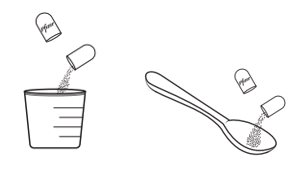
- 2.
- XALKORI 펠렛이 들어있는 캡슐을 열고 경구 투약 보조기구(예: 스푼, 약컵)에 내용물을 비웁니다. 보조기구에 있는 XALKORI 펠렛을 직접 환자의 입안에 넣어줍니다.
- •
- 투약 직후 충분한 물을 제공하여 약물이 모두 삼켜지도록 합니다.
2.5 ALCL 또는 IMT를 앓는 소아/청소년 환자를 위한 병용 치료
구토와 구역을 예방하기 위해 XALKORI 치료 전후에 구토억제제 투여를 권장합니다. 위장관 독성에 대해 표준 구토억제제와 설사억제제를 제공하십시오.
탈수 위험이 있는 환자에게는 정맥 또는 경구 수분 보충을 고려하고, 임상적으로 지시된 경우 전해질을 보충하십시오. [경고 및 주의사항(5.6)참조].
2.6 이상반응에 대한 투여량 조절
NSCLC 또는 IMT 성인 환자에 대한 이상반응 관련 투여량 조절 권고사항은 표 4와 같습니다.
|
투여량 감량 |
투여량 및 투여일정 |
|
1차 감량 |
200 mg 1일 2회 복용 |
|
2차 감량 |
250 mg 1일 1회 복용 |
|
1일 1회 250 mg 복용을 견딜 수 없는 경우 XALKORI 캡슐 또는 펠렛 투여를 영구적으로 중단하십시오. |
|
ALCL 또는 IMT 소아/청소년 환자와 ALCL 청소년 환자에 대한 이상반응 관련 권장 투여량 조절은 체표면적 기준이며 표 5와 같습니다.
|
||||
|
체표면적 (BSA) |
1차 감량 |
2차 감량* |
||
|
투여량 |
권장 감량 투여량 도달을 위한 제형 및 강도 |
투여량 |
권장 감량 투여량 도달을 위한 제형 및 강도 | |
|
0.38~0.46 m2 |
90mg 하루 2회 |
펠렛: 20mg 2정 + 50mg 1정 |
70mg 하루 2회 |
펠렛: 20mg 1정 + 50mg 1정 |
|
0.47~0.51 m2 |
100mg 하루 2회 |
펠렛: 50mg 2정 |
80mg 하루 2회 |
펠렛: 20mg 4정 |
|
0.52~0.61 m2 |
120mg 하루 2회 |
펠렛: 20mg 1정 + 50mg 2정 |
90mg 하루 2회 |
펠렛: 20mg 2정 + 50mg 1정 |
|
0.62~0.80 m2 |
150mg 하루 2회 |
펠렛: 150mg 1정 |
120mg 하루 2회 |
펠렛: 20mg 1정 + 50mg 2정 |
|
0.81~0.97 m2 |
200mg 하루 2회 |
펠렛: 50mg 1정 + 150mg 1정 |
150mg 하루 2회 |
펠렛: 150mg 1정 |
|
0.98~1.16 m2 |
220mg 하루 2회 |
펠렛: 20mg 1정 + 50mg 1정 + 150mg 1정 |
170mg 하루 2회 |
펠렛: 20mg 1정 + 150mg 1정 |
|
1.17~1.33 m2 |
250mg 하루 2회 |
펠렛: 50mg 2정 + 150mg 1정 |
200mg 하루 2회 |
펠렛: 50mg 1정 + 150mg 1정 |
펠렛: 1 x 50 mg + 1 x 150 mg |
|
1.34 ~ 1.69 m2 |
250 mg 하루 두 번 |
펠렛: 2 x 50 mg + 1 x 150 mg 또는 캡슐: 1 x 250 mg |
200 mg 하루 두 번 |
펠렛: 1 x 50 mg + 1 x 150 mg 또는 캡슐: 1 x 200 mg |
|
1.7 m2 이상 |
400 mg 하루 두 번 |
펠렛: 2 x 50 mg + 2 x 150 mg 또는 캡슐: 2 x 200 mg |
250 mg 하루 두 번 |
펠렛: 2 x 50 mg + 1 x 150 mg 또는 캡슐: 1 x 250 mg |
성인 NSCLC 또는 IMT 환자의 혈액학적 이상반응에 대한 권장 용량 조정
성인 NSCLC 또는 IMT 환자의 혈액학적 이상반응에 대한 권장 용량 조정은 표 6과 같습니다.
|
이상반응 중증도† |
XALKORI 용량 조정 |
|
3등급 |
2등급 이하로 회복될 때까지 투여 중단 후, 동일 용량으로 재투여. |
|
4등급 |
2등급 이하로 회복될 때까지 투여 중단 후, 다음 낮은 용량으로 재투여. |
치료 첫 달에는 매주, 그 이후에는 최소한 매월 전체 혈구 수치 및 백혈구 분화 검사를 실시하고, 3등급 또는 4등급의 이상, 발열 또는 감염이 있을 경우 더 자주 모니터링합니다.
ALCL 또는 IMT 소아 및 청소년 환자의 혈액학적 이상반응에 대한 권장 용량 조정
ALCL 또는 IMT 소아 및 청소년 환자의 혈액학적 이상반응에 대한 권장 용량 조정은 표 7과 같습니다.
|
|
|
이상반응 중증도 |
XALKORI 용량 조정 |
|
절대 호중구 수(ANC) |
|
|
0.5 x 109/L 미만 |
첫 번째 발생: ANC가 1.0 x 109/L 이상으로 회복될 때까지 투여 중단 후 다음 낮은 용량으로 재투여. 두 번째 발생:
|
|
혈소판 수치 |
|
|
25 ~ 50 x 109/L, 동시에 출혈이 동반될 경우 |
혈소판 수치가 50 x 109/L 이상으로 회복되고 출혈이 해결될 때까지 투여를 보류한 후 같은 용량으로 재개합니다. |
|
25 x 109/L 미만 |
혈소판 수치가 50 x 109/L 이상으로 회복될 때까지 투여를 보류한 후 다음 낮은 용량으로 재개합니다. 재발 시에는 영구적으로 투여를 중단합니다. |
|
빈혈 |
|
|
헤모글로빈 8 g/dL 미만 |
헤모글로빈 수치가 8g/dL 이상으로 회복될 때까지 투여를 보류한 후 같은 용량으로 재개합니다. |
|
생명을 위협하는 빈혈, 긴급 치료가 필요한 경우 |
헤모글로빈 수치가 8g/dL 이상으로 회복될 때까지 투여를 보류한 후 다음 낮은 용량으로 재개합니다. 재발 시에는 영구적으로 투여를 중단합니다. |
비혈액학적 이상반응에 대한 권장 용량 조절
비혈액학적 이상반응에 대한 권장 용량 조절은 표 8과 같습니다.
|
이상반응의 중증도* |
XALKORI 용량 조절 |
|||
|
간독성 [경고 및 주의사항(5.1) 참조] |
||||
|
알라닌 아미노전이효소(ALT) 또는 아스파르트산 아미노전이효소(AST)가 정상상한치의 5배를 초과하고 총 빌리루빈이 정상상한치의 1.5배 이하일 경우 |
기저치 이하 또는 정상상한치의 3배 이하로 회복될 때까지 투여를 보류한 후 다음 낮은 용량으로 재개합니다. |
|||
|
ALT 또는 AST가 정상상한치의 3배를 초과하고 동시에 총 빌리루빈이 정상상한치의 1.5배를 초과할 경우(담즙 정체 또는 용혈이 없는 경우) |
영구적으로 투여를 중단합니다. |
|||
|
간질성 폐질환(폐렴) [경고 및 주의사항(5.2) 참조] |
||||
|
약물 관련 간질성 폐질환/폐렴(모든 등급) |
영구적으로 투여를 중단합니다. |
|||
|
QT 간격 연장 [경고 및 주의사항(5.3) 참조] |
||||
|
최소 2회의 독립적인 심전도 검사에서 심박수로 보정한 QT 간격(QTc)이 500ms를 초과하는 경우 |
기저치 또는 QTc 481ms 미만으로 회복될 때까지 투여를 보류한 후 다음 낮은 용량으로 재개합니다. |
|||
|
QTc가 500ms를 초과하거나, 기저치와 비교하여 60ms 이상 연장되고 동시에 Torsade de pointes 또는 다형성 심실빈맥이 나타나거나 중증 부정맥 징후/증상이 있는 경우 |
영구적으로 투여를 중단합니다. |
|||
|
서맥 [경고 및 주의사항(5.4) 참조] |
||||
|
서맥†(증상이 있고 중증일 수 있으며 의학적으로 유의하고 의학적 중재가 필요한 경우) |
환자 연령에 맞는 휴식 시 심박수(연령별 정상 수치의 2.5백분위수 기준)로 회복될 때까지 투여를 보류합니다: 2 용법 및 투여
서맥을 유발하는 것으로 알려진 병용 약물과 항고혈압 약물을 평가합니다. 만약 기여하는 병용 약물이 확인되고 중단되었거나, 용량이 조정되었다면, 무증상 서맥이나 위에 제시된 연령별 심장 박동수로 회복 시 이전 용량으로 재개합니다. 기여하는 병용 약물이 확인되지 않았거나, 병용 약물이 중단되지 않았거나 용량이 조정되지 않은 경우, 무증상 서맥이나 위에 제시된 연령별 심장 박동수로 회복 시 감량된 용량으로 재개합니다. |
|||
|
서맥† (생명을 위협하는 결과, 긴급한 중재 필요) |
기여하는 병용 약물이 확인되지 않은 경우 영구적으로 중단합니다. 기여하는 병용 약물이 확인되고 중단되었거나, 용량이 조정된 경우, 무증상 서맥이나 증상이 있거나 중증의 의학적으로 유의한 서맥 관리를 위해 나열된 심박수 기준으로 회복 시 Table 4 또는 5의 두 번째 감량 수준으로 자주 모니터링하며 재개합니다. 재발 시 영구 중단합니다. |
|||
|
시각 손실을 포함한 안구 독성 [경고 및 주의사항 (5.5) 참조] |
||||
|
시각 증상, Grade 1 (경증 증상) 또는 Grade 2 (연령에 적합한 일상 활동 수행 능력에 영향을 미치는 중등도 증상) |
증상을 모니터링하고 안과 전문의에게 증상을 보고합니다. Grade 2 시각 장애의 경우 용량 감량을 고려합니다. |
|||
|
시력 손실 (Grade 3 또는 4 안구 장애, 현저한 시력 감소) |
중증 시력 손실 평가 동안 중단합니다. Grade 3 또는 4 안구 장애 또는 평가에서 다른 원인이 발견되지 않은 중증 시력 손실의 경우 XALKORI를 영구 중단합니다. |
|||
|
위장관 독성‡ [경고 및 주의사항 (5.6) 참조] |
||||
|
오심 (Grade 3: 3일 이상 경구 섭취 부적절, 의학적 중재 필요) |
Grade 3 (최대 의학적 요법에도 불구): 해결될 때까지 보류하고 다음 낮은 용량 수준으로 재개합니다.§ |
|||
|
구토 (Grade 3: 24시간 동안 6회 이상의 episodes, 3일 이상, 의학적 중재 필요, 즉 tube feeding 또는 입원; Grade 4: 생명을 위협하는 결과, 긴급 중재 필요) |
Grade 3 또는 4 (최대 의학적 요법에도 불구): 해결될 때까지 보류하고 다음 낮은 용량 수준으로 재개합니다.§ |
|||
|
설사 (Grade 3: baseline 대비 하루 7회 이상 증가; 실금; 입원 필요; Grade 4: 생명을 위협하는 결과, 긴급 중재 필요) |
Grade 3 또는 4 (최대 의학적 요법에도 불구): 해결될 때까지 보류하고 다음 낮은 용량 수준으로 재개합니다.§ |
|||
| 이상반응 | XALKORI (N=171) |
화학요법 (Pemetrexed/Cisplatin 또는 Pemetrexed/Carboplatin) (N=169) |
||
|---|---|---|---|---|
| 전체 등급 (%) |
3-4등급 (%) |
전체 등급 (%) |
3-4등급 (%) |
|
|
||||
|
심장 |
||||
|
Bradycardia† |
14 |
1 |
1 |
0 |
|
심전도 QT 연장 |
6 |
2 |
2 |
0 |
|
눈 |
||||
|
시력 장애‡ |
71 |
1 |
10 |
0 |
|
소화기계 |
||||
|
설사 |
61 |
2 |
13 |
1 |
|
구토 |
46 |
2 |
36 |
3 |
|
변비 |
43 |
2 |
30 |
0 |
|
복통§ |
26 |
0 |
12 |
0 |
|
소화불량 |
14 |
0 |
2 |
0 |
|
연하곤란 |
10 |
1 |
2 |
1 |
|
식도염¶ |
6 |
2 |
0 |
0 |
|
일반 |
||||
|
부종# |
49 |
1 |
12 |
1 |
|
발열 |
19 |
0 |
11 |
1 |
|
감염 |
||||
|
상부 호흡기 감염Þ |
32 |
0 |
12 |
1 |
|
검사 |
||||
|
체중 증가 |
8 |
1 |
2 |
0 |
|
근골격계 및 결합 조직 |
||||
|
사지 통증 |
16 |
0 |
7 |
0 |
|
근육 경련 |
8 |
0 |
2 |
1 |
|
신경계 |
||||
|
미각 장애 |
26 |
0 |
5 |
0 |
|
두통 |
22 |
1 |
15 |
0 |
|
현기증ß |
18 |
0 |
10 |
1 |
잘코리 투여 환자에서 발생률이 전체 1% ~ 60% 사이였던 추가 이상반응으로는 구역(56%), 식욕 감소(30%), 피로(29%), 신경병증(21%; 보행장애, 저지각, 근력약화, 신경통, 말초신경병증, 감각이상, 말초감각신경병증, 다발성신경병증, 감각장애), 발진(11%), 신장낭종(5%), ILD(1%; ILD, 폐렴증), 기립성 저혈압(1%), 혈액 테스토스테론 감소(1%; 성선기능저하증) 등이 있었습니다.
잘코리 투여 환자의 1% 미만에서 관찰된 임상적으로 관련성 있는 이상반응으로는 광과민성(0.3%)이 있었습니다.
혈액학
(%)
(%)
(%)
(%)
잘코리 투여군에서 크레아티닌 증가(전체 등급: 99%; 등급 3: 2%; 등급 4: 0%)는 화학요법군(전체 등급: 92%; 등급 3: 0%; 등급 4: 1%)에 비해 추가 실험실 검사 이상이 관찰되었습니다.
6 부작용
중성구감소증
52
11
59
16
림프구감소증
48
7
53
13
화학
ALT 증가
79
15
33
2
AST 증가
66
8
28
1
저인산혈증
32
10
21
6
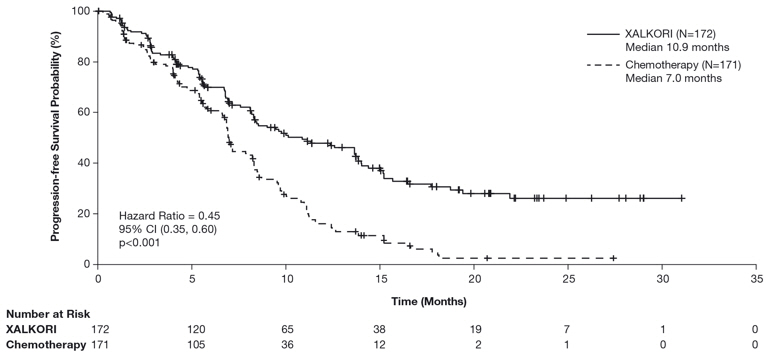
이전에 치료받은 ALK-양성 전이성 NSCLC – 연구 2 (PROFILE 1007)
표 11의 데이터는 무작위 배정, 다기관, 활성대조, 공개 실험(연구 2)에 등록된 ALK-양성 전이성 NSCLC 환자 343명에서 나온 것입니다. XALKORI 군(n=172)의 환자들은 문서화된 질병 진행, 치료 내성, 또는 의사가 더 이상 임상적 이득을 경험하지 않는다고 판단할 때까지 XALKORI 250mg을 하루 두 번 경구 투여받았습니다. 화학요법 군(n=171)의 총 171명의 환자가 pemetrexed 500mg/m2 (n=99) 또는 docetaxel 75mg/m2 (n=72)를 3주마다 정맥 주사로 문서화된 질병 진행, 치료 내성, 또는 의사가 더 이상 임상적 이득을 경험하지 않는다고 판단할 때까지 투여받았습니다. 화학요법 군의 환자들은 이전에 1차 또는 유지 치료로 pemetrexed를 받은 바가 없다면 pemetrexed를 투여받았습니다.
연구 치료의 중앙 기간은 XALKORI를 투여받은 환자에서 7.1개월, 화학요법을 받은 환자에서 2.8개월이었습니다. 무작위 배정된 347명의 환자(343명이 최소 1회 이상 연구 치료를 받음) 중 중앙 연령은 50세였고, 14%의 환자가 65세 이상이었습니다. 56%가 여성이었으며 45%가 아시아인이었습니다.
XALKORI로 치료받은 환자의 37%, 화학요법군의 23%에서 중대한 이상반응이 보고되었습니다. XALKORI로 치료받은 환자에게서 가장 빈번하게 보고된 중대한 이상반응은 폐렴(4.1%), 폐색전증(3.5%), 호흡곤란(2.3%), ILD(2.9%)였습니다. 연구 2에서 XALKORI로 치료받은 환자의 5%에서 급성 호흡곤란 증후군, 부정맥, 호흡곤란, 폐렴, 간질성 폐렴, 폐색전증, ILD, 호흡부전, 패혈증 등으로 인한 치명적 이상반응이 발생했습니다.
XALKORI로 치료받은 환자의 16%에서 이상반응으로 인해 용량 감소가 필요했습니다. XALKORI로 치료받은 환자에서 용량 감소로 이어진 가장 흔한 이상반응은 ALT 상승(일부 환자는 AST 상승 동반)(8%), QTc 연장(2.9%), 중성구감소증(2.3%)이었습니다.
XALKORI는 환자의 15%에서 이상반응으로 인해 중단되었습니다. XALKORI 중단으로 이어진 가장 흔한 이상반응은 ILD(1.7%), ALT 및 AST 상승(1.2%), 호흡곤란(1.2%), 폐색전증(1.2%)이었습니다.
표 11과 12는 각각 XALKORI로 치료받은 환자에서의 흔한 이상반응과 실험실적 이상을 요약합니다.
|
이상반응 |
XALKORI |
화학요법 |
||
|
전체 등급 6불과반응 |
3-4등급 |
모든 등급 |
3-4등급 |
|
|
신경계 |
||||
|
미각장애 |
26 |
0 |
9 |
0 |
|
현기증† |
22 |
1 |
8 |
0 |
|
실신 |
3 |
3 |
0 |
0 |
|
안과 |
||||
|
시력장애‡ |
60 |
0 |
9 |
0 |
|
심장 |
||||
|
심전도 QT 연장 |
5 |
3 |
0 |
0 |
|
서맥§ |
5 |
0 |
0 |
0 |
|
검사치 |
||||
|
체중감소 |
10 |
1 |
4 |
0 |
|
소화기계 |
||||
|
설사 |
60 |
0 |
19 |
1 |
|
구역질 |
55 |
1 |
37 |
1 |
|
구토 |
47 |
1 |
18 |
0 |
|
변비 |
42 |
2 |
23 |
0 |
|
소화불량 |
8 |
0 |
3 |
0 |
|
감염 |
||||
|
상기도 감염¶ |
26 |
0 |
13 |
1 |
|
호흡기, 흉부 및 종격 |
||||
|
폐 색전증# |
6 |
5 |
2 |
2 |
|
전신 |
||||
|
부종Þ |
31 |
0 |
16 |
0 |
XALKORI를 투여받은 환자에서 전체 발생률이 1~30% 사이였던 추가적인 이상반응에는 식욕 감퇴(27%), 피로(27%), 신경병증(19%; 지각 이상, 보행 장애, 감각 저하, 근력 약화, 신경통, 말초신경병증, 하지 불편감, 말초감각 신경병증, 다발성 신경병증, 피부 화끈감), 발진(9%), ILD(4%; 급성 호흡곤란 증후군, ILD, 폐렴), 신장 낭종(4%), 식도염(2%), 간부전(1%), 혈중 테스토스테론 감소(1%; 성기능 저하증)가 포함되었다.
XALKORI를 투여받은 환자의 1% 미만에서 발생한 임상적으로 유의한 이상반응에는 광과민반응(0.4%)이 포함되었다.
| XALKORI를 투여받은 환자에서 화학요법군(등급 있음: 72%; 3등급: 0%; 4등급: 0%)에 비해 크레아티닌 증가(등급 있음: 96%; 3등급: 1%; 4등급: 0%)가 추가적인 실험실 검사치 이상이었다. | ||||
|
XALKORI |
화학요법 |
|||
|
실험실 검사치 이상 |
등급 있음 |
3-4등급 |
등급 있음 |
3-4등급 |
|
혈액학 |
||||
|
림프구 감소증 |
51 |
9 |
60 |
25 |
|
호중구 감소증 |
49 |
12 |
28 |
12 |
|
화학 |
||||
|
ALT 증가 |
76 |
17 |
38 |
4 |
|
AST 증가 |
61 |
9 |
33 |
0 |
|
저인산혈증 |
28 |
5 |
25 |
6 |
|
저칼륨혈증 |
18 |
4 |
10 |
1 |
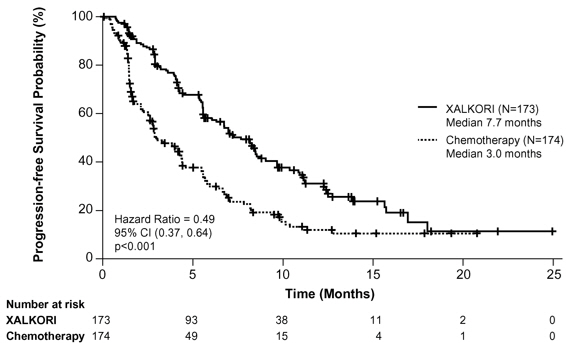
ROS1 양성 전이성 NSCLC – 연구 3 (PROFILE 1001)
ROS1 양성 전이성 NSCLC 환자 50명을 대상으로 평가한 연구 3의 XALKORI 안전성 프로파일은 ALK 양성 전이성 NSCLC 환자(n=1669)에서 평가된 XALKORI의 안전성 프로파일과 대체로 일치하였다. 시력장애는 연구 3 환자의 92%에서 발생하였으며, 90%는 1등급, 2%는 2등급이었다. XALKORI 노출의 중앙값은 34.4개월이었다.
전이성 NSCLC 환자에서의 선택된 이상반응 설명
시각 장애: 시각 장애는 가장 흔하게 시력 저하, 광시증(photopsia), 흐린 시야 또는 유리체 부유물의 형태로 1719명의 환자 중 63%에서 발생했습니다. 이들 환자의 대다수(95%)는 Grade 1의 시각적 이상반응을 경험했습니다. Grade 3 시력 저하 환자는 0.8%, Grade 4 시력 저하 환자는 0.2%였습니다. Visual Symptom Assessment Questionnaire (VSAQ-ALK)에 따르면, 연구 1과 2에서 XALKORI로 치료받은 환자들은 화학요법으로 치료받은 환자들에 비해 시각 장애 발생률이 더 높았습니다. 시각 장애의 발병은 일반적으로 약물 투여 첫 주 이내에 발생했습니다. 연구 1과 2의 XALKORI 투여군 환자 중 대다수(>50%)는 VSAQ-ALK 설문지에서 포착된 바와 같이 일상 활동에 경미하거나 영향이 없는(최대 점수 10점 중 0-3점) 시각 장애를 주 4-7일 동안 최대 1분간 경험했다고 보고했습니다.
신장 낭종: 1719명의 환자 중 3.0%가 신장 낭종을 경험했습니다. XALKORI로 치료받은 환자의 신장 낭종 대부분은 복합적이었습니다. 일부 사례에서는 농양 형성을 시사하는 영상 특징과 함께 신장을 넘어 국소적인 낭종 침습이 발생했습니다. 그러나 임상시험에서 미생물 검사로 확인된 신장 농양은 없었습니다.
신장 독성: 임상시험에서 XALKORI를 투여받은 ALK 양성 진행성 NSCLC 환자의 추정 사구체 여과율(eGFR)은 기저 중앙값 96.42 mL/min/1.73 m2(n=1681)에서 2주 후 중앙값 80.23 mL/min/1.73 m2(n=1499)로 감소했습니다. 12주에서 104주까지의 치료 기간 동안 중앙 eGFR에는 임상적으로 유의한 변화가 없었습니다. XALKORI 마지막 투여 4주 후 중앙 eGFR이 약간 증가했습니다(83.02 mL/min/1.73 m2). 전체적으로 76%의 환자에서 eGFR이 <90 mL/min/1.73 m2로 감소했고, 38%의 환자에서 eGFR이 <60 mL/min/1.73 m2로 감소했으며, 3.6%의 환자에서 eGFR이 <30 mL/min/1.73 m2로 감소했습니다.
재발성 또는 불응성, 전신 ALK 양성 ALCL – 연구 ADVL0912
연구 ADVL0912에서 XALKORI의 안전성을 평가했으며 [참조 임상 연구 14.2], 여기에는 적어도 한 번의 전신 요법 후 재발성 또는 불응성, 전신 ALCL 환자 26명이 포함되었습니다. 적격 환자는 1세 이상 21세 이하였고, 절대 호중구 수 ≥1000/mm3(골수 침범 시 750/mm3), 혈소판 수 ≥75,000/mm3(골수 침범 시 25,000/mm3), creatinine clearance ≥70ml/min/1.73m2, QTc ≤480 msec가 요구되었습니다. 이 연구에서는 ALT가 정상 상한치(ULN)의 >2.5배, bilirubin이 ULN의 ≤1.5배, 그리고 중추신경계 종양이 있는 환자는 제외되었습니다.
ALCL 환자는 질병이 진행되거나 허용할 수 없는 독성이 나타날 때까지 XALKORI 165 mg/m2 또는 280 mg/m2를 하루 두 번 경구 투여받았습니다. 중앙 노출 기간은 5.4개월(범위 1.8, 82.3개월)이었으며, 46%의 환자가 최소 6개월 동안, 35%의 환자가 최소 12개월 동안 치료를 받았습니다.
XALKORI로 치료받은 ALCL 환자 중 35%에서 중대한 이상반응이 발생했습니다. 가장 흔한 중대한 이상반응은 호중구 감소증(12%)과 저혈압(8%)이었습니다.
ALCL 환자 중 각각 77%와 19%에서 용량 중단 및 용량 감량이 발생했습니다. 이상반응으로 인해 8%의 환자에서 XALKORI 투여가 중단되었습니다.
실험실 이상을 제외하고 가장 흔한 이상반응(≥35%)은 설사, 구토, 오심, 시각 장애, 두통, 근골격 통증, 구내염, 피로, 식욕 감소, 발열, 복통, 기침 및 가려움증이었습니다.
가장 흔한 Grade 3 또는 4 실험실 이상(≥15%)에는 호중구 감소증, 림프구 감소증 및 혈소판 감소증이 포함되었습니다. Grade 4 실험실 이상(≥15%)에는 호중구 감소증(62%), 림프구 감소증(35%) 및 혈소판 감소증(19%)이 포함되었습니다.
선별된 이상반응이 표 13에 요약되어 있습니다.
| 이상반응은 NCI CTCAE version 4.0을 사용하여 등급이 매겨졌습니다. | ||
|
||
|
이상반응 |
XALKORI |
|
|
모든 등급 |
3-4등급 |
|
|
혈액 및 림프계 장애* |
||
|
호중구감소증† |
100 |
77 |
|
림프구감소증‡ |
58 |
38 |
|
빈혈 |
54 |
3.8 |
|
혈소판감소증§ |
38 |
19 |
|
위장관계 장애 |
||
|
설사 |
92 |
12 |
|
구토 |
92 |
3.8 |
|
구역 |
77 |
3.8 |
|
복통 |
50 |
0 |
|
구내염¶ |
46 |
8 |
|
변비 |
31 |
0 |
|
신장 장애* |
||
|
혈중 크레아티닌 증가 |
100 |
0 |
|
검사치 이상* |
||
|
ALT 증가 |
81 |
3.8 |
|
AST 증가 |
65 |
3.8 |
|
저칼슘혈증 |
62 |
3.8 |
|
저알부민혈증 |
54 |
0 |
|
고혈당증 |
46 |
0 |
|
저마그네슘혈증 |
46 |
0 |
|
저혈당증 |
35 |
0 |
|
저칼륨혈증 |
31 |
3.8 |
|
고마그네슘혈증 |
27 |
0 |
|
고칼륨혈증 |
23 |
0 |
|
신경계 장애 |
||
|
두통 |
58 |
3.8 |
|
미각 장애 |
23 |
0 |
|
현기증 |
23 |
0 |
|
안과 장애 |
||
|
시력 장애# |
65 |
0 |
|
근골격계 장애 |
||
|
근골격계 통증Þ |
58 |
12 |
|
전신 장애 |
||
|
피로 |
46 |
0 |
|
발열 |
38 |
0 |
|
부종ß |
27 |
0 |
|
오한 |
23 |
0 |
|
대사 및 영양 장애 |
||
|
식욕 감퇴 |
42 |
0 |
|
피부 및 피하 조직 장애 |
||
|
가려움 |
35 |
0 |
|
발진à |
23 |
0 |
|
감염 |
||
|
상기도 감염è |
31 |
0 |
|
호흡기계 장애 |
||
|
기침 |
35 |
0 |
|
알레르기성 비염 |
23 |
0 |
|
혈관 장애 |
||
|
고혈압 |
31 |
0 |
XALKORI 치료 환자의 20% 미만에서 임상적으로 관련된 이상반응은 다음과 같습니다:
- •
- 심장 장애: 서맥(19%), 심전도 QT 연장(8%)
- •
- 혈관 장애: 저혈압(19%)
- •
- 검사치 이상: 알칼라인 인산분해효소 증가(19%), 과나트륨혈증(19%), GGT 증가(8%), 저나트륨혈증(12%), 고뇨산혈증(12%), 저인산혈증(12%)
- •
- 신경계 장애: 말초 신경병증(12%)
- •
- 소화기 장애: 식도염(8%)
- •
- 혈액 및 림프계 장애: 발열성 호중구감소증(3.8%)
- •
- 근골격계 장애: 근육 약화(8%)
- •
- 신장 장애: 급성 신손상(8%)
절제 불가능, 재발성 또는 불응성 ALK-양성 염증근육종(IMT)
연구 ADVL0912
XALKORI의 안전성은 절제 불가능, 재발성 또는 불응성 IMT 환자 14명을 포함한 연구 ADVL0912에서 평가되었습니다 [임상시험 정보(14.3) 참조].
IMT 소아 환자는 경구 XALKORI 280mg/m2을 1일 2회 질병 진행 또는 허용 불가능한 독성이 나타날 때까지 투여받았습니다. 2명의 환자는 더 낮은 용량을 투여받았습니다. XALKORI 치료 기간 중앙값은 20.5개월이었습니다.
IMT 소아 환자 중 7%에서 중대한 이상반응이 발생했습니다. 가장 흔한 중대한 이상반응은 호중구감소증과 저혈압이었습니다(각각 7%).
이상반응으로 인해 71%의 환자에서 투여 중단이 있었고, 29%의 환자에서 용량 감소가 있었습니다. 29%의 환자에서 영구 중단되었습니다.
가장 흔한 이상반응(≥35%)은 구토, 구역, 설사, 복통, 발진, 시력 장애, 상기도 감염, 기침, 발열, 근골격계 통증, 피로, 부종, 변비 및 두통이었습니다.
가장 흔한 3급 또는 4급 실험실 이상반응(>15%)은 호중구감소증이었습니다.
표 14와 표 15는 ADVL0912 연구에서 각각 이상반응과 실험실 이상을 요약합니다.
| 이상반응은 NCI CTCAE 버전 4.0을 사용하여 등급을 매겼습니다. | ||
|
이상반응 |
XALKORI |
|
|
전체 등급 |
3-4 등급 |
|
|
위장관계 장애 |
||
|
구토 |
93 |
0 |
|
구역질 |
86 |
0 |
|
설사 |
64 |
7 |
|
복통* |
57 |
0 |
|
변비 |
36 |
0 |
|
구내염† |
29 |
0 |
|
감염 |
||
|
상기도 감염‡ |
64 |
0 |
|
피부 감염 |
29 |
0 |
|
호흡기계 장애 |
||
|
기침§ |
64 |
0 |
|
알레르기성 비염 |
29 |
0 |
|
피부 및 피하 조직 장애 |
||
|
발진¶ |
57 |
0 |
|
전반적 장애 |
||
|
발열 |
50 |
0 |
|
피로 |
43 |
0 |
|
부종# |
36 |
7 |
|
통증Þ |
29 |
0 |
안구 장애
시력 장애ß
50
0
근골격계 장애
근골격계 통증à
43
0
신경계 장애
두통
36
0
대사 및 영양 장애
식욕 감소
29
0
혈관 장애
저혈압
21
7
XALKORI로 치료받은 IMT 소아 환자의 20% 미만에서 임상적으로 관련된 이상반응은 다음과 같습니다:
심장 장애: 서맥(14%), 심전도 QT 연장(7%)
위장관 장애: 소화불량(14%), 식도염(7%)
혈관 장애: 고혈압(14%)
신경계 장애: 말초 신경병증(7%)
혈액 및 림프계 장애: 발열성 호중구감소증(7%)
근골격계 장애: 근육 약화(7%)
|
실험실 이상 |
||
|
모든 등급 |
3-4등급 |
|
|
화학 |
||
|
크레아티닌 증가 |
100 |
0 |
|
칼슘 감소 |
36 |
0 |
|
마그네슘 증가 |
23 |
0 |
|
인산염 감소 |
15 |
0 |
|
혈액학 |
||
|
호중구 감소 |
64 |
36 |
|
간 기능 |
||
|
ALT 증가 |
36 |
0 |
연구 A8081013
ALK-양성 IMT 성인 환자에 대한 XALKORI의 안전성은 중간값 연령 38세(범위 23-73세)의 IMT 환자 7명을 포함한 연구 A8081013에서 평가되었습니다 [임상시험 정보 (14.3) 참조]. 이 환자군의 안전성 프로파일은 일반적으로 ALK-양성 또는 ROS1-양성 NSCLC 환자에서 평가된 XALKORI의 안전성 프로파일과 일치했습니다.
가장 흔한 이상반응(≥20%)은 시력 장애, 구토 및 부종이었습니다.